BioINwatch
(BioIN + Issue + watch) : 바이오 이슈를 빠르게 포착하여 정보 제공2021년 미국 FDA에서 50개 신약 승인
- 등록일2022-04-13
- 조회수4880
- 분류레드바이오 > 의약기술
-
발간일
2022-04-12
-
키워드
#FDA#신약#new drug
- 첨부파일
-
차트+
?
차트+ 도움말
BioINwatch(BioIN+Issue+Watch): 22-26
2021년 미국 FDA에서 50개 신약 승인
◇ 2021년 COVID-19 팬데믹 지속에도 불구하고 미국 FDA는 50개 신약을 승인하며, 2018년 59개, 2020년 53개에 이어 역대 세 번째로 많은 승인 건수를 기록. 특히 생물의약품은 14개가 허가되며 2017년(17개) 이후 가장 많이 승인
▸주요 출처: Nature Reviews Drug Discovery, 2021 FDA drug approvals, 2022.1.4; FDA, New Drug Therapy Approvals 2021
▣ 2021년 미국 FDA CDER(Center for Drug Evaluation and Research, 의약품평가연구센터)가 허가한 신약은 총 50건으로, 2018년 59건과 2020년 53건에 이어 역대 세 번째로 높은 수치를 기록
○ 2021년 승인 신약 중 암젠의 첫 KRAS* 표적치료제인 루마크라스(LUMAKRAS, 성분명 소토라십)와 바이오젠의 알츠하이머 치료제인 애드유헬름(ADUHELM, 성분명 아두카두맙)을 주목
* 종양 형성에 관여하는 RAS 유전자 중 하나인 KRAS의 G12C 변이
- 루마크라스는 2027년까지 16억 달러의 매출로, 블록버스터(연 10억 달러 이상 판매) 의약품이 될 것으로 전망
- 애드유헬름은 신약 승인 이후 상당한 규제에 직면
※ 임상3상에서 의료적 효능을 확인하고 있으며, 임상에 참여하는 환자로 보험 적용이 제한. 연간 치료비용은 5만 6천 달러로 4년 동결에 합의
< 연도별 미국 FDA 신약 승인 현황 : 2012-2021 >
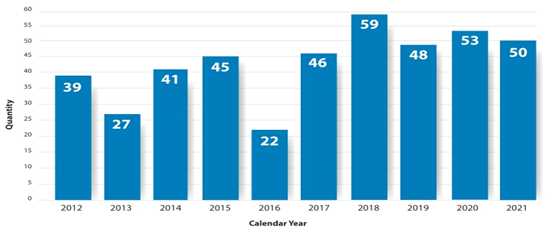
¶ FDA CBER(Center for Biologics Evaluation and Research, 생물의약품 평가연구센터)에서 추가 승인한 mRNA 백신 및 CAR-T(Chimeric Antigen Receptor T-Cell therapy), 긴급사용 승인된 경구용 코로나19 항바이러스제는 제외
출처 : FDA CDER, New Drug Therapy Approvals 2021, 2022
○ 2021년 승인 신약 중 74%(37개)가 하나 이상의 신속 심사 프로그램을 통해 승인 획득
< 2021년 신속 심사 프로그램별 승인 건수 >
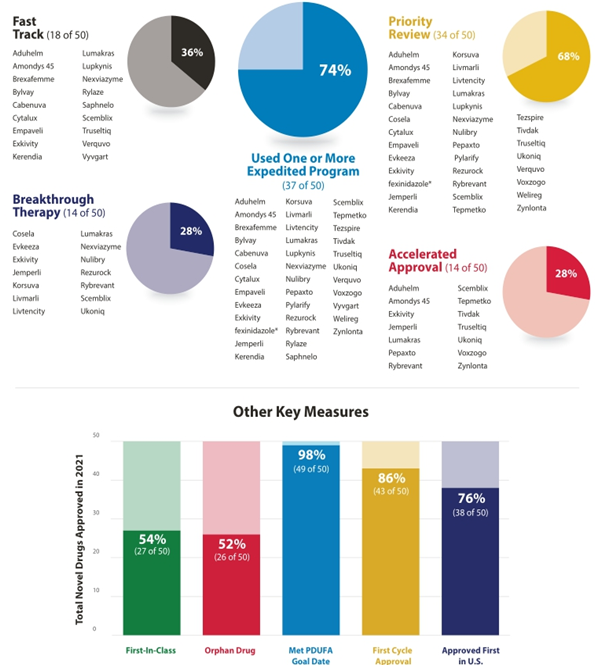
¶ Fast Track(신속심사), Breakthrough Therapy(획기적 치료제), Priority Review(우선심사), Accelerated Approval(가속승인), First-in-Class(혁신신약), Orphan Drug(희귀의약품), Approved First in U.S(미국에서 최초 승인), First Cycle Approval(추가 자료 제출 없이 최초 허가 신청서만으로 승인 획득), PDUFA (Prescription Drug User Fee Act, 신약 승인 절차에 자금을 지원하기 위해 의약품 제조업체로부터 수수료를 징수)
출처 : FDA CDER, New Drug Therapy Approvals 2021, 2022
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향


 BioINwatch22-26(4.12)●2021년 미국 FDA에서 50개 신약 승인.pd...
BioINwatch22-26(4.12)●2021년 미국 FDA에서 50개 신약 승인.pd...
 < 연도별 미국 FDA 신약 승인 현황 : 2012-2021 >
< 연도별 미국 FDA 신약 승인 현황 : 2012-2021 >