특허동향
중국의 최근 항암제 허가 및 신속허가 지정 현황
- 등록일2021-08-27
- 조회수4286
- 분류특허동향 > 기타 > 기타
-
자료발간일
2021-08-23
-
출처
한국바이오협회
- 원문링크
-
키워드
#항암제 허가#신속허가
- 첨부파일
중국의 최근 항암제 허가 및 신속허가 지정 현황
◈목차
1. 중국의 신속허가 프로그램
2. 중국의 최근 항암제 허가 현황
◈본문
1. 중국의 신속허가 프로그램
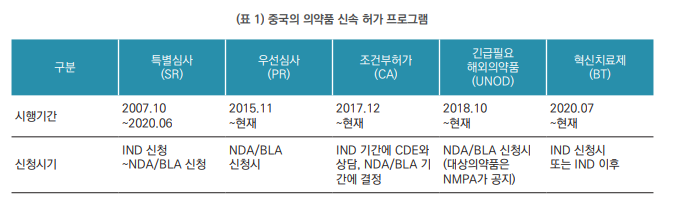
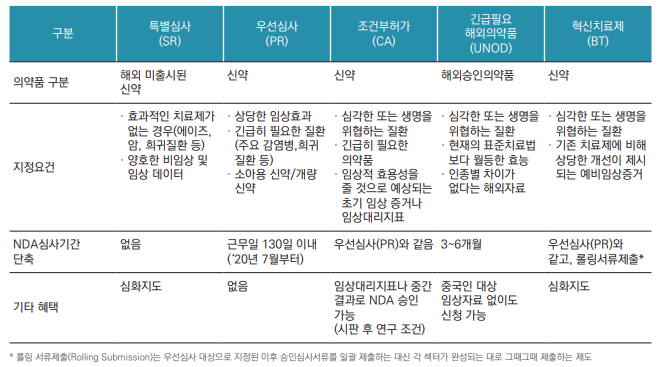
● 중국에서는 우선심사, 조건부 허가, 긴급히 필요한 해외 의약품, 혁신치료제와 같은 신속허가 프로그램(Expedited Programs)을 운영하고 있으며, 대부분 심각하거나 생명을 위협하는 질병에 대한 신약이나 긴급히 도입이 필요한 의약품을 대상으로 하고 있음.
● 우선심사(Priority Review)는 2015년 11월부터 시행되고 있으며 혁신의약품 및 제네릭의약품의 허가심사 지연을 해결하는 것에서 벗어나 임상적 혜택이 있는 혁신치료제 허가를 촉진하고 있음. 아래 표의 내용은 개정 의약품 등록 규정(2020년 7월 시행)에 근거하여 시행되고 있는 내용으로 이전에는 IND 신청과 NDA/BLA 신청 사이에 가능하였으나 지금은 NDA/BLA 신청시에만 가능함. 우선심사로 지정되면 작업일 130일 이내에서 심사가 완료될 수 있도록 하고 있음.
● 조건부 허가(Conditional Approval)는 2017년 12월부터 시행되고 있으며, IND 심사기간에 규제기관(NMPA) 산하 의약품평가센터(CDE)와 조건부 허가 가능성에 대해 상담하고, NDA 심사기간에 조건부 허가 여부가 결정됨. 심사기간은 우선심사에 준해 적용됨.
● 긴급히 필요한 해외 의약품(Urgently Needed Overseas Drugs)은 2018년 10월부터 시행되고 있으며, 규제기관 (NMPA)이 적용 대상 의약품 목록을 공지하며, NDA/BLA 심사기간은 3~6개월로 정하고 있음.
● 혁신치료제(Breakthrough Therapy)는 2020년 7월부터 시행되고 있으며, IND 신청과 동시에 혁신치료제 지정을 신청할 수 있음. 심사기간은 우선심사에 준해 적용됨.
● 2007년 10월부터 시행되던 특별심사(Special Review)는 2020년 6월 종료됨. 특별심사는 IND 심사기간을 90일에서 80일로, NDA 심사기간을 150일에서 120일로 줄여주기는 했으나 실제적으로는 심사기간이 연장되어 실제 심사기간 단축은 미미했던 것으로 평가됨.
2. 중국의 최근 항암제 허가 현황
● 중국 규제기관(NMPA)에서 2016년~2020년 사이 수입허가 또는 제조허가된 항암제 목록임.
● 허가된 항암제에 적용된 각각의 신속허가 프로그램 지정 여부를 표시하였으며, 특정 항암제가 여러가지 적응증으로 허가 받았을 경우에는 최초 적응증의 NDA/BLA 승인일을 적용함.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보


 [KBIOIS Vol.45] 중국의 최근 항암제 허가 및 신속허가 지정 현황...
[KBIOIS Vol.45] 중국의 최근 항암제 허가 및 신속허가 지정 현황...