정책동향
‘영국 생명과학 2015’ 수정보고서
- 등록일2009-03-25
- 조회수10481
- 분류정책동향 > 기타 > 기타
-
자료발간일
2009-03-25
-
출처
정교민/클러링하우스
-
원문링크
-
키워드
#영국#BIGT#UK#영국생명과학 2015
- 첨부파일
Bioin스페셜 WebZine 2009년 9호
‘영국 생명과학 2015’ 수정보고서
정교민 클러링하우스
서론
□ 배경
2003년 ‘생명과학 혁신 및 성장팀’ (Bioscience Innovation & Growth Team; BIGT)은 영국 의료 생명과학 2015년 비전을 담고 있는 ‘생명과학 2015’ 보고서 (이하 기존 ‘생명과학 2015’로 구별한다)를 제출하였다. 보고서 제출 이후 5년이 지난, 2008년 1월 영국정부는 기존 보고서에서 제안하였던 목표를 새롭고 활력을 갖도록 BioIndustry Association (BIA)에게 별도 작업을 지시하였다. David Cooksey 경(벤처투자가)을 회장으로 하는 수정보완팀 (BIGT Review and Refresh; BIGTR2)은 기존 ‘생명과학 2015’의 비전에 따라 진전된 실태를 조사하고, 영국 의료 생명과학의 미래경쟁력을 추진할 새로운 아이디어와 제안을 모색한다.
기존 ‘생명과학 2015’의 목표는 의료 생명산업을 지원하여 세계 무대 (global stage)에서 선도적 위치를 확보하고, 이로써 국민 건강을 개선하고 국가 부를 증진시키는 것이다. 전자를 달성하기 위해서 임상시험 하부구조 강화와 혁신적인 치료방법에 대한 조기 접근방법을 공고히 마련하며, 후자를 달성하기 위해서 Amgen과 같은 대규모 기업을 중심으로 하는 기업들의 critical mass를 확보하여 고성장 고부가가치, 지식기반의 생명과학 산업을 육성하는 것이었다.
이를 위해 기존 ‘생명과학 2015’에서 영국정부가 조성해야할 과제로
○ 다양하고 지속가능한 생명과학 섹터를 창출하기 위해, 규모와 성과 면에서 미국 다음가는
○ 다양하고 지속가능한 생명과학 섹터를 창출하기 위해, 규모와 성과 면에서 미국 다음가는
수준의 대기업
○ 세계에서 가장 효율적이고 효과적인 임상시험 환경
○ 환자에게 조기에 혜택을 제공하는 생명과학 혁신을 지원하기 위한 보건의료 시스템, 규제, 사업
○ 세계에서 가장 효율적이고 효과적인 임상시험 환경
○ 환자에게 조기에 혜택을 제공하는 생명과학 혁신을 지원하기 위한 보건의료 시스템, 규제, 사업
환경을 제안하였다.
또한 DNA 구조 발표 50주년을 기념하기 위해, 기존 ‘생명과학 2015’ 에서는 유전자, 유전학, 생명공학에 관련된 미디어 관심에 부응하여 생명공학의 미래에 대한 낙관론을 극대화해야 하고, 이에 덧붙여 2000년에 발표한 인간유전체프로젝트 (Human Genome Project)가 인류 건강에 기여한다는 기대를 지속시켜야 한다는 것을 강조하였다.
그러나 경제상황이 나빠져 투자가들이 생명과학기업에 투자하는 것을 주저하고 있으며, 대부분의 기업이 주식시장에서 퇴출되는 등 주식시장이 닫히고 있음을 간파하지 못했다. 정부나 생명과학 기업들은 이러한 자금 경색을 막을 수는 없다. 다만 몇 년 내 1억$ 상당의 블록버스터들이 특허기간만료로 보호받지 못하는 상황에 직면하고 있는 의약품산업은 제3자로부터 파이프라인 제품들이 공급되기를 더욱더 기대하고 있다.
□ 그때는 그때이고, 지금은 지금이다.
2009년의 시각에서 보면 기존 ‘생명과학 2015’의 비전은 매우 낙관적이어서, 급하게 수정-보완할 필요가 있다.
Neutec Pharma사가 Novartis에, Piramed Ltd.사도 Roche에 흡수되는 등많은 생명공학기업들이 해외기업에게 흡수되거나 파산하고 있다. 초기 생명공학기업들의 사업모델은 제품을 개발하여 제약회사에 라이센스하는 것이었는데, 기업 전체를 매각하게 되는 결과를 가져왔다. 투자자 입장에서 이러한 매각은 바람직할 수 있으나, 이러한 현상이 자주 일어난다면 (정부 입장에서) 추후 투자를 장려하기 어려워진다. 그리고 주식공모 (Initial Public Offering; IPO) 시장이 폐쇄되면서, 새로운 기업이 시장에 진입하는 것이 점차 감소하여 영(zero)에 이르렀다.
생물학적 제제를 포함한 의약품은 세계 시장을 형성하고 있으며, 미국은 세계 시장의 절반을 차지할 정도로 매우 중요한 지역이다. 미국에 진출하거나, 영국 내에서 의약품을 판매하는 경우 엄격한 규제절차를 따라야 한다.
국립임상연구소 (National Institute for Health and Clinical Excellence; NICE)는 산업과 환자들에게 유용한 기관이며, 의료기술평가 (Health Technology Appraisal) 면에서 세계시장 진출에 필요한 존재이다. 그러나 2006년 NICE는 임상에 성공한 생물학 제제인 Velcade, Avastin, Eribitux에 대해 단지 약가효율 면에서 용도를 제한하였으며, 또한 의료보험 (NHS)에서도 변화에 저항하려는 성향 때문에 신약 도입이 늦어지고 있다. 의약품에 대한 엄격한 규제 때문에 기업을 설립하는 환경에 영향을 미쳐 이들 규제기관이 혁신제품의 용도를 확대하려는 기업 입장에서 4번째 걸림돌로 생각할 정도이며, 점차 엄격해지는 규제 때문에 영국에서 개발되는 제품 파이프라인이 점차 줄어들고 있다.
이러한 후퇴현상의 또 다른 예로 NHS에 의해 5년 주기로 의약품가격규제방안 (Pharmaceutical Pricing Regulation Scheme; PPRS)에 의해 의약품 가격이 갑작스럽게 협상되는 것이다. 다행히 이 제도는 융통성이 도입되어, BIA와 영국제약산업협회 (the Association of the British Pharmaceutical Industry; ABPI)가 환영하고 있다.
오늘날 의약품 가격은 제약이나 생명공학이 직면한 가장 중요한 이슈의 하나이다. 연구개발은 점점 더 비싸지고 있다. Tufts Center for the Study of Drug Development (미국) 자료에 따르면, 신약이 시장에 나타날 때까지 실패비용 (cost of failure)까지 포함한 개발비용은 8억$이다. 그러나 사회적으로 이러한 혁신 비용을 기꺼이 지불하겠는가?
경쟁력을 갖기 위해 차별화된 임상결과를 제공하는 기관으로 NHS가 변화하는 것은 기대하는 바와 같은 효과를 나타내지 못한다. 유로화 가치가 높아지고, 유럽임상시험승인제도 (EU Clinical Trials Directive)가 실시되면서, 유럽에서의 임상은 다른 국가로 빠져나갔다.
따라서 상기 승인제도는 연구기관이나 중소기업에게 어려움을 주려는 것이었지만, 주요 제약기업 또는 big pharma는 승인제도의 목표인 조화 (harmonization) 면에서 임상시험 진행에 어려움을 주고 있다. 이러한 모든 것이 생명공학산업이 영국에서 정착하는데 점점 불리하게 작용하고 있다.
그럼에도 불구하고 우리는 2008년 Darzi Review (Higher Quality Care for All- NHS Next Stage Review)를 도입을 환영한다. 건강관련 정책기관 (Strategic Health Authorities)은 혁신을 촉진하도록 법적 의무룰 확보하고 각 Trust마다 확대되기를 기대한다. 정부, NICE, 제약회사가 혁신에 동반 협력하도록 Pharmaceutical Innovation Package가 도입되어야 한다. 이러한 것들에 의해 올바른 방향으로 움직일 것이다.
생명과학분야는 보다 우호적인 금융, 규제, 임상 환경을 필요로 하며, 기술과 인력자원은 공중건강 혁신을 위해서는 필수적이다. 즉 신약개발에 있어서 경험이 많은 경영과 고급 과학자를 필요로 한다. 그럼에도 불구하고, 영국 출신의, 유능한 관리자나 과학자들이 해외에서 일하고 있다. 이 사람들이 영국으로 되돌아올 수 있도록 유인하는 프로그램도 필요하다.
대학에서 배출되는 신규 졸업생들이 취업하기 어려우므로, 기능을 강화하는 훈련 프로그램으로 Semta의 Bioscience Sector Skills Agreement, 2009년부터 시작할 Pilot Leadership Program (Semta와 BIA이 개발)이 운영되고 있다.
□ 영국 파이프라인
한 국가의 의학 생명공학 섹터의 경쟁력을 판단하는 주요한 기준은 전임상과 임상단계의 파이프라인 제품의 수이다. Ernst & Young 보고서에 따르면, 영국은 유럽에서 가장 많은 파이프라인 제품을 가지고 있다. 그러나 영국에서는 최근 감소하고 있는 반면, 독일, 프랑스, 덴마크의 비중이 높아지고 있다.모든 임상단계를 진행하고 있는 제품의 수를 보여주는 도1에 따르면, 2002년에 영국은 선두이었지만 2007년에는 독일과 프랑스가 영국을 추격하였으며, 곧 추월할 것이다. 이러한 경향은 아래표에서 나타난다.
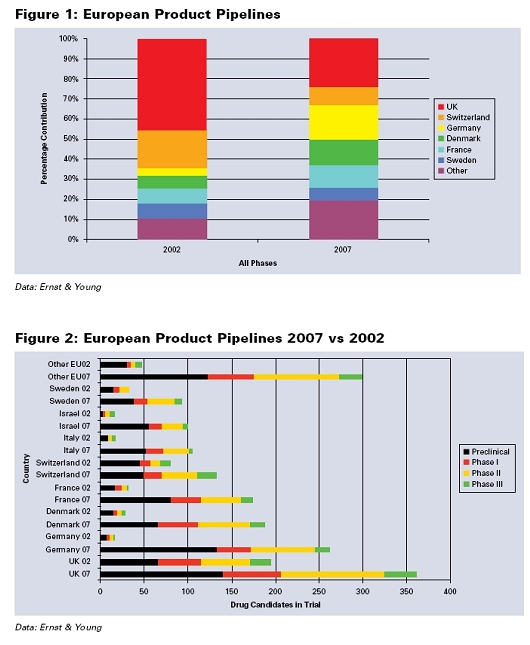
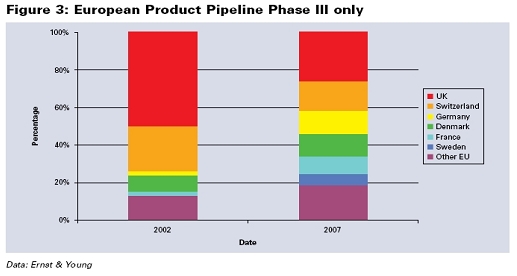
영국에는 예를 들어 Shire사는 2006년 7월 Elaprase (헌팅턴씨 증후군)과 2007년 2분기 Vyvanase (주의력결핍장애) 등 많은 제품들이 개발되고 있으며, 잘 나가는 기업으로 Antisoma, Ark Therapeutics, Renovo, Vectura 등이 있다. 그러나 2007년 Frova (편두통 치료제), Amarin사의 Miraxion (헌팅턴씨 증후군) 등이 잇달아 미국 식약청에 의해 거절되었다.
□ 새로운 비전
영국은 정부로부터 연구 위탁이나 지원에 의해 아직도 세계수준의 과학기반을 확보하고 있다. 예를들어, University College London (UCL)은 최근 유전자치료 기술로 사람의 시력을 회복시켰다. 이것은 기술발전의 최고 사례가 되고, 무엇보다 산업화가 가능한 것이다.
big pharma는 신약발굴에 대한 이러한 혁신에서 이득을 취할 수 있을 것이다. 정부는 이러한 환경을 창조하는데 도움을 주어야 하고, big pharma에 대한 긍정적인 지원은 생물산업분야를 활기 넘치게 만들 것이다. 그리하여 영국에서 생명과학의 건전하고 새로운 비즈니스 모델에 대한 기회가 마련된다.
이러한 영국의 경쟁력에 관한 제안은 BIGTR2가 정리하려는 것이고, 다양한 분야에서 지속가능한할 수 있는 분야를 육성하려는 비전을 찾으려는 것이다.
1장 ‘생명과학 2015’실태조사
기존 생명과학 2015 에서 의학 생명공학의 비전을 6개 테마에서 70개를 제안하였다.
이에 대해 본 팀은 실태를 조사하였으며, 이를 통하여 어떤 분야에서는 이미 달성되거나 진행되고 있으며, 다른 분야는 제한적이거나 기대에 어긋난 상황이다. 심지어 원안에 비하여 다른 방향으로 가고 있는 경우도 있었다. 따라서 몇 가지 제안은 거절하고, 이러한 제안이 부적합하다는 것을 받아들였다.
이 장에서 원래 보고서에서의 위치와 현재 우리 위치를 정리한다. 그래서 생명공학 활력에 초점을 맞추어 기존 생명과학 2015의 다시 조정한다.
□ 배경
□ 배경
기존 생명과학 2015 에서는 2015년까지 영국은 생명공학분야에서 세계적 리더로서의 지위를 보존한다. 이를 위해 영국은 다음을 창조해야 한다.
- 다양하고, 지속가능한 생명공학 섹터를 창출하기 위해, 규모와 성과에서 미국 다음가는 수준의
- 다양하고, 지속가능한 생명공학 섹터를 창출하기 위해, 규모와 성과에서 미국 다음가는 수준의
대기업)
- 임상시험을 진행하기 위한 효율적인 조직
- 환자에게 조기에 혜택받을 수 있도록 혁신을 지원하는 보건의료 시스템, 규제, 사업 환경
- 임상시험을 진행하기 위한 효율적인 조직
- 환자에게 조기에 혜택받을 수 있도록 혁신을 지원하는 보건의료 시스템, 규제, 사업 환경
이를 위해 6개 분야로 구분하고
○ National Clinical Trials Agency (NCTA)을 창설하고, 이를 통해 환자에게 도움이 되도록
○ National Clinical Trials Agency (NCTA)을 창설하고, 이를 통해 환자에게 도움이 되도록
NHS와 산업체와의 협력관계를 만들자. 이때 NCTA는 보건부에서 지원하며, Research Counils
UK와 협력하고, NHS 내에 임상시험에 대해 우수연구를 지원한다.
○ 혁신에 부합하는 공공/ 규제환경을 조성하자. 산업체, 규제기관, 정부의 효율적인 협력으로 영국
에서 혁신적인 신약을 개발하거나, 승인 또는 사용하는 것에 대해 규제관련 지원을 개선한다.
○ 적절하고 충분한 자금이 마련된다는 것을 확신시키자. 이로써 우선구매권 (pre-emption rights)
○ 적절하고 충분한 자금이 마련된다는 것을 확신시키자. 이로써 우선구매권 (pre-emption rights)
나 공동투자 등을 통해 생명 공학기업의 유동성을 개선하며, 발굴된 아이디어와 산업자본을 연결
하는 투자 분위기를 조성한다.
○ 영국 내 생물공정 우수연구센터 (centers of excellence; COE) 등 네트워크를 창조하여 강한 생
○ 영국 내 생물공정 우수연구센터 (centers of excellence; COE) 등 네트워크를 창조하여 강한 생
물공정 섹터를 형성한다. 이들 센터는 숙련된 인력을 배출하고, edge research를 발전시키며
내부투자를 유도한다.
○ 두 개의 새로운 프로그램을 개발하여 생명과학에 필수인 다학제 교육을 지원하고, 고급 인력
○ 두 개의 새로운 프로그램을 개발하여 생명과학에 필수인 다학제 교육을 지원하고, 고급 인력
(과학자, 관리직)을 확보할 기반을 마련한다.
○ Bioscience Leadership Council (BLC)를 창설한다. 이들은 BIGT에서 제안한 내용을 구체화하
○ Bioscience Leadership Council (BLC)를 창설한다. 이들은 BIGT에서 제안한 내용을 구체화하
고, 정부와 산업과의 포럼을 조성한다.
□ 기존 '생명과학 2015' 보고서 발표 후 무슨 일이 일어났나?
각 분야를 구체적으로 설명하면,
1. 환자에게 도움이 되도록 NHS와 산업체와의 협력관계를 만들자.
1. 환자에게 도움이 되도록 NHS와 산업체와의 협력관계를 만들자.
주요협력기관으로
- The UK Clinical Research Collaboration (UKCRC),
- Best Research for Best Health (BRfBH)
- 보건부의 새로운 전략
- National Institute for Health Research (NIHR)
- The Office for Strategic Co-operation of Health Research
- The UK Clinical Research Collaboration (UKCRC),
- Best Research for Best Health (BRfBH)
- 보건부의 새로운 전략
- National Institute for Health Research (NIHR)
- The Office for Strategic Co-operation of Health Research
(OSCHR) 및 NIHR와 Medical Research Council (MRC)와의 연계 보건부는 이미 NHS 산하 연구직으로 업적 위주의 네트워크인 UK Clinical Research Network (UKCRN)을 구성하여, 공공, 자선기금산업분야에서 연구비가 지원되는 고품질의 임상시험 및 설계가 잘된 연구를 제공하는 하부구조를 제공하고 있는데, 2008년 10월까지 산업계에서 투자한 133개 임상시험을 UKCRN에서 수행하였다. NIHR Network Coordinating Center를 통해 국가적 측면에서 조정되고 있다.
중개연구 초기단계를 지원하기 위해서, NIHR Biomedical Research Centers and Units, Wellcome Trust Clinical Research Facility, NIHR/ Cancer Research UK Experimental Medicine Centers 등 세계정상수준의 platform이 신속하게 설립되고 있다. 이러한 시설은 MRC와 자선기금으로부터 투자 제휴 (coalition)에 의해 운영된다. (상세한 내용은 www.ukcrcexpmed.org.uk를 통해 얻을 수 있다.)
매출단계에 도달하면, NIHR/ NHS Connecting for Health Research Capability Program에 따라 NHS 환자 정보에 접근할 수 있다.

임상시험에 착수하는 과제는 산업측면에서 투자비용에 따른 효과를 높이는 관점에서 선발된 다음 진행되는데, 이러한 프로그램은 2004년부터 도입되었다.
준비되고 있는 프로그램도 많다. 예를 들어 웹을 이용하는 NHS의 승인/인가 관련 일괄처리 시스템 Integrated Research Application System (IRAS), 연구계약 관련된 Research Passport System, 계약 모델, 원가계산법, 규제 관련 governance advice service 등이 있다.
한편 예산투입비중이 높은 단계에 해당하는 NIHR Coordinated System for gaining NHS Permission (CSP)과 같은 시스템은 빨리 개선해야 한다.
한편 임상 교육기관에 대해 다양한 인센티브와 경력 체계를 마련되어야 한다. UKCRC Partners와 the Modernising Medical Careers (MMC) Enquiry는 개발한 새로운 통합 경력 체계는 보건부가 채택 하였다. 유사한 자격제도를 간호원과 관련 건강관련 직업에서 운영하고 있다. 또한 Capacity Development Program을 지원하고 있는 NIHR은 연구자 경력에 따라 연구자가 연구를 진행하는 것을 지원하고, 안내하며, 격려하는 체제를 운영할 수 있는 NIHR Faculty 제도를 마련하였다.

David Cooksey 경은 보고서 'Review of UK Health Research Funding' (2006)를 통해 영국 중개 연구의 격차를 지적하였고, 이에 따라 OSCHR을 설립하였으며, MRC와 NIHR을 통해 중개연구에 2010/11년까지 17억 파운드를 투자하기로 결정하였다.
OSCHR Translational Medicine Board, MRC, NIHR은 산업계와 협력하는 새로운 계획 (scheme)을 개발하였고, the Scottish Chief Scientist Office와 Welsh Office for Research & Development가 OSCHR Partner로 참여하였다.

세계적인 의약품산업에서 일반적인 임상시험 비중이 영국인 환자를 대상으로 하는 임상시험 비중이 6%에서 2%로 줄어들었다. 이는 상업분야에서 중요한 요인인 임상결과 승인과 환자 모집의 신속성이다.
따라서 상기 진전이 NHS의 R&D와 임상시험을 진행하는데 인센티브로 작용되지 못하고 있다.

- 각 NHS Trust는 효과적으로 임상연구가 진행되도록 책임지는 이사회 구성원, 특히 이사를 두도록
한다.
- 3년 이후 NHS Trust 임상시험에 참여할 모집 환자 수를 두배 확보하는 특별목표를 설정한다.
- 임상연구를 진행한 Trust의 실적을 품질에 의거하여 평가한다.
- Trust는 반년마다 임상시험에 참여한 환자 수를 발표하고, 결과를 평가한다.
- 임상연구에 참여하는 각 NHS Trust는 승인절차까지 소요된 평균 시간을 기록 발표한다.
- 각 NHS Trust는 새로 발생하는 시스템을 따라야 한다. 새로운 시스템은 6개월마다 NIHR
- 임상연구를 진행한 Trust의 실적을 품질에 의거하여 평가한다.
- Trust는 반년마다 임상시험에 참여한 환자 수를 발표하고, 결과를 평가한다.
- 임상연구에 참여하는 각 NHS Trust는 승인절차까지 소요된 평균 시간을 기록 발표한다.
- 각 NHS Trust는 새로 발생하는 시스템을 따라야 한다. 새로운 시스템은 6개월마다 NIHR
- Comprehensive Local Research Networks 내 NHS Permissions에 관련된 협동 시스템에서
개발한다.
2. 혁신에 부합하는 공공/ 규제환경을 조성하자.
기존 '생명과학 2015'에서는 4개 분야를 강조하였으며, 보고서 발간 이후 많은 진전이 있었다. 각각을 분석한다.
2.1. 규제 지원, 혁신적인 의약품의 승인 및 사용에 대하여 개선하자.
기존 '생명과학 2015' 발간 이후 바로 발표된 EU Clinical Trials Directive는 2004년 5월 영국에서 법이 되었다. 이 제도는 유럽 내 임상시험에 관련된 법규를 단순화하고 조화시키는 것을 목표로 하지만, 회원국 사이에서 발생하는 해석 차이에 따라 중소기업이 임상시험에 착수하는데 어려운 점이 발생하였다.
영국의 Medicines and Healthcare products Regulatory Authority (MHRA)는 EU Clinical Trials Directive에 참여하여 작은 분자량의 의약품 규제에 선도하고 있으나, 생물학적 제제는 European Medicines Agency (EMEA)가 직접 규제하고 있다.

David Cooksey 경의 보고서에서 강조하였음에도 불구하고, 의약품을 조건부 라이센스 시스템을 개발하는 것은 매우 느리게 진척되고 있다. Government/ Industry Strategy Group for the pharmaceutical industry (MISG)가 조건부 라이센스 과정에 대해 기준을 마련하고 시험하는 작업과정 (work stream)을 마련하였다. 이러한 움직임에 대해 우리는 환영하지만, 진행이 너무 느리기 때문에 Group에서 우선적으로 본 작업을 진행하기를 원한다.
지금까지 NICE의 신약 승인절차와 의료기술평가 절차가 서로 연계되지 않았다. 그러나 2008년 마무리된 다국적제약회사와 NICE와의 작업은 긍정적인 방향으로 바뀌었으며, 이를 바탕으로 NICE가 승인에 필요한 증거 (자료나 임상과정)들을 기업체에게 먼저 충고하면서 선도하게 될 것이다.
한편 ABPI에 따르면, EMEA 과정에 따라 진행된 29개 제품에서 생산자의 특허기간 때문에 NICE 승인은 30%에 불과하다. 이에 대한 제안은 3장에서 다시 검토한다.
2.2. 의학연구에서 제한된 범위에서 동물 사용에 대한 책임을 부여하자.
2.2. 의학연구에서 제한된 범위에서 동물 사용에 대한 책임을 부여하자.
기존'생명과학 2015' 보고서에서 의학연구에 제한된 범위에서 동물 사용을 지원하는 내용을 강조하였으며, 이에 따라 다음과 같은 범위로 괴롭힘가정방문, 이의제기, 고용인의 보호, 주문 제한, 억제 등에 대해 법 개정이 이루어지고 있다.
the Police and Crown Prosecution Service (CPS)가 다른 기관과 공동으로 범죄행위로 간주하여 구속하고 구형할 것으로 확신한다. 한편 the Serious Organised Crime and Police Act 2005는 동물을 이용하여 연구하도록 허가받은 사람과 조직과 동시에 관련된 기업이나 개인을 보호하는 것으로 알고 있다.
그러나 the Protection from Harassment Act 1997에 저촉되어 법원으로부터 강제명령을 받은 기업체도 있다. 이러한 강제명령 등은 기업 활동의 위축을 가져온다.
Research Defence Society와 의학진보연합 (Coalition for Medical Progress)이 통합되어 형성된 동물연구이해 (Understanding Animal Research)는 동물연구에 대한 전략을 개발하였다. 이에 따라 정부와 산업체가 새로운 조직을 설립할 기회가 되었다. 이 조직에서는 제한된 범위에서 동물연구의 필요성을 이해시키고 이러한 정보를 제공하는 대표기관이 될 것이다.
동물연구의 중요성에 대하여 정부에서 지속적으로 관심을 갖고 있다는 것은 만족스러운 일이다. 동물에 대해 연구하는 사람들이 자신은 안전하며 연구를 계속할 수 있다는 자신감을 갖게 되도록 정책을 계속 개발해야 한다.
2.3. 생명과학 규제와 명성 관리(reputation management)에 대한 미래지향적인 접근방법
을 채택하자.
기존 '생명과학 2015' 에서 앞으로의 규제를 예측하고 유럽각국이 영국 입장을 수락하도록 미래지향적인 태도를 가져야 한다고 제안하였다. 방안의 하나로 Bioscience Risk Assessment Forum 창설을 제안하였고, 이에 따라 Bioscience Futures Forum (BFF)가 구성되어 2005년 2월 첫 회합을 가졌다. Department of Trade and Industry (DTI; 현재 BERR)는 3년간 BFF를 지원하기로 약속하였으며, 2008년 3월에 종료되었다.
존속기간 동안 BFF는
- 2006년에는 European Biosciences Intelligence Coalition(EBIC) 설립에 참여하였고, 동물실험
- 2006년에는 European Biosciences Intelligence Coalition(EBIC) 설립에 참여하였고, 동물실험
관련 Directive 86/609 EEC에서 영국의 입장을 반영
- 조류독감에 대해 산업계 반응을 촉진하는 행사 개최
- 산업분야에서 투자 (investment challenge)를 분석하는 행사 개최
- 조류독감에 대해 산업계 반응을 촉진하는 행사 개최
- 산업분야에서 투자 (investment challenge)를 분석하는 행사 개최
산업계, 정부, charity, 학계 모임인 EPIC은 유럽에서 발생하는 규제 관련 이슈에서 이들 네트워크에 미칠 영향력 등을 분석하기 위한 지적 단체이다. 그리하여 한 목소리를 낼 수 있다. 그러나 BFF는 기존 '생명과학 2015' 에서 언급된 사항에 대해 도전하기 어려웠고 정부로부터 지원도 중단되었다.
3. 적절하고 충분한 자금이 마련된다는 것을 확신시키자.
생명공학 중소기업 커뮤니티가 자금에 접근하는 능력은 산업분야에서 결정적인 이슈이며, 기존 '생명과학 2015'의 핵심인 지속성과 critical mass를 달성하는 능력이다. 그러므로 자금과 투자분야에서 이루어진 사항을 검토한다. 2장에서 분석결과와 행동 제안을 수록한다.
기존 '생명과학 2015' 발간 당시, 3개의 투자기관이 운영되고 있었다.
- 대표적으로 2004년 창설된 Technology Strategy Board (TSB; www.innovateuk.org)는 생명공학
분야 R&D 협력을 보완하는 것으로써 2007년 7월 비정부공공기구 형태로 설립되었다. 업무는 정부
부처간 국가기술정책을 배분하고, 기술혁신과 지식이전과 관련된 정책을 자문하는 것. Regional
Development Agencies와 Research Councils과 공동으로, TSB는 3년간 10억 파운드 이상을 투
자하여 critical mass를 조성한다.
- Enterprise Capital Funds (ECF)를 창설. 회수 가능한 잠재력을 갖는 신입기업에 최대 2백만 파운
- Enterprise Capital Funds (ECF)를 창설. 회수 가능한 잠재력을 갖는 신입기업에 최대 2백만 파운
드를 투자한다. 생명과학 펀드매니저가 운영능력이 뛰어나 Capital for Enterprise board로부터
ECF 수여받았다.
-기업백서 2008 (Enterprise White Paper)에서 growth finance에 대해 소개되었는데, 이 제도로
-기업백서 2008 (Enterprise White Paper)에서 growth finance에 대해 소개되었는데, 이 제도로
혜택을 받은 생명공학 기업은 없다.
3.1. 자력 생존할 수 있도록 생명과학 기업의 유동성을 개선할 수 있도록 자금 지원
우선매수권 가이드라인 개정 (생명과학 2015의 제안 3.1.1)에 따라 Paul Myners (Marks & Spencer사 회장; Gordon Brown 총리시절 재무부 재정서비스 차관)는 2004년 11월까지 우선매수권에 대해 정부 지원금을 증액해야 하는가에 대하여 심리를 주도하였다. 그의 보고서에 따라, the Pre-emption Group은 재개되어 보다 유연성을 부여한 Statement of Principles 개정판 (2006년 5월)을 발간하였다.
2008년 9월까지 3년간 우선매수권을 남용한 경우를 조사-분석한 2008년 11월 발간된 보고서에 따르면, 남용건수는 2005/06년도 5%, 2006/07년도 8%, 2007/08년도 10%이며, 대부분 소액이거나 신입기업체이었다.
2008년 9월까지 3년간 우선매수권을 남용한 경우를 조사-분석한 2008년 11월 발간된 보고서에 따르면, 남용건수는 2005/06년도 5%, 2006/07년도 8%, 2007/08년도 10%이며, 대부분 소액이거나 신입기업체이었다.
우선매수권과 보상에 관련되는 원칙을 소개한 Rights Issue Review Group (www.hm-treasury.gov.uk)에서 2008년 11월 발간한 보고서에 따르면, 효율적인 증자방법에 대한 많은 제안을 담고 있다.
Myners 리뷰와 후속 작업에도 불구하고, 생명과학 커뮤니티에서는 미국과 비교할 때 불리한 사항과 영국에서 증자하는 경우에 대한 걸림돌 등에 대해 논란이 많았다.
중소기업 커뮤니티와 제약회사 사이의 협동이나 파트너십은 매우 강하다. 그러나 투자회사에 대해 결손전기이월 자산 (tax loss asset) 제도 등에 관련된 Corporate Venturing Scheme (생명과학 2015의 제안3.1.2)에 대한 관점을 바꾸려는 정부의 행동은 아직 없다. 이러한 현상에 대한 아이디어는 2장에서 검토한다.
연구개발세액공제제도는 산업계에서 매우 유용한 제도이므로, 계속도이어야 하며, 다른 세액공제제도도 확장되어야 한다. 그러나 기존??생명과학 2015??에서는 이 항목을 다루지 않아, Finance and Investment Working Group에서 검토하고 있다.
생명과학 2015의 제안 3.1.5의 생명공학혁신상(bioscience innovation award) 제도는 정부가 거절하였다.
생명과학 2015의 제안 3.1.6에서는 범 유럽 기술이전에 관련된 것으로 실제로 이러한 일들은 일어나지 않았다. 그러나 critical mass를 달성하기 위해 제안을 유지하려고 한다.
3.2. 아이디어 창출 및 상업화 재원 연결 프로그램에 투자하자.
Higher Education Innovation Fund (HEIF)는 2003년에 설립되었고 4년차인 현재 펀드가 연구기관에 적절히 배분되어 기업간거래 단계까지 도달하였고, 2008/9 학년 모든 HEI가 연구비를 받고 있다.
튼튼한 반석위에 HEIF를 위치시키기 위해서는 연구기관들이 기획하고 연구인력을 선발하며, 기술이전 전문가를 확보하여야 한다. 2010/11년까지 HEIF 예산은 15억 파운드까지 증가할 것이다. 이 분야 정책은 특별한 지식이전 활동에 공적 자금을 사용하는 것에서 HEI 자체의 경쟁력을 갖도록 책임을 이양하는 방향으로 진화되고 있다.
Public Sector Research Exploitation (PSRE) 펀드에서는 공공부문 기관의 연구 지원이 증가하고 있다. PSRE가 지원하는 대표적인 과제로 총 2천9백만 파운드 규모로 투자하고 있는 Rainbow Seed Fund로Biotechnology and Biological Sciences Research Council (BBSRC) 등 다양한 공공부문 연구기관의 상업화에 투자한다.
그럼에도 불구하고, 대학 등 교육기관으로부터 지적재산을 상업적으로 개발함에 있어 기술이전을 지원할 많은 일들이 산재해 있음을 우리들은 믿고 있다. University Technology Transfer는 연구결과를 산업화로 확신시키는 과정으로 개선되어야 한다.
3.3. 유럽 투자재원에 접근하기 위해 영국 생명공학기업을 개선하자.
현재 Framework program 7 (FP7)이 진행 중이다. European Framework 투자프로그램에 접근하기를 원하는 중소기업과 대학에 자문하기 위하여, 통산성과 Medical Research Council (MRC)는 National Contact Points로 TSB를 설립하였다.
영국정부는 Innovative Medicine Initiative (IMI)을 개발하는 과정에서 민관 연구과제에 필요한 재원을 마련하는 역할을 담당하였다. 그러나 과제를 신청하는 조건이 매력이 없어, 실제로 영국 생명공학 기업이 IMI로부터 혜택을 받은 경우는 별로 없다.
또한 2005년 영국정부가 유럽 회원국과 협의한 유럽 내 생명공학 기업에 대한 fund-of-fund 제도도 진척이 없다.
4. 생물공정 섹터를 공고히 하자.
4.1. 영국을 통괄하는 생물공정 COE 네트워크를 만들자.
기존 '생명과학 2015' 에서 생물공정 연구를 위해 우수연구센터 (center of excellence; COE)를 설립하는 것 등 3개 제안을 포함하고 있다.
장기 비전으로 다학제간 교육센터를 설립하여 critical mass에 대비하는 것으로, 이에 따라 BBSRC는 과학적 도전(challenge)을 달성할 수 있는 working group을 설립하였다.
BBSRC, The Engineering and Physical Sciences Research Council, bioProcess UK (18개 기업체가 참여)는 2005년 Bioprocessing Research Industry Club (BRIC)을 설립하였다. 2011년까지 계속될 Club은 1천4백만 파운드 상당의 25개 과제를 지원하고 있다. 연구결과 파급과 참여기업과의 네트워크는 BRIC의 중요한 관점이며, 앞으로 생물학적 치료제 개발에서 병목이 되고 있는 문제점 해결로 확대하려고 한다. BRIC Steering Group은 현황과 앞으로의 문제점을 검토하여 2009년 보고할 계획이다.

BRIC에 새로운 교육기관들이 참여하여, 생물공정 커뮤니티가 보다 다양하고 활발하도록 BRIC은 포괄적인 접근법을 활용하고 있다. 또한 새롭게 COE가 탄생되면, 관련 Research Council들은 연구와 훈련 면에서 활성화되도록 재정적으로 지원하는 것을 고려해야 한다.
4.2. 생물공정 자산 확보를 위해 대내투자를 유도하자.
기존 '생명과학 2015' 에서 bioProcess UK가 대내투자를 지원해야 한다고 지적하였다. Knowledge Transfer Network가 대내투자 기회 등에 대한 반응을 개선하기 위해 조언하고 있다. 이에 따라 UK Trade and Investment (UKTI)와 공동으로, 생물공정/ 생산시설에 대한 대내투자를 지원하는 모델을 연구하고 있다. 이 연구에서는 경쟁상대인 싱가포르, 아일랜드, 미국 등 국제적으로 비교하는 것을 포함한다. 이러한 경우와 같이 보다 많은 연구들을 지원해야 할 것이다.
4.3. 생물공정 커뮤니티 발전을 조성하자.
기존 '생명과학 2015' 에서 bioProcess UK가 Knowledge Transfer Network (KTN) 역할을 지적하였다.
bioProcess UK은 BRIC을 설립하고 운영하는데 역할을 하고 있다. 이외에 2004년부터 매년 컨퍼런스를 개최하는 등 커뮤니티 발전에 기여하고 있으며, 기술개발과 훈련을 지원하는 Career Opportunity Workshop을 운영하고 있다.
커뮤니티는 생물공정 외에도 의약품, 생명공학, 서비스기업, 과학 자체까지 확대되고 있다. 따라서 이러한 일을 위해 TSB와 KTN이 나서야 한다. 2008년 여름 TSB는 KTN의 역할에 대해 재검토하였고, KTN의 하부구조와 조직을 개선할 것을 제안하였다. 이는 기존??생명과학 2015??에서도 제안한 사항이다.
5. 고급 과학적/ 관리적 유능한 기반을 마련하자.
영국의 생명과학 기초는 튼튼하고 다양하다. 이것을 기반으로 산업화로 성공하는 것에는 유능한 생명과학 전문가 풀 (pool)을 양성하고 개발하는 것이 필요하다. 이러한 방법으로 1)해외에서 일하는 유능한 인재가 되돌아오도록 격려한다. 2)산업계 리더들을 순환시킨다. 3)우수한 훈련기회를 마련하는 것이다.
다음은 기존 '생명과학 2015' 훈련에 관해 제안한 내용이다.
5.1. 생명과학 부문에 필수적인 다학제 교육을 지원하는 두 프로그램을 시작하자.
- Bachelor of Medicine, 미국에서의 MD-PhD 자격과 같은 MB-PhD 자격 등을 지원하는 프로그램
을 운영하여, 선별된 HEI에서 30명의 학생을 육성하고 점차적으로 100명으로 키운다.
영국에서는 Cambridge대학, Leicester대학, University College London 등 3개 대학에서 이러한
과정을 운영하고 있으며, 연 30명의 학생을 배출한다. Academy of Medical Sciences on MB-
PhD's 주관 심포지엄 결과가 2007년 5월에 발표되었는데, 이 과정의 진행과 지원을 중단하는 것으
로 결론지었다. European Science Foundation은 '유럽의 의학연구의 현재와 미래 전략‘ (Present
Status and Future Strategy for Medical Research in Europe) 백서를 통해 의학연구를 발전시키
기 위해서는 MB-PhD 프로그램을 추천하였다.
- 박사후과정의 과학자나 공학자에게 단위과정부터 MBA까지의 경영교육 (business education) 과
정을 이수하도록 지원하는 프로그램을 도입하자.
현재 운영하고 있는 'Train to gain' (National Skills Service에서 지원하고 있는 프로그램)에서 고
용자에게 Leadership and Management Training을 지원하고 있다. Research Coucils UK
(RCUK)는 실무훈련 단위를 습득한 박사들을 지원하려고 기획하고 있다.
또한 Semta의 Bioscience Sector Skills Agreement (SSA) Action Plan는 2009년 4월부터 시작
한다.
5.2. 다학제 교육-훈련을 확대, 심화하여 기존 이니셔티브를 지원, 확장하자.
UCAS (영국고등교육심화과정대학)의 2008/9학년 학위과정 신청을 집계한 결과, 전년 대비 물리학 (+4.2%), 화학 (+4.6%), 생물학 (+6.0%), 수학 (+7.1%)로 이공계 (Science, Technology Engineering, Mathematics; STEM)에서 증가하고 있어 긍정적이다. 한편 Higher Education Statistics Agency (HESA)의 2006/7학년 STEM 자격시험 통과율은 전년 대비 생물학 (5.1%), 화학 (5.7%) 증가하여, 상기와 비슷한 경향을 보고하였다. 이는 감소율을 보였던 2005/6학년과 2006/7학년 결과와는 상반된 것이다.
'Race to the Top' 보고서에서 밝힌 Sainsbury 경 (Science Minister)의 제안에 따라, 정부는 새로운 과학과 혁신에 향후 3년간 10억 파운드를 투자하기로 약속하였다.
Department for Children, Schools and Families (DCSF)는 2008-2011 기간동안 교육기관에 대한 STEM agenda에 1억4천만 파운드를 투자하기로 발표하였다. 이로써 과학 프로그램 세 가지를 진행하는 데 필요한 교사 채용, 유지, 연속적인 교과개발, 활성화 등을 지원할 수 있게 되었다. 또한 Wellcome Trust and Industry와 공동으로 DCSF는 ENTHUSE 프로젝트를 지원하기로 약속하였다. ENTHUSE 프로젝트는 National Science Learning Center에 향후 5년간 현재 과학(contemporary science)에 대하여 과학교사가 경험하도록 지원하는 내용이다.
모든 연령층을 대상으로 과학에 대한 흥미를 유발하는 작업에는 ABPI science careers site와 Science Council에 의해 개발되고 DCSF가 지원하는 FutureMorph site 등 웹사이트가 있다. 산업체에서 활용되는 경력 개발 교육에 대해 교육기관과 기업체들이 작업에 협력하고 있다.
Department for Innovation, Universities and Skills (DIUS)는 DCSF와 STEM skills agenda에 협력하고 있으며, STEMNET을 지원한다. 또한 Science and Engineering Ambassadors (SEAs) 프로그램은 2008년까지 1만8천명의 SEAs를 양성하였고, 2011년 3월까지 2만7천명 SEAs를 양성하는 것을 목표로 하고 있다. Volunteer Ambassodors의 경력과 배경을 살펴보면, 환경과학자, 토목공학자, 해양생물학자 의료물리학자, 디지털 디자이너, 금융모델학자, 에너지분석학자, 세포유전학자 등을 매우 다양하다.
STEMNET은 DSCF를 대신하여 과학과 공학 관련 방과후 클럽 네트워크를 지원한다. DIUS 또한 British Association for the Advancement of Science (BA) Crest Star Investigators (방과후 클럽 관련 영국 전체 프로그램)를 지원한다.
HE debate의 일환으로, The Secretary of State for Innovation, Universities and Skills는 핵심 대학이 STEM을 강화하도록 하는 보고서를 요청하였다. 이 보고서는 젊은 졸업생들에게 매력적이도록 연구경력 과정을 발굴할 것이다.
- 어린 시절부터 다학제 교육과정을 통해 생명과학과 물리학과 관련된 생명과학에 대해 흥미를
갖도록 격려하자.
생명과학 2015의 제안 5.2.2에서, Research Council들이 공동으로 졸업후 단계로 다학제 시스템을 개발하고 있다. 학교에서 Science Diploma는 교사로 진출하거나 다학제 접근을 위한 자격이 될 것이다.
생명과학 2015의 제안 5.2.2에서, Research Council들이 공동으로 졸업후 단계로 다학제 시스템을 개발하고 있다. 학교에서 Science Diploma는 교사로 진출하거나 다학제 접근을 위한 자격이 될 것이다.
science center 역할을 다시 검토되고 있다. 2007년 Science and Technology Committee (현 Innovation, Universities, Science and Skills Committee)는 science center에게 재정 지원을 요구한 바, 이에 따라 DIUS는 유사한 기능의 조직과 비교하여 STEM과 science center 네트워크의 투자효과를 분석하고 있다.
- 졸업후 단계에서 다학제 훈련을 제공하는 프로그램과 이니셔티브를 늘리자.
BBSRC는 물리학 전공학생들이 생물학에 관심을 갖도록 다학제 석사과정을 지원하고 있는데, 배스대학에서 Mathematical Biology MSc, 요크대학에서 Computational Biology MSc 등이 대표적이다.
최근에는 학생마다 4년간 지원하고 있다. 이러한 이들은 다학제 분야에서 어느 정도의 기술을 개발하는데 충분한 시간으로 판단된다.
Research Councils UK의 RCUK Research Careers and Diversity Unit (2005년 설립)은 SET for Success Review에 따른 투자효과를 분석하였고, 분석 결과 박사학위 취득부터 처음 취업 때까지 지원을 제안하였다.
2008년 12월 EPSRC는 44개 Doctoral Training Center에 2억5천만 파운드를 지원하겠다고 발표하였다.
- Research Councils이 다학제분야 박사과정 지원을 확대하도록 요청하자.
Research Councils이 박사를 지원하는 장학금은 2002년에 비해 두 배 증가하여, BBSRC가 수여하는 장학금은 12,940 파운드에 달하고 수혜자 수는 2천명에 달한다. 2011년까지 2400명으로 늘릴 것이다. 또한 BBSRC는 Masters Training Grants로 석사과정에도 지원하고 있다.
- 다학제 석사과정을 지원하여 우선분야에 경쟁력을 갖도록 격려하자.
올해 MRC와 ESRC는 기능이 부족한 Health Economics 분야를 지정하고, 다학제 박사후 과정을 지원하고 있으며, RCUK Strategy는 지원을 확대할 계획이다. BRIC style machanism도 다학제 분야에서 부각되고 있다.
- Biotechnology Young Entrepreneurs Scheme (YES) 등을 통해 사업에 접근하는 기회(business exposure opportunities)를 마련하고 지원하자.
Research Councils이 YES와 같은 제도도 지원을 계속하고 있다. BBSRC로부터 2007년 65개 팀이, 올해는 73개 팀이 지원받는다. TSB는 Knowledge Transfer Partnership Scheme (KTP)를 통해 사업기회를 지원하고 있고, 생명과학분야에는 25개 파트너십이 있다. 이 계획은 산업계에서도 긍정적으로 평가받고 있으므로, KTP는 제도를 더욱더 개선하려고 한다. Yorkshire Forward's Bio2work 등도 운영된다. 또한 제도의 필요성을 Semta SSA Action Plan에서 언급하고 있다. BBSRC의 Enterprise followship은 연구결과를 산업화하는 것을 지원한다.
BBSRC의 박사과정 단계에 지원하는 CASE Partnership scheme은 78명이 4년간 지원받고 있다. BBSRC의 Masters Competition으로 Kings College의 Drugs Discovery Skills 5곳 MSc를, University of Edinburgh의 Drug Discovery and Translational biology MSc을 지원하고 있다.
- 생명과학 섹터에 특수한 직업훈련 프로그램을 장려하자.
Semta는 National Occupational Standards 4가지, 생명과학관련 직업자격제도 7가지를 운영하여 의약품과 생명과학 분야에 많은 일을 하고 있다.
- 걸림돌을 제거하여 기존 인재에게 인센티브를 높이자.
- 걸림돌을 제거하여 기존 인재에게 인센티브를 높이자.
기존 '생명과학 2015' 보고서에서 다음과 같은 인센티브를 제안하였다.
. 3만에서 10만 파운드의 옵션을 부여하자.
. Executive Management Incentive Scheme (EMI) 옵션으로 10만 파운드까지 주도록 하자.
. 면세액수를 8천 파운드로 하자.
. Executive Management Incentive Scheme (EMI) 옵션으로 10만 파운드까지 주도록 하자.
. 면세액수를 8천 파운드로 하자.
그러나 이러한 제안은 실제로 불가능하며, 정부에서도 나서지 않고 있다. 2003년 상황에서는 필요한 조치이었을지 모르지만, 현 시점에서 다시 검토할 필요가 있다.
6. the Bioscience Leadership Council을 활성화하자.
기존 '생명과학 2015' 보고서에 따라 Richard Sykes 경 (이후 Imperial College London 총장으로 취임)을 회장으로 the Bioscience Leadership Council가 설립되었으나, 2006년 1월 축소되었다.
6.1. 의료생명과학 섹터의 경쟁력 분석
기존 '생명과학 2015' 보고서에서는 의료생명과학 섹터의 데이터 수입에 대한 언급은 없다. 그러나 2003년 이후 의료생명과학 섹터의 변화를 파악하기 어렵고, 의료생명과학 기업의 경쟁력은 더욱 파악하기 어렵다.
의료생명과학 기업에 대해 기술력을 측정하거나 데이터를 추적하는 것은 매우 어렵다. 따라서 다음과 같은 작업을 진행해야 한다.
. 의료생명과학 기업을 정의하고, 그리고 소규모 제약회사와 차이점을 구분한다.
의료생명과학 기업이 정의되지 않아 국가나 국제적인 통계에 따른 산업분류코드 확인이 불가능하다.
의료생명과학 기업은 생물학적 의약품이나 개선된 치료약을 발견, 개발 생산하는 것으로 알고 있으나, 제약회사에 라이선스 또는 판매할 목적으로 -omics 기술과 같은 진보기술을 사용하여 의약품을 개발하거나 의약품을 발견/개발하는데 필요한 플랫폼을 개발하고 있다. 다른 기업들은 의료생명과학 대신에 환자에 적용할 의료기술이나 건강관련 기술, 즉 진단기술을 개발하고 있다.
의료생명과학 기업은 생물학적 의약품이나 개선된 치료약을 발견, 개발 생산하는 것으로 알고 있으나, 제약회사에 라이선스 또는 판매할 목적으로 -omics 기술과 같은 진보기술을 사용하여 의약품을 개발하거나 의약품을 발견/개발하는데 필요한 플랫폼을 개발하고 있다. 다른 기업들은 의료생명과학 대신에 환자에 적용할 의료기술이나 건강관련 기술, 즉 진단기술을 개발하고 있다.
. 기업체와 국가의 역할을 배당하자.
영국에 근거하는 의료생명과학 회사에서 개발 중인 의약품의 숫자는 개발단계를 확인해야 한다. 현
실은 매우 복잡하기 때문이다. 예를 들어 컨소시엄에 의해 개발되는 것, 소규모 생명공학기업을 매수
한 대기업의 경향에 따라 한 국가의 경쟁력이 다른 나라에 영향을 미치기 때문이다.
. 특정 의약품의 임상단계에 대한 실상을 파악하는 것은 쉽지 않다.
의약품은 임상시험의 여러 단계를 동시에 진행될 수 있고, 승인된 의약품이라도 다른 의약품과 혼합
하여 임상이 진행되기도 한다. 또한 항암제의 경우 여러 가지 암에 적용하기 위한 임상은 각각 달라
진다.

2장 새로운 비전 및 사업모델
□ 서론
기존 '생명과학 2015' 보고서의 비전은 ‘세계 수준의 대기업을 발굴하고, 생명과학 부문의 자생력을 창조하는 것’이었다.
본 장에서 보고서 발간 이후 생명공학 부문에서 진행된 상황, 구체적으로는 투자 및 금융상황을 검토하여, 아직도 가능한 일인지를 판단한다. 만일 그렇지 않다면, 새로운 비전이나 가능한 아이디어를 제안하고자 한다.
우리는 다음 관점에서 생명과학 기업 비즈니스 모델에 대한 투자자 시각을 검토한다.
. 투자 라운드 (funding round)에서 나타나는 투자 행태
. 생명과학 섹터에서 투자 효율성
. 기업체가 필요한 자금을 유인하기 위해 자신의 우월한 위치를 어떻게 확신시키기 위한 분석
. 생명과학 섹터를 지원하기 위한 정부가 취해야할 행동 방안 모색
. 생명과학 섹터에서 투자 효율성
. 기업체가 필요한 자금을 유인하기 위해 자신의 우월한 위치를 어떻게 확신시키기 위한 분석
. 생명과학 섹터를 지원하기 위한 정부가 취해야할 행동 방안 모색
이때 생명과학 기업은 독창적인 방법으로 새로운 의약품 (치료법, 생물학적 의약품, New Chemical Entities (NCEs))을 발견/ 개발하려는 최근 생겨난 기업으로 정의한다. 대규모 제약회사는 포함되지 않는다.
□ 생명과학 비전
기존 '생명과학 2015' 보고서 발간 후 5년이 경과한 현재, 영국 생명과학 기업들은 보고서에서의 비전 가능성에 대해 논쟁하고 있는 동안, 파이프라인 제품에서 나타난 바와 같이 유럽 다른 나라의 기업들은 영국을 따라잡고 있다. 예를 들어 2002년 임상중인 유럽 제품의 46%가 영국에서 개발된 것이었지만, 2007년 영국 제품은 24%로 낮아졌다.
그리고 기업의 시가총액에 관련된 도 5에서, 2002년부터 2천5백만 파운드 미만인 기업의 수가 증가하고 있지만, 2천5백만 파운드 이상인 기업의 수는 감소하고 있다.
2003년에 가졌던 희망과 반대 방향으로 움직이고 있으므로, 2015년에 대한 비전을 현실화할 필요가 있다.
자급자족 (지속가능한)은 투자가 이루어져야 하고, 또한 재투자도 이루어져야 한다. 이러한 분위기를 만드는 것이 우리의 목표이다.
□ 투자의 연속성 (continuum)
의약품 개발은 오랜 시간을 필요로 하기 때문에, 기존 '생명과학 2015' 비전을 만족하기 위해서는 어느 기업체이던 몇 차례 투자를 받아야 한다.
본 장에서는 기업체가 투자계획을 수립하는 방법을 소개한다. 이러한 방법을 통하여 매출이 증가할 것인데, 이것이 영국에서 생명과학 기업이 운영하는 대부분의 비즈니스 모델이 될 것이다. 그러나 매출 증가는 미국이나 기타 유럽에서 관찰되지만, 영국에서는 뚜렷하게 나타나지 않는다.
이 모델에 따라 다음 단계로 진행하는 데는 많은 원인들이 존재한다. 일반적인 벤처투자에서 회수되는 기간이 10년인 반면, 의약품이 시장에 나타나는데 12년 정도가 소요되므로 벤처투기자본은 의약품이 시장에 나타나기 전에 투자회수방법을 검토하고 있다.
다음 단계 진출을 위해 기업체들은 탄력성을 갖는 주식시장으로부터 증자하고 있다. 그러나 생명과학 부문에서 지난 5년간 주식시장이 하락하는 것을 볼 수 있다. 그림 4에서 보면, 영국 생명과학 회사들의 시가총액은 런던주식시장 시가총액의 1%를 넘지 못한다.
한편 생명과학 기업이 흡수되거나 매각되는 수가 증가하고 있다. 벤처투자의 한 형태이기는 하지만, 주식시장에서 이러한 형태로 탈출하는 것은 정상적인 상황은 아니다.
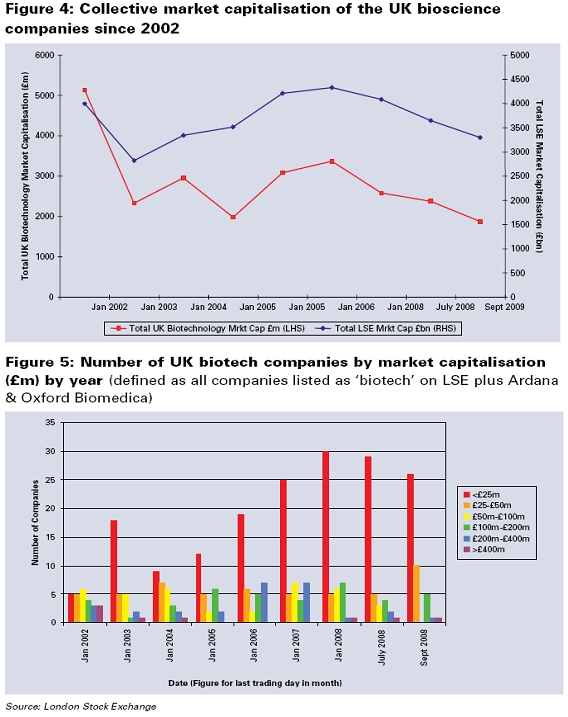
□ 초기투자/ 벤처 단계/ 주식공모에 관련된 이슈
○ 초기투자 (seed funding)
특히 의약품인 경우, 초기투자를 유치하는 것은 매우 어렵다. 생명과학은 초기단계에 투자하는 것이기 때문에, 초기투자나 angel 투자 등에게 투자효과가 희석되기 때문에, 유동성을 선호하는 벤처투자가에게는 매우 위험한 영역이다. 그러므로 시작단계 기업에 대한 초기투자는 적절한 투자방법은 아니다.
따라서 이를 극복하기 위해 정부가 증명하는 개념 증명 (proof of concept) 제도를 도입할 것을 제안한다.
○ 개념 증명을 위한 국가규정
유동성 관점에서 보면, 투자단계가 진행될수록 후속 단계의 투자 안전성 확보는 점점 복잡해진다. 이때 돌파구가 기업공개 (IPO)이다.
Sainsbury경은 'Race to the Top' (2007년 보고서)에서 Scottish Enterprise's Proof of Concept Programme 사례를 보고하였다. 그는 모범사례 (best practice)에 근거하여 투자효과를 상승시키기 위해 개념 증명을 위해 국가규정을 개발하는 것을 제안하였다. 그리고 새로운 ??Grants for R&D??(10만-25만 파운드 규모로 지원)와 같은 Business Support Products을 통해 투자하는 것은 국가 측면에서 개념 증명을 지원하는 것이 유용하다. 'Grants for R&D'는 전임상단계에서 투자에 대한 필요성과 일치하는 설계이다.
'Race to the Top' 의 개념 증명에 대한 제안은 상대적이지만, 해결방안을 제시할 수 있다.
Wellcome Trust, Cancer Research UK, Michael J. Fox 재단과 같은 자선기금 또는 박애주의 기관들은 ??실험실 벤치에서 병원 침대 곁으로?? (bench to bedside) 관점에서 건강관리 제품에 대해 연구를 지원하고 있다. 이러한 지원은 의약품 개발에 필요한 장기 레이스를 후원하고 또한 벤처투자가의 위험을 다소 감소시킨다.
미국 Johns Hopkins 등 주요병원에서 운영하고 있는 Academic Health Science Center (AHSCs) 시스템도 영국에도 도입되었다.
첫 번째로 Imperial College에, 이후 최근 King's College London과 University College London에도 설립되었다. 이 시스템은 자선기금이나 Research Council으로부터의 지원을 의학연구와 중개연구를 연계하는데 운영한다. MRC Translational Technology는 의약품 스크리닝에 대해 Drug Dicovery Group를 통해, 초기 기술이전과제에 대해서는 Development Gap Fund를 통해 연구비를 지원하고 있다. 그러나 이들 재원이 중소기업에 직접 지원하는 경우는 없다.
○ pre-IPO/IPO
일반적으로 자본 회수율이 낮아 생명과학 기업을 비관적으로 보는 입장이 늘어나고 있어 생명과학 기업이 주식시장을 통해 자금을 확보하는 것은 불가능하지만, 최근 Cambridge Antibody Technology사와 NeuTec Pharma사는 경우는 성공적으로 증자할 수 있었다. 그러므로 독립적이거나 성공한 결과를 갖고 있거나, 대규모이거나, 국제적인 형태의 이들 생명과학 기업이 영국에 존재하는 한, 수입과 이익을 창출하는 제품을 확보한 생명공학 기업들에게는 IPO는 탈출구이다.
과거에는 벤처자본투자는 펀드기간, 유동성 선호도 등에 따라 기업공개에 관여하였다. 기업공개로 벤처자본은 투자를 회수하여 탈출하고, 초기단계 기업은 (주식)시장에 도달하게 된 것이다. 이때 벤처자본의 욕망에 따라 대상기업의 지분을 저렴하게 매각하는 등 상황이 악화될 수 있다.
미국과 대비되는 상황으로, 영국의 주식시장은 critical mass를 개발하기 어려워, 상황이 악화된다. 투자가의 숫자가 적으면 적을수록 유동성도 나빠지게 되고, 투자지분을 매각하려고 투자자본은 변덕스러운 행동을 취하게 된다. 이에 따라 다른 나라 또는 다른 산업보다 궁극적으로 생명과학 부문 전체의 매력이 떨어지게 된다. 이것이 유럽 다른 국가와 비교하여 외국 투자가들이 영국, 특히 영국 생명과학에 대해 접근하는 시각이다.
런던주식시장 (London Stock Exchange; LSE)에서 스위스 등 선진국의 기업이나 인도, 중국 등 개발도상국의 시장에 대해 보는 시각은 영국 생명과학을 도와주거나 확신을 심어줄 수 있었다. 또한 현재도 같은 맥락이다. 영국 기업체에 대한 투자자본 총액은 줄어들고 있지만, 생명과학 부문에 대한 투자자들의 시각은 아직도 과대평가하고 있는 중이다. 현재보다 더 흡족하게 투자회수기회를 제공하는 기업들의 숫자가 늘어난다면 기업공개시장에서의 투자자들은 생명과학 부문으로 다시 돌아올 것이다.

□ 생명과학 중소기업에 대한 투자를 증가시키는 방법; 정부 전략
정부는 기업을 지원하는 많은 전략 (scheme)을 제공하고 있으며, 동시에 투자가 원활하도록 단순화시키기 위해 많은 노력을 하고 있다. 보다 쉽게 접근할 수 있는 단순화된 사업지원 계획 (landscape)에서 모든 부문의 사업은 혜택을 받는다. 이러한 제도는 투자위험이 큰 생명과학에서 더욱 특별하다.
생명과학 부문에서 행하는 연구 개발비용은 많이 든다. R&D 세금공제 (tax credit)는 최소한 혁신을 촉진한다는 점에서, 정부 지원에서 매우 유영한 정책이다. 생명과학 기업은 연구개발단계에서 많은 비용을 소비하므로, 기업 감세제도 (tax cut)보다 훨씬 선호한다.
세금공제와 같은 세금 관련 인센티브는 다른 부문 혁신과 마찬가지로 생명공학 기업을 자극한다. 또한 R&D 세금공제는 산업과 혁신을 지원하는 시장-우호적인 지침이 되고 있다.
특허는 생명공학을 포함한, 하이테크 사업의 R&D 비용에서 상당하다. 특허 1건당 35만 파운드 (25만 파운드는 직접비용, 10만 파운드는 변리사 비용)로 상승되고 있으며, 제품이 출시될 때까지 긴 시간도 필요하다. 대부분의 제품이 하나 이상의 특허 세트에 의존한다. 특허 세 개로 이루어진 제품의 경우에는 지적재산 비용만 1백만 파운드 이상이 필요하다.

Enterprise Investment Scheme (EIS)는 고위험 소규모기업이 증자하는 경우 이들 기업의 신주를 인수하려는 투자자에게 증자기업의 세금경감 범위를 제안하는 것을 도와주도록 고안되었다.
2007년도 Pre Budget Report에서, 정부는 장기보유공제 (taper relief)에 대한 양도소득세 (capital gain tax) 제도를 폐지한다고 발표하였다.
많은 생명과학 기업들은 손해를 무릅쓰고 R&D 활동을 계속하고 있음에도 불구하고, EIS나 Venture Capital Trust (VCT) 와 같은 조건을 만족시킬 수 없다. 따라서 투자가에게 양도소득세 제도 등 세제 인센티브가 필요하다. 제한된 시장에서 주주가 보유주식을 거래할 수 있어야 한다. 그렇지 않다면, 10-15년 동안 투자를 한 번 할 수 있다면 투자를 단념시키는 것과 같다.

2백만 파운드 정도로 운영되는 Enterprise Capital Funds (ECFs)는 상업적 펀드로, 개인이나 공공자금을 조합하여 고위험 소규모사업에 투자한다. 정부는 각 ECF 자산의 2/3를 정부채수익률 (gilt rate)에 따르도록 제한하고 있어, 실제 투자할 자본은 적다. 1장에서 언급한 바와 같이, Capital Enterprise Limited는 생명과학 관련 펀드매니저로 한 개의 ECF를 운영하고 있다.

□ 새로운 비즈니스 모델
전술한 영국 생명공학의 기회에서, big pharma은 주요한 역할을 담당한다. 신제품에 대한 아웃소싱으로 기업 운영을 되살리려고 재구성이 이루어지고 있다. 영국 생명공학 부문을 강화하는 기회이다.
예를 들어 스위스는 교육기관에서의 분사보다는, Novartis에서 분사한 Speedel사와 같이 기업에서 분사하는 제도를 채택하여 생명공학 산업을 성공하였다.
최근에 생겨난 생명과학 산업은 보다 기술적이고 충분한 자금력을 필요로 하며 생명공학 의존형 (dependency) big pharma 모델은 또하나의 기회가 된다.
스위스의 모델을 배워, 영국정부는 제약회사로부터 개발단계기술을 스핀아웃하는 것을 도와야 한다. 이로써 제품혁신이 계속되는 한편, 유능한 인력을 순환시킬 수 있고, 개인의 능력을 영국 내에 계속적으로 보유할 수 있다. 회사가 커지면 커질수록 의약품 개발단계의 파이프라인 제품을 갱신할 가능성도 커지기 때문에 big pharma에게도 유리하다.
영국에서 초기단계 생명공학 기업에 제약회사가 투자하는 것은 장려할 필요가 있다. 예를 들어 생명공학 벤처 자회사로 SR1을 운영하고 있는 GSK에 적용할 방법을 살펴보면, 시작기업에 투자하는 UK 투자펀드를 구성하는 것이다. 즉 초기 투자가와 정부가 펀드를 형성하고, big pharma가 가세하는 것이다. 이러한 방법으로 초기기업이나 스핀아웃에 대해 초점을 맞춘 것이기 때문에, 나중에 투자한 big pharma는 세금과 자금에 대한 인센티브를 확보할 수 있고, 이로써 구분이 명확해진다.
또한 제약회사들은 전세계 생명공학 중소기업을 대상으로 직접 투자를 계속할 것이다. 의약품 개발활동을 영국에 유치하고, 생명공학 중소기업과의 협력이 용이하도록, 영국 정부는
. 생명공학 중소기업에 대기업이 투자한 자본납입 (capital contribution)에 대해 세금공제 혜택을 부
여하자. 자본납입에 대한 세금공제는 다른 나라에 없는 제도이므로, 영국에 대한 투자 유인책으로 활
용할 수 있다. 이때 특허 창출에 기반을 둔 사업모델의 소기업이 투자하는 경우에만 혜택을 주어야
한다.
. 의약품 개발에 파트너로 참여한 대기업에 따라 발생하는 세금관련 수입으로 중소기업에 손실이 발생
. 의약품 개발에 파트너로 참여한 대기업에 따라 발생하는 세금관련 수입으로 중소기업에 손실이 발생
하는데, 이러한 손실을 인정해야 한다. 만일 대기업이 최소 75%의 지분을 갖고 있다면, 대기업은 이
러한 위험을 낮추거나 다른 영역으로 대체할 것이기 때문이다.
. 제약회사가 영국 내에서 연구 활동을 유지하도록 지적재산권 관련 세제제도를 개발하여 제약회사를
. 제약회사가 영국 내에서 연구 활동을 유지하도록 지적재산권 관련 세제제도를 개발하여 제약회사를
격려하자. 예를 들어 최근 벨기에는 수입에 대한 세율을 6.8%로 낮추었다. 이러한 제도로 제약회사
가 영국 내 R&D와 제조에 대해 투자를 유도하고, 장기적으로는 이들 기업이 납부하는 세금이 증가할
것이다.
생명공학 중소기업을 되살리는 또다른 방법으로 대기업들의 스핀아웃을 유도하여 영국 내 새로운 기업들을 만드는 것이다. 이때 대기업에서 중소기업으로 자산이 이동할 때 면세혜택을 부여하는 인센티브를 부여한다. 현재 대기업은 자산이동에 대해 세금을 내고 있다.

□ R&D에 대한 정부 투자
Sainsbury경의 'Race to the Top' 보고서에서 제안된 Small Business Research Initiative(SBRI)제도는 DIUS의 백서 'Innovation Nation' 에서 채택되었으며, 2009년 4월까지 프로그램 내용이 마련된다.
SBRI는 새로운 아이디어는 아니다. 이미 세 번인가 네 번째로 언급된 것으로 생각된다. 장기 투자에 의해 이익을 오랜 세월 창출하는 개념이기 때문에, NHS과 관련지어 보건부에서는 매우 중요한 것이다.
○ 초기 임상단계에서 위험을 줄인다.
생명과학 기업에 투자하는 것의 큰 걸림돌의 하나는 불확실성에 대한, 위험이 높은 투자라는 것이다. 임상에 착수할 제품을 확보한 기업은 다음과 같은 위험을 안고 있다.
. 규제라는 장애물
. 제품 효능에 대한 불확실성
. 제품의 안전성에 대한 불확실성
. 예상되는 비용과 시간표에 대한 불확실성
. 앞으로 일어날 위험
전문투자가의 대부분은 이러한 위험을 이해하고, 위험을 최소화하는 방법을 찾게 된다. 만일 방법론에 대한 정보, 전문가에 접근하는 방법, 장비에 대한 최신 정보, 임상시험 비용의 절감방법 등을 생명과학 기업이 숙지하고 있다면, 투자자들은 금번 투자에 대해 훨씬 안심하게 될 것이다.
기업이 임상시험을 수행하는 것을 지원하도록 마련된 시설과 전문가에 접근하는 방법에 대한 이니셔티브로
. Wellcome Millennium Centres
. Wellcome Trust Clinical Research
. NIHR Clinical Research Facilities, Biomedical Research
Centres and Biomedical Research Units
. Experimental Cancer Medicine Centres of NIHR and CR-UK
. Wellcome Drug Seeding Programme
. Database of Experimental Medicine
. NIHR Clinical Research Networks
. MRC Developmental Pathway Funding Scheme
. IMHRA clinical trial advice service
. NICE Consultancy providing advice in phase 1 and 2 trials
. Wellcome Millennium Centres
. Wellcome Trust Clinical Research
. NIHR Clinical Research Facilities, Biomedical Research
Centres and Biomedical Research Units
. Experimental Cancer Medicine Centres of NIHR and CR-UK
. Wellcome Drug Seeding Programme
. Database of Experimental Medicine
. NIHR Clinical Research Networks
. MRC Developmental Pathway Funding Scheme
. IMHRA clinical trial advice service
. NICE Consultancy providing advice in phase 1 and 2 trials
그러나 이들 기관을 이용하는 것이 너무 비싸거나, 학구적인 성향을 띠고 있어, 많은 생명과학 중소기업들이 그들이 필요하지 않다는 이유로 접속하지 않고 있다.
미국의 경우 2006년 NIH를 통해 이루어진 임상시험 투자비용은 4백6십만$. 그러나 영국정부로부터 산업계로 임상시험을 지원한 경우는 없다. 활용할 수 있는 투자비용이 적기 때문에 영국 기업은 미국에 비해 성공할 제품이 거의 없다고 인식된다. 미국의 경우 한두번의 실수는 용납되지만 영국의 경우 그렇지 않다.
종합하면, 영국 생명공학에서의 투자환경은 다른 어느 때보다 매우 나쁘다. 인구통계를 살펴보면 더욱 심각하다. 즉 국민 전체가 늙어가고 있으며, 노령인은 질병과 장애 없이 가능하면 자유롭게 살기를 원하고, 혁신적인 의약품들이 이러한 문제를 해결하기를 기대한다. 따라서 의약품 시장은 오직 증가할 것이다. 그러나 성공에 대한 실적이 없다는 것에서 이 부문에서의 투자자가 발길을 돌리게 만드는 것이다. 지금 필요한 것은 투자자가 흥미를 갖도록 보다 개선된 비즈니스 모델과 구조를 개발하는 것이다.
3장 지식기반 개발 및 이해 증진
□ 서론
생명공학 부문은 연구 아이디어로부터 많은 파이프라인 제품을 창조하고잠재력 있는 제품을 임상으로 중개하며, 공중 건강을 개선하기 위해 안전하고 효과적인 제품을 개발하는 것으로 번영하는 것이다. 영국은 혁신분야에서 세계적인 리더이며, 생명과학 부문의 급속한 성장 원동력이 될 신제품 관련 아이디어를 창출하는 경우에도 매우 성공적이다. 그러나 2003년부터 중개연구와 개발에 대한 진척속도가 느려졌다. 지금부터 2015년까지 우리가 생명공학 산업을 도와주어야 할 일들은 혁신적인 의약품이나 의료처치방법을 강력하게 흡인하는 과정을 만들기 위한 아이디어들이다.
여러 가지 이유들을 들어 파이프라인 제품의 진행을 지연시키지만, 대표적인 세 가지를 구별하면,
. 스스로 신약 개발을 위축시키는 산업에서의 실패
. NICE로부터 승인받기 위한 현재 절차
. 새롭거나 혁신적인 의약품에 접근하는 임상연구자들의 우유부단성
. 스스로 신약 개발을 위축시키는 산업에서의 실패
. NICE로부터 승인받기 위한 현재 절차
. 새롭거나 혁신적인 의약품에 접근하는 임상연구자들의 우유부단성
□ NICE 승인/평가
National Institute for Health and Clinical Excellence (NICE)로부터 영국내 진행되도록 이루어지는 승인은 제조자, 환자, 의약품 값을 지불하는 사람 및 여론과의 관계에 점차 중요해지고 있다. NICE 승인은 기업체가 시장에 접근하여 이익을 창출하는 기회를 제공하는 것이며, 파이프라인 후보에서 어떤 물질을 결정하는 가에 대한 정보를 제공한다. 이러한 과정에서 들려오는 불만은 왜 다른 나라보다 영국 환자들이 신약후보물질로부터 혜택을 받을 수 없는가이다. 현재 영국기업들이 느끼는 문제점은 NICE 승인이 혁신을 지원하는 것이나 신약에 접근하는 것으로 유도하지 않는다는 것이며, 이러한 이유로 영국 내 투자를 기피한다.
□ 의약품 발견 모델
기존 ??생명과학 2015??보고서 (2003년)에서, 2015년에는 의약품의 필요성을 어떻게 평가하는가에 대한 모델이 변화하고, 신약을 생산하는 작업환경도 극단적으로 변화할 것이라고 예측하였다. 5년이 경과한 현재, 제약회사나 생물공학 기업들은 전통적인 의약품 발견, 개발, 상품화 모델이 무너졌으며, 따라서 철저하게 변해야 한다는 것을 인식하고 있다. Richard Clark (Merck사의 CEO)는 ‘만일 우리가 비즈니스 모델을 바꾸지 못한다면, 우리는 산업적으로 살아남지 못할 것이다’라고 지적하였다.
이러한 현상은 신약을 개발하는 비용과 소요시간은 길어지고 있는 반면, 특허기간이 만료되어 특허로 보호받을 수 있는 신약후보물질을 파이프라인으로부터 선택할 숫자가 점차 감소하고 있는 것에 기인한다.
이러한 현상은 신약을 개발하는 비용과 소요시간은 길어지고 있는 반면, 특허기간이 만료되어 특허로 보호받을 수 있는 신약후보물질을 파이프라인으로부터 선택할 숫자가 점차 감소하고 있는 것에 기인한다.
세계적으로 의약품산업에 이익을 가져다줄 대부분의 신약후보물질은 1980년대 말부터 1990년대 초에 개발된 것이다. 상당수의 블록버스터 의약품의 특허기간이 만료되기 때문에, 수입의 상당부분을 잃게 되는 제약기업은 2009년부터 2011년 벼랑 끝에 서게 될 것임을 직면하고 있다. 생명공학 기업들이 의약품 파이프라인을 보충할 제품들을 공급하고 있지만, 만일 의약품 개발-승인절차에 대한 비용, 위험, 시간이 감소된다고 하여도, 산업분야의 혁신 속도나 새로운 치료방법을 도입하는 것은 점차 느려지고 있다.
의약품을 개발하고 환자를 대상으로 시험해보는 위험 배분에 대한 변화가 필요하다. 이중 초기단계에 환자에게 의약품을 제공하는 분야로 orphan drug로써, 이 약품들의 종류는 점차 확대되고 있다.
□ the Ministerial Industry Strategy Group
the Ministerial Industry Strategy Group (MISG)는 보건부, BERR, DIUS, 재무부 장관과 글로벌 산업계 대표로 구성되며, 정부와 제약기업과의 관계를 검토한다. 포럼도 개최하지만, 전략적인 주제로 action 프로그램을 수립하기도 한다. 최근에 소기업 대표를 그룹 멤버에 포함시켰는데, 이러한 행동은 적절한 균형을 확보하는데 바람직한 것으로 평가할 수 있다. MISG가 산업에 기여하는 정부 주도의 다양한 이니셔티브에 대한 전체론적인 시각을 가질 필요가 있다.
영국이 글로벌 리더십을 갖기 위해서는 세 가지 시스템을 발전시켜야 한다.
. 의약품 개발에 대해 재정의
. 협력, 규제책임, 건강관련 기술 분석의 강화
. 최근에 발생한 기술과 이슈에 대한 장려와 지원 강화
. 의약품 개발에 대해 재정의
. 협력, 규제책임, 건강관련 기술 분석의 강화
. 최근에 발생한 기술과 이슈에 대한 장려와 지원 강화
□ 의약품 개발에 대해 재정의
하나의 의약품이 시장에 나타나고 환자들이 신약에 접근할 수 있는지에 대해 단속자가 결정할 수 있다. 그런데 단속자가 의약품 승인에 대해 점차 보수적인 자세를 취하고 있으며, 이는 환자 입장에서 손해가 된다. 환자 침대 곁으로 아이디어가 접근하는 길에서 몇몇 단속자가 존재한다.
국제 규모의 단속 커뮤니티에서 대표적인 것은 1960년대 후반부터 1970년대 초반 과학이 번창할 때, 과학과 방법론 관점에서 우려하는 목소리로부터 형성되었다. FDA의??Critical Path Initiative??에 따르면 기초 의학과학에 투자와 진전은 기대를 넘어설 정도로 빨랐고, 환자에 대한 임상이 매우 심각한 걸림돌이 되었다. 금세기 발전을 진전시키기 위해 지난 세기의 도구와 하부구조를 평가하기 시작했다. 이러한 문제를 해결하기 위해, FDA는 시뮬레이션 모델, 바이오마커, 새로운 임상 디자인 병원균 검출방법 등 의학 관련 제품개발과정에 과학발전을 접목시키고 제품개발에서 특별한 장애물을 제거하기 위해 critical path scientific area에 응용연구 프로그램을 도입했으며, 첨단 과학을 반영할 수 있도록 규제표준을 현대화하였다.
EU의 Innovative Medicines Initiative와 같이 많은 연구가 이 분야에서 이루어지고 있지만, 급속히 발전하는 과학에 따라 적응하면서 중소기업에게는 도움이 될 만한 새로운 의약품 개발과정은 아직 마련되지 않았다.
의약품은 세계 시장에서 활용되는 것이기 때문에 국제 단속자의 요구를 만족해야 한다. 따라서 영국은 FDA와 EMEA와 협력하여 의약품에 대한 초기 개발단계를 다시 디자인하고 이러한 개념을 도입하는 작업을 진행하고 있다. 즉 MHRA는 EMEA 이사회에서 CEO로 일하고 있다.
MHRA, NICE, NHS, 산업계, 교육계의 전문가로 구성되는 국가 규모로 운영될 이니셔티브는 새로운 접근법을 실증하는 방법론을 정의하기 위해 설립되어야 한다. 여기서 개발되는 접근법은 NHS Connecting for Health Research Capability Programme과 UK NHS IT system 개선에 기여해야 한다. 또한 이 접근이 유럽 단위의 규제관련 법규에도 반영되어야 한다.
EC, EMEA, MHRA, FDA 등은 협정, 첨단치료 의료제품, 정보교환 등 주제로 쌍무회의를 갖는 것과 같이, 다양한 영역의 단속자들은 경우에 따라 회합을 갖는다. 그러나 이들은 규제과정 전체를 재편할 필요성에 대해 발표하는 경우는 드물다.
의약품 개발에 윤활유를 공급하거나 의약품 분자를 환자에게 접근하는 용이한 길을 찾기 위해 지난 5년간 정부와 산업계에서 운영한 이니셔티브는 상당수에 달한다. 즉 Darzi경의 'Next Stage Review of the NHS' (2008), Sainsbury경의 'Review of Science and Innovation' (2007), MISG의 'Long-Term Leadership Strategy'(2007), David Cooksey경의 'Review of UK Health Research Funding' (2006), 'Lambert Review of Business-University Collaboration'(2003).
Connecting for Health에 의해 진행된 이들 이니셔티브는 영국이 통합이 잘 되어서 가능하면 의약품 규제에 관련된 토의를 가속화시키려는 것.
따라서 우리가 이러한 열망을 이해한다면, 최신 과학 동향을 놓치지 않으면서보다 적합한 규제를 만들 수 있는 기회를 놓치지 않을 것이다.

□ 계층화되는 질병 전략에 대하여
유전자 진단법 발전에 따라, 특정 환자 그룹들이 의약품에 대한 민감성을 예측할 수 있게 되었다. 이러한 계층화 질병 (stratified disease)에 대한 개념이 맞춤형 의료 (personalized medicine)이다.
맞춤형 의료가 전임상과 임상시험을 시작하는 단계에서도 도입될 수 있다면, 표적 대상에 대한 보다 적은 규모로, 보다 적은 비용으로 진행될 수 있을 것이다. 이때 동물실험에서도 사용하는 마리수와 스케일도 줄일 수 있게 된다. 이러한 시험은 통계학적 신뢰도를 제공하는데도 적용된다. 이 의약품은 반응할 사람에게만 시험하기 때문에, 부작용에 대한 위험을 줄일 수 있고, 또 의약품에 따른 치료효과를 확인하는데 보다 긍정적으로 작용한다. 임상 전체과정의 소요비용을 줄일 수 있고, 환자 확보에 대한 노력도 줄일 수 있으므로 빠르게 진행된다.
임상시험 비용은 기업체가 초기 투자를 확보할 수 있는지 아니면 매각해야 하는지를 결정하는 주요한 요인이다. 만일 의약품 개발에 대하여 다시 정의된다면, 생명공학 기업들은 많은 후보물질들을 임상시험에 제공할 수 있으며, 이중 하나가 임상시험에서 실패하더라도 자금 측면에서 파산하는 위험에서 벗어날 수 있게 된다.
계층화된 질병 전략을 구현하기 위한 필요한 많은 부분을 영국 내에서 사설이나 공설기관으로 확보하고 있다. 영국은 생명과학이나 생물정보학 분야에서 세계 수준이며, 센터 내부에서 질병이나 환자 권리 등을 어떻게 관리해야 할지에 대한 모델도 확보하고 있다. 그러나 이러한 모델이 잘 배치되어 있기에는 충분하지 못하다. 만일 정부나 산업계에서 세계적 경쟁에 발맞추기 위해서는, 미흡한 점들을 곧바로 수정하고 도입할 수 있어야 한다.
산업계는 이러한 방향으로 많은 진척되었는데, 우리는 아직 충분하지 않다. 계층화 전략이 적용될 질병은 정신분열증 등 중추신경 시스템, 당뇨병, 암, 알츠하이머 치매 등이며, 이들 모두 생물의약품 산업계 모두 통상적으로 연구하고 있는 질병이다. 초기개발단계에서 인체에 대한 충분한 데이터를 확보하는 것은 어렵지만, 현재 효능과 독성과 관련된 바이오마커로부터 많은 데이터를 얻고 있다.
이 분야에서 전임상에 대해 비경쟁적으로 작업할 필요가 있다. 만일 특정 의약품 타겟에 대해 기업체들이 준비해야 한다면, 교육기관에서 필요한 마커를 개발하고 국제경쟁력을 확보하기 위한 표준을 마련해야 한다. 교육기관은 기업체가 가장 관심갖는 분야가 무엇인지 파악해야 하며, 기업체 관심분야와 교육기관 COE가 배치된다면 예를 들어 임상약학 분야 등에서의 인력양성 필요성이 발생하게 된다.
Connecting for Health와 같은 대단위 이니셔티브 운영에 의해 사람에 대한 고급 데이터를 얻는 것이 목표가 되며, 필요한 환자를 확인하는 것을 도와줄 수 있다. 이러한 데이터들에 접근하는 것은 적절한 익명성과 관리로 산업계가 사용할 수 있는 임상을 진행할 수 있도록 설계하는데 필요한 정보를 창출한다.
2008년 11월 총리는 보건부와 Innovation, Universities and Skills로부터 주요 연구 결과를 중개하는 것을 활성화하는 방법에 대해 보고받았고,'National Ambitions for Translational Health Research'로 구체화될 것이다.
'National Ambitions'는 Office for Strategic Co-ordination of Health Research (OSCHR) 후원으로 마련될 것이다. 임상 필요성을 분석하는 것도 이루어진다. OSCHR의 UK Health Research Opportunities의 일환으로 이루어진다.

□ 규제책임, 의료기술평가 (Health Technology Appraisals) 등 협력 강화
의약품 개발을 재정의하는 것은 건강과 부의 창출에 관한 기업체의 목표를 정부가 지원하는데 필요한 일련의 변화를 의미한다. 즉
. 제약회사, 생명공학 기업, 교육계, 환자 사이에 협력을 증가
. 감독자에게 보다 큰 책임. 새롭거나 혁신적인 의료법으로 환자들이 혜택을 받는 것을 방해하는 방
. 제약회사, 생명공학 기업, 교육계, 환자 사이에 협력을 증가
. 감독자에게 보다 큰 책임. 새롭거나 혁신적인 의료법으로 환자들이 혜택을 받는 것을 방해하는 방
법으로 지나치게 보수적이지 않는 방법으로
. 환자 결과와 연계된 보다 개선된 의료기술평가 (Health Technology Appraisal)
. 환자 결과와 연계된 보다 개선된 의료기술평가 (Health Technology Appraisal)
○ 더 협력하자.
과학은 경계가 없으며, 협력 또한 경계가 없다. 기존??생명과학 2015 보고서??에서, NHS와 산업에서 생산성을 높이기 위해 일을 같이하도록 격려하는 많은 방법이 있었으나, 환자 입장에서 기여할 수 있는 시각과 능력에 대해서는 언급되지 않았다.
의약품 개발에서 새로운 접근을 창조하기 위해서 경계 (organisational boundary)를 넘어설 수 있는 산업계, 교육계, 환자 그룹과 협력을 증가시킬 잠재력이 필요하다.
환자 그룹이 신약개발과정에서 기여할 수 있는 내용을 살펴보면,
환자가 무엇을 원하고, 이러한 처리법을 통해 무엇을 준비해야 하는지를 파악할 수 있으며, 환자 그룹과 계약은 임상시험 때 환자모집 속도를 높일 수 있고, 이때 자선기관 등은 시험에 필요한 등록환자 정보를 제공하며, 환자 입장에서 보면 필요한 시험에 접근하는 것이 빨라지고, 기업체는 임상비용을 줄일 수 있다. 또한 많은 charity들이 의학 연구개발에 필요한 자금들을 기부하고 있다.
환자가 무엇을 원하고, 이러한 처리법을 통해 무엇을 준비해야 하는지를 파악할 수 있으며, 환자 그룹과 계약은 임상시험 때 환자모집 속도를 높일 수 있고, 이때 자선기관 등은 시험에 필요한 등록환자 정보를 제공하며, 환자 입장에서 보면 필요한 시험에 접근하는 것이 빨라지고, 기업체는 임상비용을 줄일 수 있다. 또한 많은 charity들이 의학 연구개발에 필요한 자금들을 기부하고 있다.
정부 차원에서 암, 심장질환, 비만 환자 관리하고 있는데, 많은 환자들은 이들 우선권에서 제외되어 있는 경우도 있다. 이러한 질병으로 신경과학이나 안과 등은 영국 의학에서 강한 분야이다. 이들 질병의 경우 상환에 대한 상업적 의문 때문에 초기 임상단계에서 funding gap이 있다. 정부의 우선관리 질병 외의 질병분야에서 뛰어난 혁신을 이룬 생명공학 기업들도 있다. 이러한 질병분야를 지원하게 되면, 특정분야에서 의약품 개발을 촉진할 수 있다. 기업은 혼자 힘으로 의료분야 개선을 지속할 수 없다.
big pharma가 R&D 모델을 재설계하고 있는데, 생명과학 산업과 협력하기 위해 영국 대학 부문과 전에 없던 기회를 마련하고 있다. 생명과학 연구를 지원하는 공공자금, MRC, BBSRC, NIHR, TSB 등은 최근 중개연구를 지원하고, 동시에 산업과의 제휴에 대해 인센티브를 제공하고 있다. 중개연구와 산업화 분야에서 영국 대학 문화에서의 부업이라고 생각하던 시각이 대학의 핵심 미션으로 변화되고 있다. 그러나 대학 문화를 변화시키는 것을 도와주는 인센티브가 필요하다.
전통적인 교육행동과 마찬가지로 산업계와 협력을 경력으로 인정하는 경향이 늘고 있다. DIUS, Universities UK로부터 연구비를 지원받는 대학 섹터에 대한 good practice가 늘고 있다. 연구비지원 위원회들은 기업체를 동반자로 하는 협동연구를 촉진하는 방법을 개발해야 한다.
연구비 지원기관은 대학의 연구자와 연구결과를 이용할 사람과의 협력을 도와주고 있다. 2008년 12월에 발간된 보고서에 따라, 가장 최근 Research Assessment Exercise (RAE)는 사용자를 초점으로 하는 연구를 목표로 한다.
HEFCE는 business research income에 근거하여 QR block grant를 통해 특별히 지원하고 있다.

○ 보다 개선된 NICE Appraisal
NICE 존재 때문에, 영국은 Health Technology Appraisals (HTA)에서 리더이며, 영국 HTA는 WHO로부터 세계적으로 중요한 모델로 평가되었다. 우리는 이러한 리더십 위치를 개발하고 확보할 기회를 갖고 있다. HTA 시스템으로서의 NICE는 환자에게 중요한 의약품을 접근하는 것에 대해 안전성을 제공하려는 것을 도와준다.
미국 등 다른 나라에서는 HTA가 산업의 미래에 대한 필수 원동력으로 인식하고 있다. NICE의 위치와 자원을 올바르게 활용하여 NHS에게 경제적 초기평가를 제공하고, 기업체가 그들 시장을 보다 명확히 이해함으로써, 영국의 경쟁적 우위를 유지할 수 있다.
그러나 NICE 심사과정에서 지체가 일어난다. 즉 2004년 4월부터 2008년 8월까지 NICE가 심사한 74건에 따르면, 심사 초기부터 지도 발간까지 기간은 164일부터 1,410일로, 평균 698일인 거의 2년이다 (ABPI 자료). 그러나 NICE Single Technology Appraisal process이나 Cancer Reform Strategy 개발을 위해서는 심사기간이 짧아져야 한다.
'Improving access to medicines for NHS patients' 보고서에 따르면새로운 항암제에 대한 심사기간을 평균 6개월 이내로 기대하고 있다.
NICE의 최근 몇 가지 결정에 대해 투명성이 결여되었다고 기업체는 보고 있으며, 이러한 결정에 이르는 과정은 산업계와 공공섹터에게 피해를 주고 있다고 믿고 있다. ABPI 분석에 따르면, 2005-2007년 항암제 개발건수는 영국에서 증가하였지만, 유럽국가와 비교하면 아직도 적다.
17개 항암제 신약 중에서 영국에서 10개가, 유럽에서 2개, 기타 국가에서 5개가 계속되고 있다. NICE는 지난 5년간 4개 항암제 (Alimta, Velcade, Erbitux, Tarceva)가 광범위 용도로 겨우 승인하였고, 하나는 거절하였다.
이 분야에서의 데이터는 변수가 있기 때문에, 최근 PPRS agreement에 따라 정부와 ABPI가 국제수준과 비교하여 더 이상의 일을 진행하고 있다.
영국 임상의들은 외국 표준임상진료기준 (standards of care)에서 평가된 의약품을 사용하지 않는 경우가 늘고 있다. 임상의가 이러한 의약품을 사용하지 않는다면, 그들은 이들 약품 사용에 따른 경험이 적어지고 환자들에게 치명적이 될 수 있다.
임상시험 설계에도 또한 어려움이 있다. Michael Rawlins (NICE 회장)이 Financial Times (2008년 10월 17일자 NICE questions drug test methods)에 기고한 글에서, 제약회사가 사용하는 주요한 안전성과 효율성 방법이 증거의 gold standard가 되지 못하고 있다고 지적하였다.

○ 새로운 기술과 이슈에 대한 지원 강화
생명과학 섹터에 관련된 새로운 이슈로 영국 내 제약회사가 문을 닫고 직장이 줄어드는 것이다. 한편 생명공학 상업화에 있어서, 유전자재조합 단백질을 시작으로 단일클론항체와 재활의학은 새롭게 부상하고 있다. 새로운 이슈와 기술은 생명과학 섹터의 발전에 어떤 형태로든 기여해야 한다.
재활의학
재활의학에 관여하는 생명과학 회사의 상당수가 2003년부터 급성장하고 있으며, 이 분야의 이점은 기존 생명과학 2015 보고서에서 언급되어 있다. 재활의학은 1950년대 골수이식부터 오래된 것이며, 현재 화상환자에게 피부를 재생시키거나 안과환자에게 각막을 생장시키는 것에서 환자들에게 도움을 주고 있다. 단일클론항체 산업에서 성공한 바와 같이 영국에서는 이러한 신규 산업 개발을 육성하는데 잠재력이 크다.
Pattison 보고서 'The UK Stem Cell Initiative' (2005), the Human Fertilisation and Embryology Act (2008), International Stem Cell Forum, the UK Stem Cell Bank, 다양한 이니셔티브 및 지역 네트워크 등 치료법을 개발하는 것을 목표로 하는 지난 5년간 진행된 정책에 의해 영국은 이 분야에서 아직도 리더이다.
민관협동의 'Stem Cells for Safer Medicine'은 독성 예측에 사용할 줄기세포를 개발하는 것이지만, 앞으로 재생의학에 필요한 기술 개발에 기여할 것이다. 2008년 Pfizer는 Cambridge대학에 4천만 파운드를GSK는 미국 Harvard Stem Cell Institute에 2천5백만$을 투자하는 등 big pharma가 재생의학 프로그램에 참여함에 따라, 재생의학은 이제 중소기업 영역에서 벗어났다.
정책과제는 교육기관이나 NHS를 도와주는 것을 목표로 하고 있지만 재생의학에 참여하는 기업체도 특별한 도움이 필요하다. 미국의 경우 재생의학 치료기술을 가속화하기 위해 설립되었던 Armed Forces Institute for Regenerative Medicine (AFIRM)의 성공에서와 같다.

재생의학 산업이 상업화하기 위해 실험실 결과를 중개하는데 필요한 단계를 scale-up 중개연구센터는 담당할 것이다. 즉 센터는 연구자 생산자, 임상의 사이에 인터페이스로, 각 센터는 실험실 및 생산시설을 갖추는 동시에, 재생의학 기업체를 보육하는 공간도 포함한다. 또한 이들 기업체는 scale-up 기술과 공정을 제공해야 한다.
BBSRC Bioprocessing Research Industry Club (BRIC), bioProcess UK KTN, MRC, TSB, NIHR 등과 협력하여 UK Stem Cell Initiative (UKSCI)의 줄기세포생산 유니트에서 설치할 장소로 추천한다. 10년 가동한다고 예상하여 두 센터에 투입할 비용은 매년 6백만 파운드가 될 것이다.
영국은 줄기세포 연구에서 주도권을 갖고 있으며, UKSCI로부터의 투자에는 새로운 치료법에 대한 중개연구가 포함되어 있지 않다. 그러나 미국에서는 최근 허용하는 변화를 보이고 있어, 주도권을 유지하는 것이 어려워지고 있다.
4장 인적자원
□ 서론
기업체에서 효과적인 리더십과 경영을 위해서는 올바른 전략을 수립해야 하고, 상업적으로 성공하기 위한 기회를 늘려야 한다. 기업 내부의 리더십과 경영 팀의 질적 수준은 투자자가 투자를 결정하는데 필수적인 요인이지만 대기업에 비해 중소기업은 유능한 인재를 유인하는데 결정적으로 불리하다.
영국에서 생명과학 창업의 대부분은 대학에서 시작된다. 자주 설립자들은 회사를 운영하거나 CEO가 되기를 원하지 않는다. 대학에서 개발한 모델은 기업체와 같이 경험을 공유하는 것이다. 비즈니스 발전의 여러 단계를 경험한 개인들은 경영팀의 지원이 있다면 도움이 될 것으로 기대하고 있다.
□ 리더나 경영자의 확보, 유치
많은 수의 과학자나 최고 경영자들이 영국을 떠나 미국, 유럽 주요국가의 생명과학 클러스터를 향하고 있다. 만일 생명과학 섹터가 강화된다면 본 섹터가 정립되고 발달된 국가로부터 리더나 경영자를 영국으로 데려올 수 있다고 믿는다. 또한 영국은 해외로부터 유능한 인재가 되돌아오도록 많은 일을 해야 한다.

생명공학 회사를 새로 설립하는 것은 기존 사업지원 서비스와는 다른 전문적인 지식이 필요하다. 기술을 바탕으로 하며, 벤처투자자에 의해 스핀 아웃된 경우 이들 조직은 지적재산권에 대해 제한적인 경험을 갖고 있으며, 제약회사 출신 개인들은 생명공학의 활용법, 기업 커뮤니티 내에서의 교류 등에 대해 보다 많은 지식이 필요하다. 따라서 제약회사에서 스핀 아웃을 유도하기 위해, 자문 네트워크, 사양정보 (information pack), 올바른 인력 (멘토, 투자자, 사업가 등) 등 시스템을 만들 필요가 있다.
지적재산권은 생명공학 기업에서 활력이지만, 제약회사 모기업으로부터 필요한 지적재산권을 선택하는 것은 스핀 아웃을 운영하는데 필수적이다.

□ Sector Skills Agreement
리더십과 기업가정신은 생명과학에서 상위기술 (priority skills) 분야이다. 기존‘생명과학 2015’에서 Sector Skills Councils (SSCs)를 제안하였다.
기존 Semta도 생명과학 섹터의 SSC이며, 2008년 5월 Sector Skills Agreement (SSA)와 Action Plan을 발표하였다. SSA는 고용주와 투자가가 협력하여 만들어지며, 산업 기능에 대한 요구를 만족시키기 위해 운영된다.
결론적으로 ‘생명과학 2015’ 발간 이후, 우리들은 이를 기대하지 않았지만, 미래를 위해 필요한 일로 판단한다. 이러한 일로 Bioscience Sector Strategy Agreement가 필요하다.
Bioscience Sector Strategy Agreement Action Plan에는 생명과학 산업에서 요구하는 기능과 교육을 정의하며, 어떻게 진행되어야 하는지에 대하여 상술해야 한다.
2008년 4월에 완성된 Action Plan의 주요 테마는
. 리더십과 기업가정신
. 최상 수준의 전 종업원 (work force)
. 이미지와 매력
. 네트워크와 클러스터이다.
. 리더십과 기업가정신
. 최상 수준의 전 종업원 (work force)
. 이미지와 매력
. 네트워크와 클러스터이다.


Bioscience SSG에 의해 다양한 멘토와 리더십 훈련 시스템을 도입연계한다. BIA Mentoring and Management Development Programme도 이중 하나다.
BIA의 Advisory Committee와 함께 표준화된 사양정보와 가이드라인을 개발할 것이다.

□ 최상 수준의 전 종업원 (work force)
이 주제는 기존 ‘생명과학 2015’ 보고서에서 추천한 내용을 반영한 것으로, 전 종업원이 특수기능으로 무장하는 것을 말한다. 산업체에서는 현장능력이 입증된 고급 과학자를 필요로 한다.
Semta는 National Occupational Standard (NOS)를 통하여 기술 레벨에 대한 이슈를 진행하였고, Research Councils들도 다학제간 고급 학위에 대한 지원을 늘리고 있다. 전 종업원을 최상 수준화하는 조건을 마련하는 방안은 DIUS의 'A vision for Science and Society' 최신 보고서의 핵심이다.
기존‘생명과학 2015’보고서에서 추천한 바와 같이, 다학제간 학위과정도 본 주제와 같은 의미이며, 기술의 진보와 함께 매우 중요한 이슈로 부각되고 있다.
Semta에서 기존 NOS와 새로운 National Occupational Standard로 다음 항목을 개발하고 있다.
. 기존 종업원에 대한 현장기능
. 학교에서 총명한 젊은 인력을 훈련시키는 기작을 제공하는 것
. 기존 종업원에 대한 현장기능
. 학교에서 총명한 젊은 인력을 훈련시키는 기작을 제공하는 것
산업계와 대학은 석사나 박사와 같은 고급 학위과정에서 다학제가 포함되는 것에 대해 협력해 왔다. Research Councils도 이러한 관점에서 열심이며, 장기간 노력이 필요하다는 것을 인정한다. bioProcessUK는 생물공정 기능을 갖춘 박사를 매년 120명에서 240명 배출하는 것으로 목표하고 있다.
ABPI, BERR, Bioscience Federation 공동 작업한 2007년 10월 보고서에 따르면, Kings College에서 운영할 the Capacity Building Initiative in Integrated Mammalian Biology와 같은 프로그램 여름학기에 BBSRC가 5년간 10만 파운드를 지원한다. 또한 Drug Discovery 프로그램 석사과정 20-30개에 기업체가 공동 지원하고 있다.
이러한 프로그램은 Strategic, Important and Vulnerable Subjects list (SIVS)에 포함된 in vivo 실험과정에 불과하다.
Higher Education sub-group of the Bioscience SSG는 Higher Education Institute와 공동으로, 생명과학/ 생물공학 학위에 필요한 커리큘럼에 실용적인 과목을 개발하는 작업을 진행할 것이다.

□ 이미지와 매력
생명과학을 경력으로 인정하는 이유가 세 가지 있다.
첫 번째는 세포치료, 단일클론항체, 유전자치료 등 생명공학 혁신에 따른 새로운 의학 필요성에 대한 요구가 증가하고 있다는 것.
생명공학은 이타적이고 이상적인, 유능한 젊은 졸업생을 요구할 의무가 있으며, 이들이 다른 분야로 가지 않도록 공공보건을 개선하는 등의 동기를 부여해야 한다. 이러한 동기를 대부분의 의학 연구자는 수용한다. 동시에 피고용인으로써 남부럽지 않은 봉급과 작업환경을 기대한다.
결론
‘생명과학 2015’ 보고서에서와 같이, 영국 의약품산업과 생명공학 섹터는 의약품 발견과 개발에서 진보를 계속하고 있으나, 미국 등 외부와의 경쟁에서 밀리고 있다. 국제 경쟁력을 유지하기 위해 생명과학 섹터를 재평가하여 2015년 목표를 설정하기 위해서, 영국의 과학적 우수성을 건강보건에 접목시키기 위한 요인을 분석하였다.
생명과학 산업을 활성화할 BIGTR2의 검토는 네 분야, 즉 자금, 규제, 새로운 아이디어, 인력 및 자원분야 면으로 나누어 구성된다.
생명과학 산업을 활성화할 BIGTR2의 검토는 네 분야, 즉 자금, 규제, 새로운 아이디어, 인력 및 자원분야 면으로 나누어 구성된다.
영국 생명과학 섹터에 대한 자금 검토는 최근 세계적 금융 위기에 따라 IPO 창구도 닫히고, 벤처투자가의 흥미도 줄어들고 확신도 사라졌으며 제약 대기업은 비즈니스 모델을 재검토하고 있다.
우리는 글로벌 단계에서 영국의 위치를 유지하기를 원한다. 생명과학 마케팅전략에 대한 UKTI의 새로운 전략은 해외 우수기업들을 런던주식시장에 상장시키고, 해외투자자금을 영국에 유치하려는 것이다. 또한 Global Entrepreneurs Programme을 통해 미국에서와 같이 투자가에게 투자기회를 유도한다 (수정안 8).
우리는 정부가 R&D 세금공제 기회를 확대하고 (수정안 9), 제약회사가 생명공학 소기업과 협력하도록 partnership에 대한 tax loss를 제안하였다. 이러한 변화로 생명공학 소기업의 자본이 개선되고, 금융위험에서 벗어나게 할 수 있다 (수정안 12).
우리의 자금관련 수정안은 규제개혁과도 연관되며, 혁신제품이 출시되는 과정에서의 규제에 따라 투자가 결정된다. 따라서 우리는 규제를 다시 디자인하기를 원한다 (수정안 13).
NICE가 Health Technology Appraisals에서 영국을 세계 리더로 만드는데 기여하였지만, 혁신 약품에 대한 NICE의 결정에 대해 산업체와 환자그룹은 낙담하고 있다. 그러므로 의약품 도입에 의한 비용 분석 등 NICE의 장기적인 입장에 대하여 조사단을 운영하는 것을 제안한다 (수정안 16).
EU Clinical Trials Directive에서 영국 제도에 대하여 호감을 갖고 있다. 따라서 정부는 영국 외부에서 그리고 유럽에서 진행되는 임상시험 경향을 반영하도록 Directive 개편에서 리더십을 발휘해야 한다 (수정안 5).
영국 생명과학 산업은 우수연구기관에서 발생하는 혁신적인 아이디어를 원한다. 급성 질환의 유전학 결정인자에 대한 지식이 늘어나고 있으므로 바이오 마커를 이용하는 진단방법은 맞춤의학으로 발전하고 있다. 따라서 새로운 Stratified Disease Strategy를 개발하고 이를 통합한 다학제 프로그램에 반영하는 것을 권고하였다 (수정안 14). 치료가 목적이라면 영국의 경쟁력을 높일 수 있다.
영국은 줄기세포 치료와 재생의학에서 선두주자이다. 그러므로 연구기능과 생산시설 등을 확보한, 줄기세포 scale-up 센터 두 개를 설립하는 것을 제안하였다 (수정안 17).
물론 영국 생명과학 섹터는 교육기관과 산업에 올바른 사람을 공급해야 한다. 그러므로 Semta의 Bioscience Sector Skills Agreement와 Action Plan 제안을 환영하며, 시행을 요청하였다 (수정안 20). 나아가서 Plan이 개정되도록 Semta의 Sector Strategy Group (대기업, 소기업 대표들도 위원으로 참가한다)이 분기별로 재조사하고 이때 지표도 개발하기를 제안하였다 (수정안 21).
마지막으로, 영국 생명과학 섹터가 앞으로 나아가기 위해서 good quality evidence이 필요하다. 생명과학에 대한 BERR, DH, DIUS의 입장 등에 관하여 BIA와 ABPI는 매년 진척보고서를 제작한다 (수정안 7).
결론적으로 우리 리뷰는 영국 생명과학 섹터의 새롭고 현실적인, 다음의 비전을 제시한다.
지속가능한 기초를 바탕으로, 부가가치를 높이며, 영국의 부를 증가시키고 건강을 증진시키면서 다양한 지속가능한 생명과학 섹터를 창조하는 것이다.
우리는 이러한 수정안들이 action program에 반영되어, 2015년 비전을 달성하는데 기여하기를 바란다.
용어집
BIA (BioIndustry Association); 영국 생물산업협회
BRIC (Bioprocessing Research Industry Club)
Bioscience Sector Skills Agreement
ECFs (Enterprise Capital Funds)
EU Clinical Trials Directive; 유럽임상시험승인제도
EBIC (European Biosciences Intelligence Coalition)
HEFCE (Higher Education Funding Council for England)
HEIF (Higher Education Innovation Fund)
HESA (Higher Education Statistics Agency)
HTA (Health Technology Assessment/ Appraisal); 의료기술평가
KTN (Knowledge Transfer Network)
KTPs (Knowledge Transfer Partnerships)
MHRA (Medicines and Healthcare products Regulatory Agency)
MISG (Ministerial Industry Strategy Group)
NHS (National Health Service); 의료보험
NICE (National Institute for Health and Clinical Excellence); 국립임상연구소
NIHR (National Institute for Health Research)
OSCHR (Office for the Strategic Co-operation of Health Research)
PPRS (Pharmaceutical Price Regulation Scheme); 의약품가격규제방안
PSRE (Public Sector Research Exploitation Fund)
Research Councils UK
Semta (Sector Skills Council for Science, Engineering and Manufacturing Technologies)
TSB (Technology Strategy Board)
UKCRC (UK Clinical Research Collaboration)
UKCRN (UK Clinical Research Network)
BRIC (Bioprocessing Research Industry Club)
Bioscience Sector Skills Agreement
ECFs (Enterprise Capital Funds)
EU Clinical Trials Directive; 유럽임상시험승인제도
EBIC (European Biosciences Intelligence Coalition)
HEFCE (Higher Education Funding Council for England)
HEIF (Higher Education Innovation Fund)
HESA (Higher Education Statistics Agency)
HTA (Health Technology Assessment/ Appraisal); 의료기술평가
KTN (Knowledge Transfer Network)
KTPs (Knowledge Transfer Partnerships)
MHRA (Medicines and Healthcare products Regulatory Agency)
MISG (Ministerial Industry Strategy Group)
NHS (National Health Service); 의료보험
NICE (National Institute for Health and Clinical Excellence); 국립임상연구소
NIHR (National Institute for Health Research)
OSCHR (Office for the Strategic Co-operation of Health Research)
PPRS (Pharmaceutical Price Regulation Scheme); 의약품가격규제방안
PSRE (Public Sector Research Exploitation Fund)
Research Councils UK
Semta (Sector Skills Council for Science, Engineering and Manufacturing Technologies)
TSB (Technology Strategy Board)
UKCRC (UK Clinical Research Collaboration)
UKCRN (UK Clinical Research Network)
관련정보
지식


 영국생명과학_2015_수정보고서.pdf
영국생명과학_2015_수정보고서.pdf