정책동향
코로나19 대응을 위한 주요국 R&D 동향
- 등록일2021-06-03
- 조회수4196
- 분류정책동향 > 기타 > 기타
-
자료발간일
2021-06-03
-
출처
한국과학기술기획평가원(KISTEP)
- 원문링크
-
키워드
#코로나대응#코로나 백신 #포스트 코로나 전략
코로나19 대응을 위한 주요국 R&D 동향
◈목차
1 개요
2 글로벌 코로나19 백신 개발 현황
3 주요국 코로나19 대응 현황
4 포스트 코로나 시대 전략
◈본문
1. 개요
□ 코로나19 선포 이후, 세계 각국은 백신, 치료제 개발 등 코로나 19 극복을 위한 R&D에 주력해 오고 있음
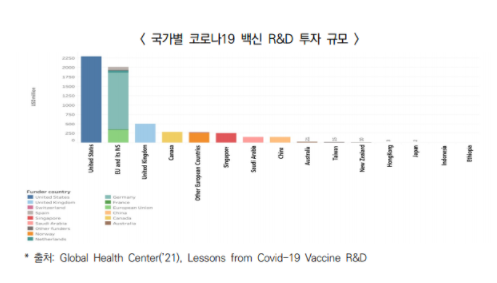
○ 글로벌 코로나19 R&D 생태계에서 미국과 독일은 ’20~’21년간 코로나19 백신 개발에 두각을 나타냈으며, 그 외 영국, 캐나다, 중국 등도 대규모 투자를 추진 중
- 미국 화이자(Pfizer)는 독일의 바이오텍인 BioNTech과 협력하여 가장 빠른 속도로 백신 개발과 사용허가에 성공했으며, 바이오텍인 모더나(Moderna)는 정부지원 프로젝트(Operation Warp Speed)의 도움을 받아 백신 개발 및 사용 승인 획득
- 영국은 화이자 백신을 세계 최초로 긴급사용승인하고 아스트라제네카, 모더나 등 여러 종류의 백신 사용승인을 신속하게 하여 코로나19의 확산을 통제하는데 집중
- 화이자와 공동으로 백신을 개발한 독일 바이오앤텍(BioNTech)은 mRNA 기반 백신 원천기술을 보유한 회사로, 가장 빠르게 코로나19 백신 개발에 성공
- 중국은 시노팜, 시노백 코로나19 백신을 선제적으로 개발하여 개도국을 대상으로 적극적 지원 추진
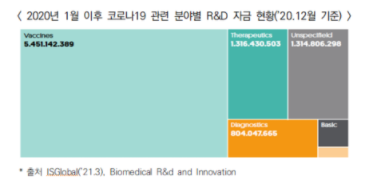
○ 코로나19 글로벌 대응을 위해 전 세계적으로 91.8억 달러 규모의 연구개발 펀드를 조성하고, 코로나19 관련 1,052개 연구 제품 개발을 위한 파이프라인을 구축
- 코로나19 바이러스(SARS-CoV-2)에 대한 진단, 치료 및 백신개발, 기본연구에 전 세계 기준 최소 91.8억 달러가 투자되었는데 그 중 대부분을 미국(48%), 독일(12%), 영국(8%), 캐나다(7%) 등 선진국에서 주도
- 분야별로는 백신에 54.5억 달러, 치료제에 13.2억 달러, 진단에 8억 달러, 그 외 분야에 13.1억 달러의 펀드가 조성되었음
- 분야별로 개발되고 있는 파이프라인은 진단기기가 469개, 치료제가 362개, 백신이 221개로 나타남
- 향후 포스트 코로나 시대를 맞아, 새로운 감염병 예방 등 제2의 팬더믹 위기 상황에 체계적으로 대응하기 위한 전략이 필요
○ 본 고에서는 코로나19 대응을 위한 주요국의 관련 R&D 추진 현황 및 포스트코로나 전략을 통해 향후 정책적 시사점을 모색하고자 함
2 글로벌 코로나19 백신 개발 현황
□ 전세계적으로 코로나19 확산이후 1년 안에 백신이 개발되면서 빠르게 보급 중
○ 미국의 모더나, 화이자, 이노비오, 영국의 아스트라제네카, 중국의 시노팜, 시노백, 칸시노바이오로직스 등이 전세계적으로 빠르게 공급 중
- 코로나19 백신의 개발 현황을 살펴보면, 제약사 임상 1상을 진행중인 백신은 44건, 2상은 32건, 3상은 22건. 또한, 제한적 사용 승인 6건과 완전사용 7건 등이 현재 치료현장에서 사용 가능
1) 아스트라제네카/옥스퍼드대 (영국)
- 영국 옥스퍼드 제너 연구소가 개발한 바이러스 벡터 백신으로 ’20년 5월부터 영국에서 2상, 3상 시험 실시후, 8월부터 미국에서 3상 시험 후 영국에서 접종 시작
- 유럽 및 아시아 6개(인도혈청연구소, 머크 등)제약사에 백신 제조권 부여
2) 화이자/BioNTech (미국/독일)
- ’20년 1월 백신 연구에 착수한 바이오엔텍은 당해 3월 화이자와 협력해 연구 규모를 확대하였고, 공동개발한 코로나19 백신은 ’20년 12월 영국에서 세계 최초로 사용 승인을 발표하였고, 뒤이어 미국 FDA는 화이자 백신의 긴급사용승인(EUA)을 발표
- 화이자와 바이오엔테크는 백신 대량 생산을 위해 공장을 확장했으며, 2021년 말까지 전 세계적으로 20억 회분을 제조할 수 있을 것으로 예상
3) J&J(얀센) (미국)
- ’21년 2월 FDA는 J&J 백신에 긴급사용승인을 세 번째로 허가하였으며, 1회분 만으로 안전성과 효능을 입증한 것은 최초임
- ’20년 1월 베스 이스라엘 디코네스 메디컬 센터(Beth Israel Deaconess Medical Center)는 J&J와의 코로나19 백신 개발에 협력하고 임상에 착수
4) 모더나 (미국)
- ’20년 12월 18일(현지시간) 모더나의 코로나19 백신은 화이자 백신에 이어 FDA로부터 두번째로 긴급사용승인(EUA)을 받았으며, 3월에 코로나 백신 가운데 가장 빠르게 임상 1상에 착수하여, 11월 최종 데이터를 발표
5) 시노팜(Sinopharm, 중국의약집단)
- WHO는 2021년 5월 7일 중국의 국영제약사 시노팜의 코로나19 백신(불활화 백신)에 대해 긴급사용을 승인
- 미국의 화이자/BioNTech 백신, 영국 아스트라제네카 백신 2종, 미국 얀센(J&J) 백신, 미국 모더나 백신에 이어 WHO가 긴급 사용을 승인한 6번째임
6) 스푸트니크V (러시아)
- 바이러스벡터 백신으로 러시아 등 61개국에서 승인됐으나 미국, 유럽에서는 아직 허가되지 않음
- 유럽의약청(EMA)에서 사전검토 중이며, 세계보건기구(WHO)에서도 긴급사용목록(EUL) 등재신청에 따른 심사 진행중
7) 노바백스
- 코로나바이러스의 돌기(스파이크) 단백질 자체로 만든 백신으로 재조합유전자를 통해 합성한 단백질을 정제한 후 면역증강제 역할을 할 사포닌을 추가해 만든 백신임. 미국, 유럽, 한국 등에서 사용허가를 위한 심사 중
3 주요국 코로나19 대응 현황
가. 미국
□ NIH, CDC, FDA를 중심으로 코로나19 대응 조치들이 발표되었으며, 민관 협력 체계 시스템을 구축하여 성공적인 백신 개발에 성공
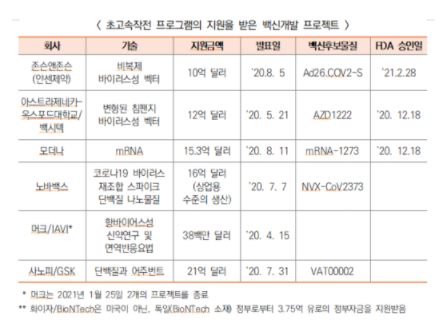
○ (백신) ’20년 5월 코로나19 백신, 치료제, 진단기기 개발 가속화를 위한 민관협력 「초고속작전(Operation Warp Speed, OWS)」을 발표하여 대규모 자금 지원
- ’21년까지 미국국민에게 안전하며 유효한 백신을 3억 회분 제공할 것을 목표로 내세워, NIH, FDA, CDC 등의 의료연구 및 공중위생리소스와 DOD의 제조 및 물류리소스를 통합하여, 여러 유망한 백신후보의 개발로부터 승인, 양산, 비축을 고속으로 추진
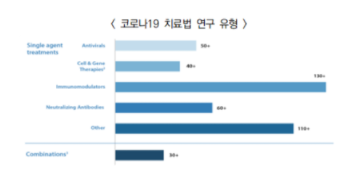
○ (치료제) FDA는 ’20년 4월과 7월에 코로나 바이러스 치료 촉진 프로그램(CTAP, Coronavirus Treatment Acceleration Program)을 긴급하게 만들고 모든 치료가능한 방법을 검토
- 임상 전단계 610개 이상, 임상 진입 이상 단계 450개 이상, 긴급사용승인 치료제 9건, FDA 승인 치료제 1건
- 임상 진입 이상 단계를 치료법에 따라 살펴보면, 면역조절법이 130개 이상으로 가장 많았고, 중화항체(neutralizingantibodies)가 60개 이상, 항바이러스제가 50개 이상, 세포/유전자치료법이 40개 이상 순으로 나타남으로 많음
- 그 외의 방법도 110개 이상 이었으며, 기존 방법과의 병용요법(combinations)도 30개 이상으로 나타남
- 국립보건원(NIH)과 NIH재단(FNIH)는 ’20년 4월, 민관협력 프로그램으로 코로나19 백신과 치료제 개발을 가속화하기 위해 코로나19 치료 및 백신 촉진 (ACTIV, Accelerating COVID-19 Therapeutic Interventions and Vaccines) 파트너십을 추진하여 백신과 치료제의 임상개발을 위해 유망한 후보물질을 발굴하고 우선순위를 설정하고 임상단계 진입을 촉진함
나. 영국
○ 초기부터 코로나19 팬데믹 후 사회구축을 위한 R&D와 비즈니스에 집중 투자
- 안전하고 효과적인 백신을 개발하기 위한 백신태스크포스(VTF)를 구성하고 중국에서 바이러스 유전정보를 공개하자마자 백신개발에 착수
- 2020년 4월, 비즈니스・에너지・산업전략부(BEIS)는 코로나19 이후 회복력 구축에 2000만 파운드를 투자하여 영국 주요 산업 전반에 걸쳐 새로운 근로방식을 장려하고 지속적 생산성을 보장하는 혁신적인 기술 R&D를 지원
- 국방부 산하기관인 국방안보추진기구(DASA)는 ‘광범위 바이오센싱(Biosensing Across Wide Areas)’ 기술개발 계획을 발표하고, ‘구급차 신속 소독’ 기술개발을 추진
- 백신개발 초기 자금으로 국립보건연구원(NIHR)과 영국연구혁신기구(UKRI)에서 아스트라제네카 백신의 임상시험이 즉시 시작될 수 있도록 2000만 파운드의 추가 자금을 지원
* 첫 라운드의 연구에 1,050만 파운드를 투자하여 임상시험 성공시 100만회분의 대량 백신 생산이 가능하도록 제조 프로세스의 개발에 투자
- 대학, 연구소, 제약회사의 컨소시엄 연구에 재정을 지원하면서 2020년 12월 2일 화이자의 코로나 백신을 최초로 승인하고 이어 12월 30일 아스트라제네카, 모더나 등 여러 종류의 백신을 승인
○ COVID-19 대책에 대한 영국공중보건국(PHE,Public Health England), NHSTT, JBC부문간 연계 착수
- ’20년 5월 NHS검사・추적 서비스(NHS Test and Trace service, NHSTT)를 설치하여 추적 어플리케이션의 개발 및 응용을 시도하였으며, 같은 해 6월에는 The Joint Biosecurity Centre (JBC) 개설
* JBC는 국내의 역학 전문성과 정부 내의 정보분석기능을 융합하여, ①이병・전파의 즉시 파악 및 해석과 이에 근거한 얼러트 발신 및 ②정부에 대한 조언기능을 담당
- 그 외에도, 새로운 국립보건원(National Institute for Health Protection, NIHP)를 설립하여, PHE, NHSTT, JBC를 보건사회복지부 (DHSC)소관 하에 통괄하는 계획 발표
- NIHP는 2021년 봄에 개설될 예정이며, 모든 감염병 및 핵・화학물질・대비하여, 조사・연구, 검사・추적, 과학적 조언・근거 제공
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보

