BioINpro
(BioIN + Professional) : 전문가의 시각에서 집필한 보고서 제공유전체 교정 기술
- 등록일2016-01-26
- 조회수13743
- 분류생명 > 생물공학, 플랫폼바이오 > 바이오기반기술

질병의 예방 및 치료를 위해 수많은 과학자들은 유전체 변형에 대한 많은 연구를 해왔으나, 정확한 돌연변이를 생성시켜 자손까지 전달시키기에는 많은 한계가 있었다. 그러나 3-4년 전부터 이를 극복한 “유전자가위” 기술이 등장하여 의생명과학의 발전에 획기적인 전환점을 이루고 있다. 이 기술의 현황과 미래를 소개한다. |
1. 기술의 기원과 기전
CRISPR 라고 하는 유전체 편집(genome editing) 방법은 최고의 학술지 Science에서 Science's 2015 Breakthrough of the Year로 선정되었다(1). 이 기술은 이미 2012년과 2013년에도 Breakthrough section에 소개된 바 있다. 이제 이 기술은 오랜 기간 동안 인류에 큰 적이 되어 온 해충이나 그 해충으로부터 야기된 질병의 퇴치(gene drive)에 큰 기여를 하고 있으며, 아직 논란의 여지가 많이 남아 있지만 사람의 질병을 없애기 위하여 태아의 DNA를 편집할 수 있게 된 사실이 또한 놀라운 진보로 인정받은 것이다. 이 놀라운 기술에 대한 기원과 현재, 미래에 대하여 고찰해보자.
1953년 DNA 이중나선이 학술지 Nature에 발표된 이후 인류는 사람의 탄생, 질병, 노화, 사망에 이르는 모든 현상이 유전자 혹은 유전체에 의하여 큰 지배를 받는다는 것을 알게 되고, 그 세부적인 작용 원리를 알기 위하여 끊임없이 노력해왔다. 1970년대에 제한효소(restriction enzyme)가 발견되어 DNA 이중나선을 자를 수 있다는 사실을 알게 되고, 세포에 유전자를 넣을 수 있게 되면서 유전자/유전체 기능을 변형시켜 그 원래의 기능이 무엇인지에 대한 연구를 매우 공격적으로 진행해 왔다. 여기에 가장 많이 사용되었던 방법은 homologous recombination, anti-sense RNA, 그리고 RNA interference (RNAi) 등이었다.
가장 최근에는 RNAi가 많이 사용되었지만 이 방법은 유전자의 기능을 불완전하게 억제한다는 점과 원하지 않는 유전자를 건드릴 수 있다는(off-target effect) 약점이 있다. 실제로 살아있는 세포나 생명체가 가지고 있는 유전체의 특정 부위만을 변형시켜 이를 유전적으로 계속 유지시킨다는 것은 기술적으로 큰 한계가 있었다. 2007년 배아줄기세포와 homologous recombination 기술을 이용하여 마우스에서 특정 유전자의 기능을 제거할 수 있는 소위 knockout mouse technology가 노벨생리의학상을 수상하였지만, 배아줄기세포를 얻을 수 있는 생명체가 한정되어 있었으므로 이 방법 또한 한계에 직면하고 있었다.
1990년대에 들어 우리나라의 김진수 교수 등 몇몇 연구자들의 노력으로 제한효소의 자르는 기능과 zinc-finger domain의 특정 DNA 염기서열을 인식할 수 있는 기능을 혼합하여 Zinc-finger nuclease (ZFN)라는 유전체 교정 기술이 등장하였다. 이 기술은 발표되자마자 이를 이용하여 유전체를 조작한 각종 생명체가 성공적으로 생산되었다고 발표가 되었으며, 2012년 1월, Nature Methods에서 2011년의 Method of the Year로 선정되어 앞으로 미래의 의생명과학분야의 소위 “혁명”이 일어나고 있음을 예지하였다. 그러나 그 후 Tranion factor-like endonuclease (TALEN)이라고 하는 새로운 유전자 가위가 탄생하였다. DNA 염기서열 3개를 인식하던 ZFN 대신 단백질 motif 하나가 염기서열 하나를 인식할 수 있는 TALEN이 등장함으로써 ZFN은 서서히 사라지게 되었다.
이 TALEN을 제2세대 유전자 가위라고 하며, 이를 이용하여 수많은 생명체에서 유전자의 조작이 가능하게 되었다. 하지만 곧 또 다른 유전자 가위, 즉, CRISPR/Cas9 (Clustered Regularly-Interspaced Short Palindromic Repeats/CRISPR associated protein 9)이라는 새로운 유전자 가위가 등장하였다(그림 1). 이것은 처음에 박테리아의 adaptive immunity에 중요한 기능을 하는 유전자들로서, 외부로부터 침입하는 유전물질들을 제거하기 위한 시스템으로서 발견되었다. 박테리아에서 CRISPR의 작용기전에는 세 가지 타입이 있는 것으로 알려져 있는데, 그 중 타입 II가 가장 잘 연구되어 있다. 타입 II CRISPR와 함께 작용하여 타겟 DNA를 자르는 단백질은 여러 종의 Cas 단백질 중 9번(Cas9)이다. 이 시스템에 의하여 특정 타겟 DNA가 잘라지려면 Cas9은 반드시 crRNA (CRISPR RNA)와 tracrRNA (trans-activating crRNA, crRNA와 일부분 서로 상보적임)와 결합하여 complex를 이루어야 한다. 그 후 Cas9 단백질의 nuclease domain은 crRNA에 있는 20 nucleotide 타겟 서열에 의하여 지정되는 타겟 DNA를 잘라서 Double Strand Break (DSB)를 만든다. 이 과정에서 Cas9이 DSB를 형성하기 위해서 protospacer-associated motif (PAM)이라고 하는 2-5 개의 염기서열로 이루어진 짧은 보존된 서열이 crRNA 상보 서열의 3’쪽에 반드시 있어야 한다.
Doudner와 Charpentier 박사의 실험실에서는 2012년 세가지 성분 (crRNA와 trRNA, 그리고 Cas9)만 있으면 타입II CRISPR nuclease가 genome editing에 사용될 수 있음을 발표하였고(2), 이 중 crRNA와 trRNA를 합쳐서 하나의 RNA (sgRNA, single guide RNA)로 만들어도 똑같이 기능을 함을 보였다. 즉, CRISPR/Cas9 시스템은 ZFN이나 TALEN과 같이 단백질이 DNA를 인식하는 대신 sgRNA가 자신의 서열과 상보적인 DNA를 인식하므로 매번 단백질을 새로 cloning해야 하는 번거로움이 생략된다. 대신 타겟에 대한 20개의 염기서열 oligonucleotide만을 합성한 후 클로닝하여 RNA를 만들고, 이미 만들어 놓은 Cas9 단백질 혹은 RNA와 함께 사용하면 된다. 이 시스템을 제3세대 유전자 가위라고 하며 단백질 대신에 RNA에 의해 인식되므로 RNA-Guided Endonuclease (RGEN)이라고도 한다.
지금까지 설명한 제1, 2, 혹은 3세대 유전자가위를 세포핵 안에 넣어서 원하는 DNA 서열에 DSB를 만들면, 이렇게 생긴 DSB를 세포가 스스로 수선(repair)하게 된다. 먼저 DSB를 수선하는 세포의 반응은 크게 둘로 나눌 수 있다. 첫째는 Non-homologous end joining (NHEJ)라는 과정으로 deletion, insertion, 혹은 indel (insertion/deletion)이 무작위로 일어나는 현상이 있으며(3), 둘째는 homology-directed recombination (HDR)이라고 하는 과정으로서 타겟 DNA 부위와 homology를 가진 DNA 서열을 포함한 donor DNA를 함께 넣어 줌으로써 원하는 서열을 정확하게 넣거나 치환할 수 있다(4).
2. 기술의 발전 및 최신 연구동향
가. 분자생물학적 응용
지금까지 세 종류의 변형된 Cas9 nuclease가 genome-editing에 적용되고 있다. 먼저 wild-type Cas9은 이미 앞에서 언급한 바와 같이 double-stranded DNA를 정확하게 자를 수 있으며 DSB를 유도한다. 이 DSB는 NHEJ에 의하여 수선되면서 insertion과 deletion 등을 생성한다.
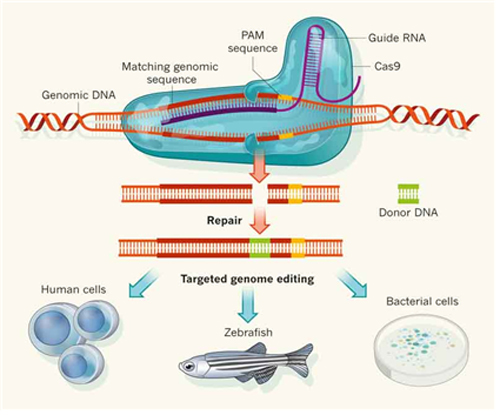
[그림 1. CRISPR/Cas9 system](E. Charpentier & J. A., Daudna, Nature 495:50-51, 2013에서 발췌)
또한 donor DNA를 함께 넣어 HDR을 일으킨다(그림 2A). 두 번째 Cas9 시스템은 Cas9D10A라고 하는데 DNA 이중나선 중 한 가닥만을 자름으로써 NHEJ는 전혀 일으키지 않고 donor DNA와 함께 HDR을 매우 잘 일으킨다. 한 가닥만 자르므로 이를 또한 nickase라고도 한다(그림 2B). 세 번째 Cas9 변형 단백질은 dCas9이라고 하는데, 이것은 nuclease activity가 아예 없는 것으로 DNA를 전혀 자르지 않고 타겟에 그냥 결합만 정확하게 한다. 그럼으로써 다른 여러 가지 effector domain들과 함께 사용하면 타겟의 gene silencing이나 activation에 이용할 수 있다(그림 2C).
...................(계속)
* 로그인 하셔야 자세한 정보를 모두 보실 수 있습니다.
-
이전글
- 정밀의학 최신 동향
-
다음글
- 미생물 유전체 연구동향
지식
- BioINwatch 최대 규모의 오픈소스 Evo2를 활용한 유전체 모델링 및 설계 2025-03-21
- BioINwatch 후성 유전체 비트(Epi-bits)를 활용한 DNA 기반의 데이터 저장 기술 2025-03-18
- BioINwatch 작물 중개 유전체학에 거는 기대와 도전 과제 2025-01-24
- BioINregulation 유전체 데이터 2차 활용 관련 국가별 제도 비교 2025-01-24
- BioINwatch 시행 가능성이 높아진 미국의 생물보안법(US Biosecure Act), 바이오산업 공급망 재편 압박 2024-12-04
동향
- 기술동향 [6월호 테마 Genomics : The Secret Code of Biology] 3차원 후성유전체 분석법과 질병발병 기전에서의 임팩트 2024-06-19
- 제도동향 [이슈 브리핑] 미국 하원 상임위원회 상정 생물보안법안 미리보기 2024-05-21
- 기술동향 [첨단바이오포커스 제 40호] PMDA, 유전체 편집 기술을 이용한 유전자 치료용 제품 등에 대한 품질·안전성 등의 고려사항에 대한 보고서 2024-04-24
- 기술동향 원숭이두창바이러스의 분리 배양과 전장유전체 정보 분석 2023-04-27
- 기술동향 전장유전체 분석 기반 경북권 코로나19 진단검사 특이사례 분석 2023-03-16


 유전체교정기술.pdf
유전체교정기술.pdf
 CRISPR/Cas9 system]
CRISPR/Cas9 system]