BioINpro
(BioIN + Professional) : 전문가의 시각에서 집필한 보고서 제공의약품 허가특허연계제도와 시사점
- 등록일2018-02-26
- 조회수10509
- 분류기타 > 기타, 제품 > 바이오의약
-
저자/소속
손경복 특임교수/이화여자대학교 제약산업학과
-
발간일
2018-02-26
-
키워드
#허가특허연계제도
- 첨부파일
-
차트+
?
차트+ 도움말

1. 개요
한-미 자유무역협정(Free Trade Agreement, FTA) 제18.9조 제5항에 따라 의약품 허가특허연계제도가 2015년 3월 15일 완전하게 도입되었다. 동 제도는 신약(오리지널 의약품)의 안전성·유효성 자료에 의존한 의약품(후발의약품)의 품목허가 과정에 특허권 침해 여부를 고려함으로써, 특허권을 보다 적극적으로 보호하려는 취지를 가지고 있다. 허가특허연계제도는 무역관련 지식재산권에 관한 협정(Agreement on Trade-Related Aspects of Intellectual Property Rights, TRIPS)이 제시하고 있는 지식재산의 보호 범위를 넘어서는 것으로 소위 TRIPS-plus 조항으로 불리고 있다. 동 제도는 1984년 Drug Price Competition and Patent Term Restoration Act(이하 Hatch-Waxman 법안)에 의하여 최초로 미국에서 법제화되었다.
그러나 Hatch-Waxman 법안은 단순히 허가특허연계제도를 도입하기 위한 목적으로 만들어진 법률이 아니다. 동 법은 오리지널 의약품 혁신(innovation)과 후발의약품 시장 진입(access)이라는 상반된 정책 목표를 달성하기 위한 내용을 포함하고 있다. 특허의 존속기간 연장, 자료보호(data exclusivity) 제도와 허가특허연계제도 도입은 혁신의 유인을 제공하지만 후발의약품 시장 진입을 억제하는 효과가 뚜렷하다. 동시에 동 법은 기존 특허법에서 특허 침해로 규정하고 있던 의약품 허가를 위한 특허 사용을 정당한 것으로 인정하였고, 약식신약허가신청 제도(Abbreviated New Drug Application, ANDA)를 처음으로 도입하였다. 이는 제네릭 제약사의 요구를 적극 반영한 것이라고 한다.
------------------------------------------------------------------
1) 본고는 아래의 보고서에서 저자가 작성한 III. 의약품 허가특허연계 관련 제도 연구 (pp.163~pp.237) 부분을 수정 및 보완하였다. 식품의약품안전처·서울대학교 산학협력단 (2016). 의약품 허가특허연계제도 영향평가.
캐나다, 호주, 한국은 각각 1993년, 2004년, 2015년 미국의 요구로 허가특허연계제도를 도입하였다. 즉, 허가특허연계제도는 각 국가에서 자발적으로 도입한 것이 아니라 무역협상 및 국제무역협정의 부산물로 도입되었다. 그런데 허가특허연계제도를 서술하고 있는 국제법 및 국제협정은 모호함(ambiguity)을 가지고 있다2). 불충분한 설명에서 파생되는 모호함은 민감한 문제를 해결하기 위하여 의도적으로 사용되는 정치적인 언어이다. 예를 들어 협상가들은 세부 논점에 합의하기 어려운 경우 고의적으로 모호한 문장을 만들고 추후 이행과정에서 문제를 해결하고자 한다. 미국의 정치학자 헨리 키신저는 이러한 정치적 행위를 구조적 모호함(constructive ambiguity)이라고 하였다.
한-미 FTA 협정문에서도 구조적 모호함을 확인할 수 있다. 한-미 FTA3) 제18.9조 제5항은 허가특허연계제도를 아래와 같이 간략하게 서술하고 있다. 즉, 한-미 FTA 협정문은 허가특허연계제도를 의약품 특허목록(허가당국에 통보된 특허), 허가신청사실 통지(다른 인의 신원을 특허권자가 통보), 판매금지(시판허가 절차에서의 조치를 이행)로 제시하고 있는데 제도의 실질적 운영을 위한 구체적 정보를 제공하고 있지는 않다4).
5. 당사국이 의약품의 시판을 허가하는 조건으로, 안전성 또는 유효성 정보를 원래 제출한 인 이외의 인이 그러한 정보 또는 그 당사국의 영역 또는 다른 영역에서의 이전 시판허가의 증거와 같이 이전에 허가된 제품의 안전성 또는 유효성 정보의 증거에 의존하도록 허용하는 경우, 그 당사국은 가. 그 제품 또는 그 제품의 허가된 사용방법을 대상으로 하는 것으로 허가당국에 통보된 특허의 존속기간 동안 시장에 진입하기 위하여 시판허가를 요청하는 모든 그러한 다른 인의 신원을 특허권자가 통보받도록 규정한다. 그리고 나. 그 제품 또는 그 제품의 허가된 사용방법을 대상으로 하는 것으로 허가당국에 통보된 특허의 존속기간 동안 특허권자의 동의 또는 묵인 없이 그러한 다른 인이 제품을 시판하는 것을 방지하기 위한 자국의 시판허가 절차에서의 조치를 이행한다. |
------------------------------------------------------------------
2) 국제법 및 국제협정에 나타난 구조적 모호함은 다음의 논문을 참조.
Son, K. B., & Lee, T. J. (2017). The trends and constructive ambiguity in international agreements on intellectual property and pharmaceutical affairs: Implications for domestic legislations in low-and middle-income countries. Global public health, 1-10.
3) 구체적인 한-미 FTA 협정문은 다음을 참조. http://www.fta.go.kr/us/doc/1/
4) 이와 유사하게 2005년 발효된 호-미 FTA와 최근 이슈가 되었던 환태평양경제동반자협정(Trans-Pacific Strategic Economic Partnership, TPP)도 허가특허연계제도를 모호한 방식으로 서술하고 있다. TPP의 주요 내용은 다음을 참조,
손경복 (2016). 환태평양경제동반자협정과 의약품 관련 지식재산 및 제도. 보건경제와 정책연구 22(2). 99-117.
본고는 국제협정이 가지고 있는 구조적 모호함에 주목하여, 미국, 캐나다, 호주, 한국의 허가특허연계제도를 분석하고 제도 운영의 시사점을 도출한다. 2장에서는 한국의 제도를 소개하고 제 외국 제도와의 유사점과 차이점을 분석한다. 3장에서는 제도 현황을 고려하여 제도 운영의 시사점을 제시한다.
2. 제도 현황
가. 한국의 제도
한국의 의약품 허가특허연계제도는 1) 의약품 특허목록, 2) 허가신청사실 통지, 3) 판매금지 신청, 4) 우선판매품목허가로 구성되어 있다. 특허목록 등재와 허가신청사실 통지는 한-미 FTA 협정문 제18.9조 제5항 가호를 반영한 것이며, 판매금지는 나호를 반영한 것이다. 제도 도입 시 쟁점이 되었던 것은 특허권자의 판매금지 신청으로 후발의약품의 시장 진입이 최대 9개월5)간 지연되는 판매금지 제도이다. 우선판매품목허가는 한-미 FTA 협정문에 명시된 내용은 아니었다. 우선판매품목허가는 특허 소송에 따른 위험과 비용을 감수하고, 특허에 도전한 후발의약품의 시장 진입을 촉진하기 위한 제도로 Hatch-Waxman 법안과 같이 오리지널 의약품의 혁신뿐만 아니라 후발의약품의 시장 접근을 고려하기 위한 조치로 이해할 수 있다. 참고로 한-미 FTA 발효일인 2012년 3월 15일부터 의약품 특허목록과 허가신청사실 통지가 시행 중이며 판매금지 및 우선판매품목허가 등의 사항은 시행이 3년간 유예되어 2015년 3월 15일부터 시행되고 있다.
------------------------------------------------------------------
5) 약사법 제50조의6 제3항은 판매금지의 효력이 소멸되는 경우를 제시하고 있다. 여기에는 판매금지가 신청된 의약품이 등재특허권의 권리범위에 속하지 아니한다는 취지의 심결일 또는 판결일, 판매금지가 신청된 의약품이 등재특허권을 침해하지 아니한다는 취지의 판결일, 등재특허권이 무효라는 취지의 심결일 또는 판결일 등이 포함된다.
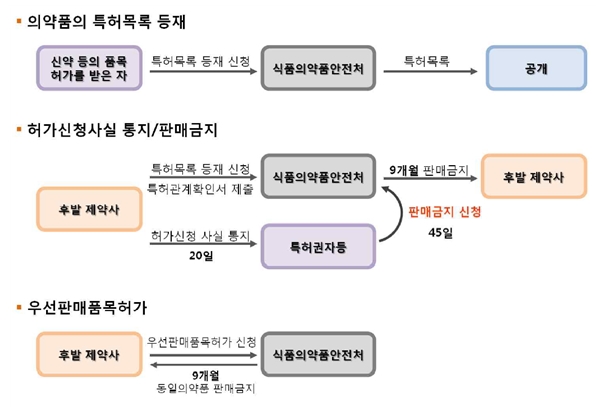
[그림. 의약품 허가특허연계제도의 구성]
출처 : 식품의약품안전처(2015)
나. 제 외국의 현황
본 절에서는 제 외국의 제도를 1) 의약품 특허목록, 2) 허가신청사실 통지, 3) 판매금지 신청, 4) 우선판매품목허가로 동일하게 구분하여 제시한다. 또한 미국 제도의 특징을 고려하여 의약품을 합성의약품과 생물의약품으로 구분하였다.
1) 의약품 특허목록
의약품 특허목록은 허가특허연계의 대상이 되는 특허를 한정한다. 즉, 의약품 특허목록은 제도 운영의 출발점으로 의의가 있다. 동시에 특허목록이 존재한다면 후발의약품 신청자는 공개되는 특허목록을 통하여 손쉽게 관련 의약품의 특허 정보를 획득하고 조치를 취할 수 있기 때문에 특허의 정보원(information source)으로 활용할 수 있다.
한국과 캐나다는 합성의약품과 생물의약품 모두를 대상으로 의약품 특허목록을 운영하고 있다. 미국은 합성의약품에 대해서만 특허목록을 운영하고 있으며, 생물의약품은 특허목록을 운영하지 않고 있다. 호주는 별도의 특허목록을 운영하지 않는다. 특허목록에 등재가 가능한 특허는 명칭은 다소 다르지만 큰 틀에서 물질, 제형과 조성물, 의약적 용도로 구분할 수 있다. 물질 특허의 경우 공통적으로 결정다형을 포함한다. 제조방법과 관련해서는 한국, 미국(합성의약품), 캐나다가 모두 인정하고 있다. 하지만 한국과 미국은 제조방법과 관련하여 물질의 신규성이 있어야 한다. 제형과 조성물, 의약적 용도는 한국, 미국(합성의약품), 캐나다가 모두 인정하고 있다.
미국(합성의약품)과 캐나다는 신약신청과 동시에, 한국은 신약신청 후 허가 받은 날 이후 특허목록 등재를 신청할 수 있다. 미국과 캐나다는 예외적으로 특허가 신약신청 이후 등록된 경우 등록된 날로부터 30일 이내에 특허목록 등재를 신청할 수 있다. 미국(합성의약품)은 특허 출원일을 한정하지 않으며, 캐나다와 한국은 각각 신청 전, 허가 전 출원한 특허만 등재를 신청할 수 있다.
한국, 미국, 캐나다의 특허목록 관리 주체는 각각 식품의약품안전처, FDA, 보건부(Health Canada)이다. 등재 내용의 정정은 모든 국가에서 가능하다. 다만 삭제의 경우 국가마다 내용이 다르다. 한국과 캐나다에서는 관리 주체가 직권으로 삭제할 수 있으나 미국은 법원을 통해서만 삭제할 수 있다. 즉, 한국과 캐나다는 미국과 다르게 관리 주체가 적극적으로 특허목록을 관리할 수 있다.
2) 허가신청사실 통지
신약신청자가 허가 당국에 제출한 안전성·유효성 자료를 원용한 후발신청자는 허가신청사실을 신약신청자에게 통지해야 한다6). 통지를 받은 신약신청자는 후발의약품 판매금지 조치를 취할 수 있다. 참고로 자료보호 기간에는 신약신청자가 제출한 안전성·유효성 자료를 원용할 수 없기 때문에 허가특허연계는 자료보호 종료 후에 작동한다.
------------------------------------------------------------------
6) 엄밀하게 통지를 받는 대상은 국가마다 다르다. 한국과 미국(합성의약품)은 특허권자와 신약신청자이며, 미국(생물의약품)과 캐나다는 신약신청자이며, 호주는 특허권자이다. 하지만 본고에서는 이해를 돕기 위하여 신약신청자로 서술하였다.
한국, 미국(합성의약품), 캐나다는 비슷하게 허가신청사실 통지 제도를 운영하고 있다. 하지만 호주의 통지 제도는 상당히 다르다. 한국은 등재특허권이 무효이거나 또는 등재특허권을 침해하지 않는다고 주장한 자, 미국(합성의약품)은 Paragraph IV7)를 주장한 자, 캐나다는 특허관련 주장통보서를 제시한 자에게 허가신청사실 통지 의무가 적용된다. 반면 호주는 후발의약품 신청자의 소명에 따라 통지가 의무가 될 수도 있고, 의무가 되지 않을 수도 있다8). 아래 표와 같이 소명은 두 가지 종류가 있는데, 전자의 경우 신청자는 특허권자에게 통지 할 필요가 없으며, 후자의 경우만 특허권자에게 통지해야 한다.
진심으로, 신청자가 제품을 시판하거나 시판 준비를 함으로 인해 특허의 유효한 청구를 침해하지 않는다고 합리적인 근거에 따라 믿는다는 내용 (소위 26B(1)(a) 소명) 신청하는 제품과 관련하여 특허가 등록되어 있고, 신청자가 특허기간이 만료되기 전에 제품을 시판하려고 하며, 약사법 23조에 의거한 허가 또는 신고를 위한 신청을 특허권자에게 알렸다는 내용 (소위 26B(1)(b) 소명) 26B(1)(a) a certificate to the effect that the applicant, acting in good faith, believes on reasonable grounds that it is not marketing, and does not propose to market, the therapeutic goods in a manner, or in circumstances, that would infringe a valid claim of a patent that has been granted in relation to the therapeutic goods; or
26B(1)(b) a certificate to the effect that: (i) a patent has been granted in relation to the therapeutic goods; and (ii) the applicant proposes to market the therapeutic goods before the end of the term of the patent; and (iii) the applicant has given the patentee notice of the application for registration or listing of the therapeutic goods under section 23. |
통지해야 하는 기한은 한국과 미국(합성의약품)이 허가신청이 접수된 후 20일로 동일하다. 캐나다는 명시된 기한을 제시하지 않았다.
------------------------------------------------------------------
7) 등재되어 있는 의약품의 특허가 유효하지 않거나 침해되지 않을 것이라는 내용을 포함한다.
8) 호주 전문가에게 문의한 결과 대부분은 통지하지 않는다고 한다.
[표 1. 각국의 특허목록 등재 및 관리]
| 미국 | 캐나다 | 호주 | 한국 | |
합성의약품 | 생물의약품 | ||||
특허목록 | 존재함 | 존재하지 않음 | 존재함 | 존재하지 않음 | 존재함 |
등재 가능한 시점 | 신약신청서와 같이 제출 혹은 특허권 등록이 된 날부터 30일 이내 | - | 신약신청서와 같이 제출 혹은 특허권 등록이 된 날부터 30일 이내 | - | 허가 받은 날 혹은 특허권 등록이 된 날부터 30일 이내 |
특허 출원일 한정 | 한정하지 않음 | - | 신청 전 출원한 특허 | - | 허가 전 출원한 특허 |
생물의약품 포함여부 | 구분하여 운영 | 구분하여 운영 | 포함 | 포함 | 포함 |
등재 대상 | 1) 의약품 물질 2) 의약품 제품 :제형과 조성물 3) 용도 특허 | - | 1) 의약성분 2) 조성물 3) 제형 4) 의약 성분 용도 | 신약과 신약의 용도에 관한 특허
| 1) 물질 2) 제형 3) 조성물 4) 의약적 용도 |
관리 주체 | FDA
| - | 보건부 장관 실제 관리는 OPML | _ | 식품의약품안전처
|
등재 내용 수정 | 가능, 신청자, FDA 및 법원을 통한 수정 | - | 가능, 보건부 장관
| _ | 가능, 신청자의 신청과 식약처장의 직권 |
등재 내용 삭제 | 가능, 법원을 통한 삭제
| - | 가능, 보건부 장관 특허청과 협의 가능 | - | 가능, 신청자의 신청과 식약처장의 직권 |
[표 2. 각국의 허가신청사실 통지]
| 미국 | 캐나다 | 호주 | 한국 | |
합성의약품 | 생물의약품 | ||||
통지해야 하는 자 | Paragraph IV를 주장한 후발 의약품 허가신청자
| 기존 바이오의약품에 동등한 혹은 동등생물의약품으로 시판허가를 획득하려는 후발의약품 허가신청자 | 특허관련 주장통보서를 제시한 후발의약품 허가 신청자
| 특허관련 소명(26B (1) (b)만 적용)을 해야 하는 후발의약품 허가신청자
| 등재특허권이 무효이거나 또는 등재특허권을 침해 하지 않는다고 주장한 후발의약품 허가신청자
|
통지해야 하는 기한 | 신청이 접수된 후 20일 이내 | 신청이 접수된 후 20일 이내 | - | - | 신청이 접수된 후 20일 이내 |
통지를 받는 대상 | 특허권자 신약신청자 | 신약신청자
| 신약신청자
| 특허권자
| 특허권자 신약신청자 |
3) 판매금지 신청
통지를 받은 신약신청자 혹은 특허권자는 행정적 혹은 사법적 절차로 판매금지 조치를 취할 수 있다. 그러나 판매금지 조치의 신청은 국가마다 그 내용이 다르다. 한국은 신청자에게 특허분쟁(소 제기 또는 심판 청구)과 진술서를 요구하고 있다. 미국(합성의약품)은 신청자에게 특허 침해소송만을 요구한다. 생물의약품의 경우 의약품 시판을 통보받은 신약신청자(대조약 제공인)가 판매금지 조치를 법원에 가처분(preliminary injunction)의 형태로 신청할 수 있다. 캐나다는 법원에 판매금지 조치를 신청할 수 있다. 호주는 신청자가 특허침해소송과 관련된 소명을 하고 법원에 특허침해소송 및 가처분(interlocutory injunction)을 신청할 수 있다. 이는 전술한 미국(생물의약품)의 가처분(preliminary injunction)과 유사하다. 한국은 판매금지 신청에 앞서 신청자에게 각각 진술서와 소명서를 요구하고 있다. 호주는 이에 더하여 소명서가 거짓인 경우 신청자는 벌금을 내야 한다9).
------------------------------------------------------------------
9) 그러나 호주 전문가에게 문의한 결과 실제 벌금을 낸 사례는 없다고 한다.
한국, 미국(합성의약품)은 행정적 절차로 판매금지 조치를 이행하고 있다. 여기서 행정적 절차란 식품의약품안전처와 FDA가 판매금지 조치의 요건을 충족한 경우 별다른 판단 없이 판매금지 조치를 이행하는 것을 의미한다. 캐나다는 준행정적 절차로 판매금지 조치를 이행한다. 즉, 신약신청자는 법원에 판매금지 조치를 신청하고 이를 근거로 보건부 장관에게 판매금지 조치를 요구한다. 미국(생물의약품)과 호주는 사법적 절차(가처분)로 판매금지 조치를 이행한다. 행정적 혹은 준행정적 절차를 따르고 있은 국가(한국, 미국(합성의약품), 캐나다)에서는 신청 기한을 통지받은 날부터 45일로 제시하고 있다. 반면 사법적인 절차를 따르고 있는 경우(미국(생물의약품), 호주) 구체적 신청 기한이 존재하지 않는다.
판매금지 조치의 구체적 내용은 국가마다 다르다. 행정적 혹은 준행정적 절차로 판매금지 조치를 이행하는 국가는 구체적 기간을 명시하고 있다. 반면, 사법적 절차로 판매금지 조치를 이행하는 국가는 조치의 구체적 기간을 명시하고 있지 않다. 한국은 특허권자와 신약신청자가 통보받은 날부터 9개월간 식품의약품안전처가 허가가 아닌 판매를 금지한다. 미국(합성의약품)은 특허권자와 신약신청자가 통보받은 날 중 늦은 날부터 30개월간 FDA가 허가를 보류한다(2016년 12월 5일 이행)10)). 캐나다는 법원에 판매금지 조치를 신청한 신약신청자가 신청의 증거자료를 보건부 장관에게 접수한 날부터 24개월간 허가를 보류한다.
------------------------------------------------------------------
10) 이를 자동유예(auto-stay)라고 하는데, 주의할 것은 이 기간에도 FDA는 허가 자료를 검토한다.
캐나다와 호주는 부당한 판매금지 조치 신청에 대한 신약신청자의 손해배상 책임을 법률에 명시하였다. 캐나다는 부당한 판매금지 조치로 후발의약품 신청자에게 발생한 손해에 대하여 신약신청자가 배상할 것을 명시하였다. 유사하게 호주도 후발의약품 신청자에게 발생한 손해와 정부, 주, 지역에 발생한 손해에 대하여 신약신청자가 배상할 것을 명시하였다.
4) 우선판매품목허가
우선판매품목허가는 한국과 미국(합성의약품)만 운영하고 있다. 한국에서의 신청 요건은 1) 최초 허가신청, 2) 특허심판 등의 인용심결, 3) 특허심판 최초 청구 및 심결이다. 후발의약품의 독점 기간은 9개월이다. 또한 요양급여를 신청한 의약품인 경우 2개월의 범위에서 연장이 가능하다. 미국에서는 이와 다르게 처음으로 Paragraph IV를 주장한 ANDA 신청자에게 독점권을 부여한다. 후발의약품의 독점 기간은 180일로 상대적으로 짧다. 독점권의 기산점은 한국과 미국(합성의약품)이 유사하다. 한국과 미국은 각각 후발의약품 판매 가능일과 시판한 날을 기산점으로 한다. 미국은 해당 약품의 시판 사실을 시판하고 30일 이내에 FDA에 통보해야 한다. 통보하지 않은 경우 시판한 날은 해당 의약품이 허가 받은 날이다(2016년 12월 5일 이행).
...................(계속)
* 로그인 하셔야 자세한 정보를 모두 보실 수 있습니다.


 의약품 허가특허연계 제도와 시사점.pdf
의약품 허가특허연계 제도와 시사점.pdf
 각국의 판매금지 조치 제도
각국의 판매금지 조치 제도
 의약품 허가특허연계제도의 구성
의약품 허가특허연계제도의 구성