제도동향
브렉시트 이후 영국 내 의료기기 규제
- 등록일2021-02-18
- 조회수4975
- 분류제도동향 > 종합 > 종합
-
자료발간일
2021-02-15
-
출처
KOTRA
- 원문링크
-
키워드
#의료기기 규제#영국#브렉시트
브렉시트 이후 영국 내 의료기기 규제
- 의료기기 종류에 따라 규제기관 등록기간 확인 필수 -
- 빠른 시일 내 영국 내 책임자(RP) 지정을 통해 등록절차 진행해야 -
- 2023년 6월 30일 이후부터 의료기기 UKCA 마크 필수 부착 -
- 영국 정부의 업데이트에 따라 향후 변경되는 내용이 생길 수 있음을 알려드립니다.
- 규정 확인 시 GB(잉글랜드, 스코틀랜드, 웨일즈)와 UK(잉글랜드, 스코틀랜드, 웨일즈, 북아일랜드)의 구분이 필요합니다.
▣ 영국의 의료기기 시장 규제는 의약품 및 의료기기 규제기관인 MHRA(Medicines and Healthcare products Regulatory Agency)가 담당한다. 2020년 12월 31일 브렉시트 이행기간이 종료되면서 영국 정부는 의료기기와 관련한 인증, 적합성, 의료기기 등록을 안내하는 지침을 제공하고 있다. 해당 지침의 의료기기에는 체외진단의료기기(in vitro diagnostic medical devices)와 능동이식형 의료기기(active implantable medical devices)가 포함된다.
영국 정부는 해당 지침을 통해 기업들에 참고할 수 있는 정보를 제공하고 있으며 기업은 별도의 전문적인 컨설팅이 필요한지를 고려해야 한다. 상품에 적용되는 규제 프레임워크가 확실하지 않은 경우 변호사나 무역 유관기관으로부터 자문을 얻을 것을 권고하고 있다.
- Association of British Health Tech industries(ABHI): enquiries@abhi.org.uk
- British In Vitro Diagnostics Association(BIVDA): enquiries@bivda.org.uk
- Proprietary Association of Great Britain(PAGB): regulatory@pagb.co.uk
영국(GB) 내 의료기기 출시를 위해 확인해야 할 주요 내용
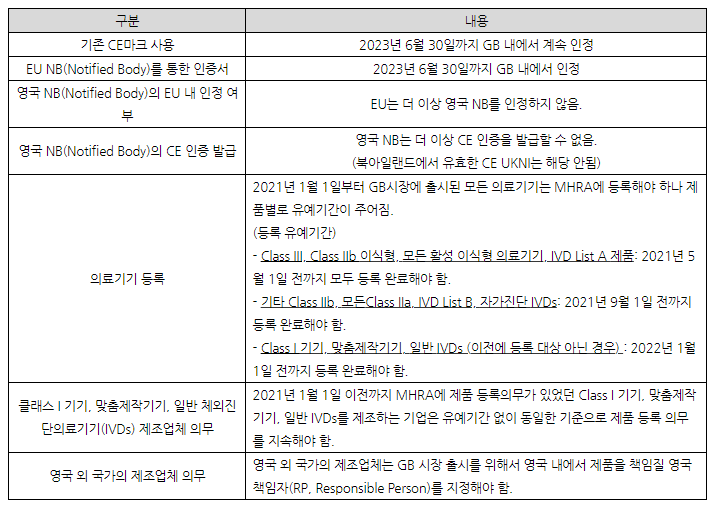
▣ 영국 내 적용 법률
능동이식형 의료기기 지침(EU AIMDD), 의료기기 지침(EU MDD), 체외진단의료기기 지침(EU IVDD)은 모두 영국 법률(UK MDR 2002, Medical Devices, Regulations 2002(SI 2002 No 618, as amended))에 적용되며 이 규정은 이행기간 이후에도 계속 효력을 지닌다. 이는 2021년 1월 1일 이후로 의료기기 영국 시장 진출과 이에 대한 요구사항 등이 EU 법률에서 파생된 요구사항을 기반함을 의미한다.
EU 의료기기규정(EU MDR)과 EU 체외진단의료기기 규정(EU IVDR)은 각각 2021년 5월 26일, 2022년 5월 26일부터 EU 회원국에만 적용되며 영국법으로는 전환되지 않는다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보
지식

