제도동향
GRP-MaPP-심사기준-15_의약품동등성시험 검토서 작성기준 (9개정)
- 등록일2021-04-19
- 조회수4266
- 분류제도동향 > 종합 > 종합
-
자료발간일
2021-04-16
-
출처
식품의약품안전처
- 원문링크
-
키워드
#의약품동등성시험#안전성시험#약리시험#의약품 안전#식품의약품안전처
- 첨부파일
의약품동등성시험 검토서 작성기준 : Guidance on Pharmaceutical-equivalence Review Templates
이 지침서는 의약품동등성시험 검토서 작성기준의 세부 지침을 정한 것으로서 식품의약품안전처 관련 부서 담당 직원의 업무처리를 위한 것입니다. 본 지침서는 대외적으로 법적 효력을 가지는 것이 아니므로 본문의 기술방식(‘∼하여야 한다’ 등)에도 불구하고 참고로만 활용하시기 바랍니다. 또한, 본 지침서는 2021년 4월 12일 현재 유효한 법규를 토대로 작성되었으므로 이후 최신 개정 법규 내용 등에 따라 달리 적용될 수 있음을 알려드립니다.
◈개요
목적 : 이 지침서(편람)는 의약품 허가(신고) 또는 변경허가(신고) 신청 시의 비교용출시험 및 비교붕해시험의 의약품동등성 검토를 위하여 심사자로 하여금 검토서 작성에 적 정을 기하게 하기 위함이다.
공개여부 : 공개
유효일 : 이 편람은 발간일로부터 유효함
연락처 : 이 편람에 대하여 문의사항 및 추가의견이 있는 경우 약효동등성과(전화:043-719-3159, 이메일: yunej0614@korea.kr)로 연락바랍니다.
◈목차
1. 목적
2. 관련규정
3. 본문
◈본문
1. 목적
이 편람은 의약품 허가(신고) 또는 변경허가(신고) 신청 시의 비교용출시험 및 비교붕해 시험의 의약품동등성 검토를 위하여 심사자로 하여금 검토서 작성에 적정을 기하게 하기 위함이다.
2. 관련규정
∙「약사법」제31조, 제42조
∙「의약품등의 안전에 관한 규칙」(총리령) 제4조, 제8조
∙「의약품의 품목허가‧신고‧심사 규정」(식품의약품안전처 고시)
∙「의약품동등성시험기준」(식품의약품안전처 고시)
3. 본문
3.1. 의약품동등성시험 검토서 양식 동 검토서의 구성 및 내용은 다음과 같다.
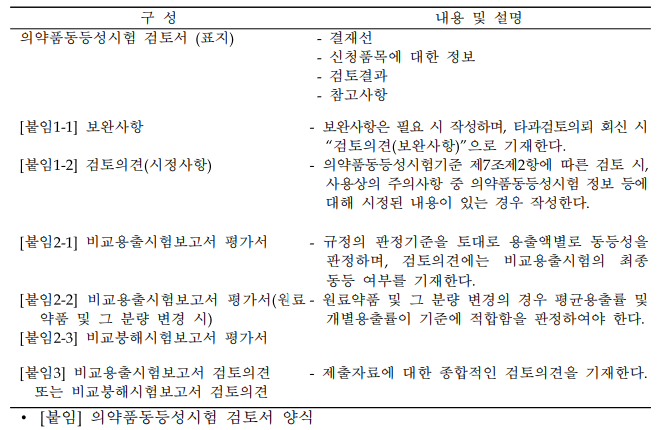
[붙임 1-1] 보완사항 - 제품명, 회사명을 기입한다.
「의약품동등성시험기준」(식품의약품안전처고시 제2020-91호)에 근거하여 다음의 자료를 제출하여 주시기 바랍니다.
1.「의약품동등성시험기준」(식품의약품안전처고시) 제3조제1항에 적합한 비교용출시험자료
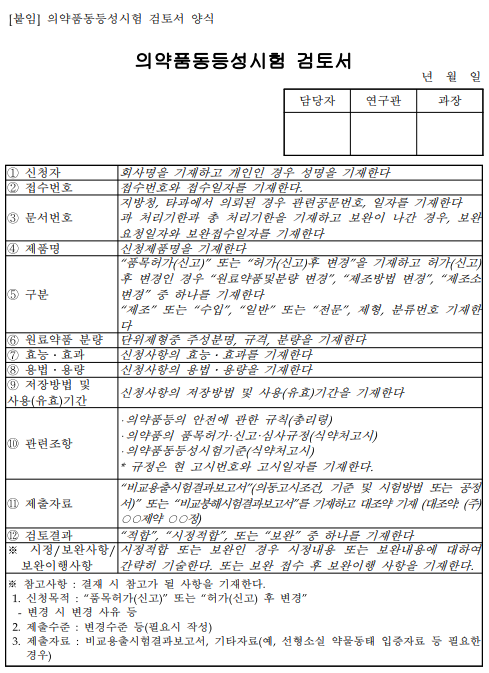

...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보


 GRP-MaPP-심사기준-15_의약품동등성시험+검토서+작성기준+(9개정...
GRP-MaPP-심사기준-15_의약품동등성시험+검토서+작성기준+(9개정...