제도동향
'생물의약품을 화학의약품으로 개발한 저분자 합성펩타이드염 제제 허가 방안' 개정 알림
- 등록일2021-09-13
- 조회수5685
- 분류제도동향 > 종합 > 종합
-
자료발간일
2021-09-10
-
출처
식품의약품안전처
- 원문링크
-
키워드
#생물의약품#화학의약품#저분자#합성펩타이드염
- 첨부파일
'생물의약품을 화학의약품으로 개발한 저분자 합성펩타이드염 제제 허가 방안' 개정 알림
◈본문
추진배경
○ 생물학적으로 제조된 펩타이드를 화학적으로 합성한 의약품 개발에 대한 국내·외 제약업계의 관심이 증가하고 있는 추세이나,
- 합성펩타이드로서 품목개발 시 기허가 제품과의 동등성 판단기준,자료제출 범위 등이 명확하지 않음
○ 국제조화된 합성펩타이드 의약품 허가방안 마련으로 제품개발 지원 필요저분자 합성 펩타이드 허가 방안
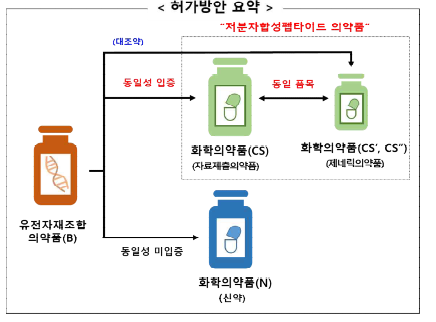
○ (기본방향) 기허가 생물의약품의 유효성분과 동일하여야 하며, 불순물의 유형 및 양이 안전한 수준임을 입증하는 국제조화 수준의 자료 제출
○ (대상) 국내 허가된 아미노산 40개 이하의 유전자재조합 펩타이드를 화학적 합성법으로 제조한 의약품
* (기허가 유전자재조합 펩타이드) 리라글루타이드, 테리파라타이드, 테두글루타이드

○ (최초 의약품) 유전자재조합의약품(B)과 합성펩타이드의약품(CS)의 주성분 간 ❶동일성* 및 ❷불순물 평가결과*에 따라 허가 유형 결정
* (참고) ANDAs for Certain Highly Purified Synthetic Peptide Drug Products That Refer to Listed Drugs of rDNA Origin(FDA, ‘21.5)
❶ 동일성 평가
- 1차 구조 및 물리화학적 특성, 2차 구조, 중합체/응집 상태
- 생물학적 특성(임상 PK/PD, 비임상 등)
❷ 불순물 평가
- 생물의약품에도 존재하는 불순물인 경우, 그 각각은 생물의약품보다 작거나 같아야 함
- 새로운 불순물인 경우, 원료의 0.5% 이하이며 각 불순물에 대한 1차 구조 및 특성 이외, 주성분의 안전성·유효성에 영향을 미치지 않음을 입증(면역원성 평가 포함)
- (동일성이 입증되지 않은 경우) 신약(N)으로 분류
- (동일성이 입증되는 경우) 자료제출의약품으로 분류(“저분자합성펩타이드”)
⇒ 동일성 입증자료, 불순물 평가자료, 기타(시설, 품질자료 등)(붙임1 참조)
* 「의약품 등의 안전에 관한 규칙」제22조제1항제2호나목을 적용하여 4년 재심사 조건 부관(필요시)
○ (이후 화학의약품) 제네릭의약품으로 분류하나 최초 화학의약품(CS)과 동일한 수준으로 평가하여 허가
* 최초 화학의약품이 아닌 유전자재조합의약품과 동일성 입증
.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
이전글
- 나고야의정서 국내외 동향 ABS BRIEF [제 112호]지역협정이 아프리카의 생물다양성과 지속가능한 무역을 촉진하는 법 등
-
다음글
- 내년 1월 유럽 임상시험 등록시스템에 큰 변화
관련정보


 생물의약품을+화학의약품으로+개발한+저분자+합성펩타이드염+제제...
생물의약품을+화학의약품으로+개발한+저분자+합성펩타이드염+제제...