제도동향
「첨단재생바이오법」 인체세포등 관리업 분야 자주묻는 질의응답집
- 등록일2022-03-28
- 조회수4822
- 분류제도동향 > 종합 > 종합
-
자료발간일
2022-03-23
-
출처
식품의약품안전처
- 원문링크
-
키워드
#식품의약품안전처#식약처#첨단재생바이오법
- 첨부파일
「첨단재생바이오법」 인체세포등 관리업 분야 자주묻는 질의응답집
◈목차
Ⅰ. 일반사항
Ⅱ. 인체세포등 관리업
◈본문
Q1. 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」 (이하 첨단재생바이오법) 제정 취지는? 제정에 따라 달라지는 점은?
○ 생명공학 기술 발달로 최근 개발되고 있는 첨단바이오의약품은 살아있는 세포·조직 등을 원료로 하고, 체내에 장기간 머무는 등 합성의약품과는 다른 특성을 가지므로,
- 첨단바이오의약품은 안전성·효과성 검증, 채취 및 생산 등 과정, 사후관리 등에서 차별화된 평가 및 관리 방식이 필요합니다.
○ 이에, 원료 채취부터 시판 후 장기추적조사까지 전주기 안전관리체계를 구축하고, 기술발전에 신속하게 대응하기 위하여 약사법에서 분리해 별도 법률로 제정하게 되었습니다.
○ 이 법이 시행되면 첨단바이오의약품 원료채취부터 최종 사용 단계까지 정부가 책임 있게 관리하게 되며,
- 제제의 특성을 반영한 허가·심사를 통해 안전성·유효성이 확보된 첨단바이오의약품이 공급되어 환자 안전이 제고될 수 있을 것으로 기대됩니다.

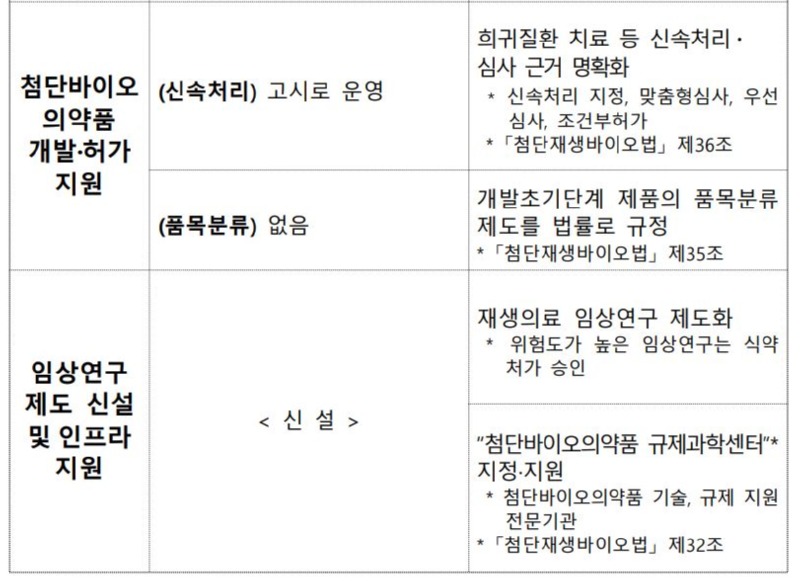
Q2. 기존 식약처의 임상시험과 첨단재생의료 임상연구의 차이점은?
○「약사법」제2조제15호에 따른 “임상시험”이란 의약품 등의 안전성과 유효성을 증명하기 위하여 사람을 대상으로 해당 약물의 약동, 약력,약리, 임상적 효과를 확인하고 이상반응을 조사하는 시험으로서,
- “임상시험”을 하려는 자는 개발계획, 임상시험계획서 등을 제출하여 식약처의 승인을 받아야 합니다.
- “임상시험”에서 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」 (이하, 「첨단재생바이오법」)에 따른 첨단재생의료 임상연구는 제외됩니다.
○「첨단재생바이오법」 제2조제3호에 따른 "첨단재생의료 임상연구"란 환자의 삶의 질 향상 및 질병 치료 기회 확대를 목적으로 사람을 대상으로 첨단재생의료에 관하여 재생의료기관(연구자) 주도로 실시하는 연구로,
- “첨단재생의료 임상연구”의 연구계획은 ‘첨단재생의료 및 첨단바이오 의약품 심의위원회’의 심의를 받아야 합니다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보
동향
- 정책동향 식약처,‘2025 CELL-UP 첨단바이오의약품 규제지원사업 캘린더’배포(상반기 업데이트) (’25.2.28.) 2025-04-25
- 정책동향 평가원, 2025년 제1차 식품의약품안전처 출연연구개발사업 신규과제 통합 재공고 알림 (’25.2.7.) 2025-04-23
- 정책동향 식약처, 2025년 식품의약품안전처 주요 정책 추진계획 발표 (’25.1.21.) 2025-04-22
- 정책동향 식약처, ‘2025 CELL-UP 첨단바이오의약품 규제지원사업 캘린더’ 배포 (’25.1.3.) 2025-04-21
- 기술동향 식약처, ‘키메라 항원 수용체(CAR) T 치료제 개발 시 고려사항(민원인 안내서)’ 제정 (’24.12.20.) 2025-04-18


 첨단바이오의약품+자주묻는+질의응답집[민원인안내서]_인체세포등...
첨단바이오의약품+자주묻는+질의응답집[민원인안내서]_인체세포등...