제도동향
2023 상반기 FDA, EMA 신약 승인 현황
- 등록일2023-08-21
- 조회수5774
- 분류제도동향 > 레드바이오 > 의약기술
-
자료발간일
2023-08-16
-
출처
국가신약개발재단
- 원문링크
-
키워드
#FDA#EMA#신약 승인
2023 상반기 FDA, EMA 신약 승인 현황
◈ 목차
1. FDA 승인 내역
2. EMA 승인 내역
Overview
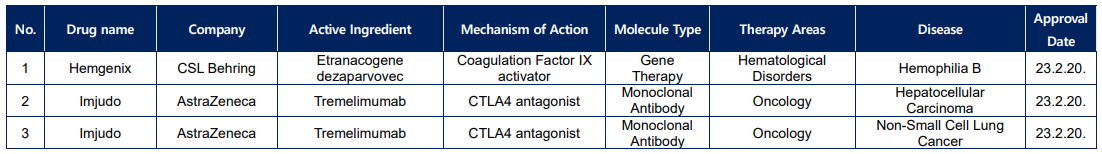
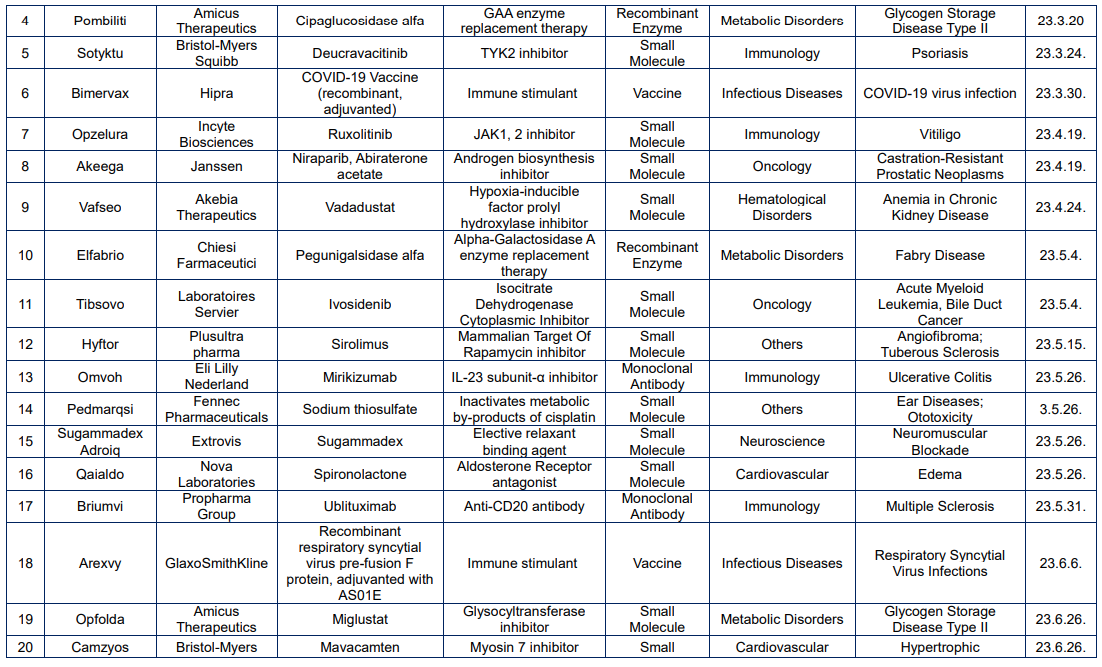
2023년 상반기 미국 식품의약국(FDA)과 유럽 의약품청(EMA)은 각각 30건, 22건의 신약을 승인하였다. 올해 두 기관에서 모두 승인을 획득한 신약은 파브리병 치료제 Elfabrio(성분명; pegunigalsidase alfa)와 미만성 거대 B세포 림프종 치료제 Columvi(성분명: glofitamab-gxbm)가 있다.
*FDA 승인 내역 기준일: 2023.07.25 / EMA 승인 내역 기준일: 2023.07.08.
FDA 승인 신약 30건을 모달리티 별로 분류하였을 때, small molecule 이 18건(60%)으로 가장 많았으며 Ab 가 6건(20%), recombinant enzyme과 peptide 가 각각 2건(각 7%), gene therapy가 1 건(3%) 승인되었다. 질병 영역(TA)별로는 oncology 가 6건(20%), neuroscience 가 5건(17%), infectious diseases 와 metabolic disorders 가 각각 4건(각 13%) 순으로 많았으며, 그 외에도 ophthalmology 가 3건(10%), Immunology 가 2건(7%) 등을 차지하였다.
EMA 승인 신약 22건의 경우, 모달리티 분포가 FDA와 유사하게 small molecule이 12건(55%)으로 가장 많았으며, Ab가 5건(23%), recombinant enzyme 과 vaccine 이 각각 2건(각 9%), gene therapy 가 1건(5%) 순으로 많았다. TA 별로는 oncology 가 6건(27%), immunology 가 4건(18%), metabolic disorders 가 3건(14%)순으로 많았으며, cardiovascular 와 Hematological disorders 가 각각 2건(각 9%)등 신약 승인을 받았다.

[FDA vs EMA Modality]

[FDA vs EMA Therapy Areas]
◈본문
1. FDA 승인 내역
상반기에는 일곱 개 제품이 가속 승인 경로에 따라 승인되었다.
(1) Biogen/Eisai 의 알츠하이머병 치료제 Leqembi, (2) Eli Lilly 의 외투세포 림프종 치료제 Jaypirca, (3) Travere 의 IgA 신병증 치료제 Filspari, (4) Incyte 의 메르켈세포암 치료제 Zynyz, (5) Ionis/BioGen 의 근위축성 측색 경화증 치료제(ALS) Qalsody, (6) Genmab/AbbVie 의 미만성 거대 B 세포 림프종 치료제(DLBCL) Epkinly, (7) Roche 의 DLBCL 치료제 Columvi 이다.
바이오젠과 에자이가 공동 개발한 레켐비(성분명: lecanemab)는 베타 아밀로이드를 표적으로 하는 단일 항체 알츠하이머병 치료제이다. 올해 1월 6일 가속승인을 획득한 후, 대규모 글로벌 CLARITY AD 임상 3 상에서 임상 혜택을 입증하여 지난 7월 6일 정식 승인을 획득했다. 데이터 분석기업인 글로벌데이터(GlobalData)는 2028 년까지 레켐비가 129억 달러(약 17조)의 매출을 달성할 것이라고 예측하였다.
BTK 억제제로 FDA 승인을 받은 일라이릴리의 외투세포림프종의 3차 치료제인 Jaypirca(성분명: pirtobrutinib)는 동일 표적의 경쟁 약물들이 이미 2차 치료제로 승인을 받은 후 4번째로 시장에 출시되었다. 기존 외투세포림프종 치료제 FDA 승인 약물은 (1) 애브비와 J&J 의 Imbruvica(성분명: ibrutinib), (2) 아스트라제네카의 Calquence(성분명: acalabrutinib maleate), (3) 베이진의 Brukinsa(성분명: zanubrutinib)이다.
그러나, 앞선 약물이 ‘공유결합’으로 BTK 에 결합하는 반면, 자이피르카는 ‘비공유 결합’으로 결합하기 때문에, 틈새 시장을 확보하는데 중요한 강점으로 작용할 수 있다. 실제로 BRUIN 임상 1/2 상에서 공유결합 BTK 억제제로 치료했던 환자의 50%에서 자이피르카가 효능을 보였다.
트래버 테라퓨틱스의 IgA 신병증 치료제 Filspari(성분명: Sparsentan)는 FDA 시판 허가를 받은 첫 비스테로이드성 약물로, 엔도텔린 안지오텐신 수용체 이중길항제이다. FDA는 PROTECT 3상 시험에서 36주의 치료 기간 동안 ARB(Angiotensin II receptor blockers) 대조군인 irbesartan 에 비해 Filspari가 단백뇨를 현저히 감소시킨 데이터를 기반으로 가속 승인을 결정하였다. Filspari를 복용한 환자는 기준 대비 평균 49.8%의 단백뇨 감소를 달성한 반면 대조군은 15.1% 감소하였다.
가속 승인 뿐만 아니라 이번 분기에는 다수의 최초 치료제 승인들도 많았다.
Reata의 NRF2 활성제인 Skyclarys(성분명: omaveloxolone)는 퇴행성 신경근 장애인 Friedreich 운동실조증을 치료하는 최초의 치료제가 되었으며, 거의 여아에게만 영향을 미치는 희귀 신경 장애인 레트 증후군도 Acadia Pharmaceuticals 의 IGF1 조절제인 Daybue(성분명: Trofinetide)가 승인되면서 치료 옵션을 갖게 되었다.
Menarini 의 전이성 ER, HER2-, ESR1 변이 유방암 치료제 Orserdu(성분명: elacestrant)는 최초의 경구용 선택적 에스트로겐 수용체 분해제가 되었으며, Chiesi Farmaceutici 의 Lamzede(성분명: velmanase alfa)는 최초로 매우 희귀한 리소좀 축적 질환인 α만노시도증의 치료제로서 FDA 승인을 획득하였다.
Pharming은 극희귀 자가면역질환인 활성화된 PI3K Delta 증후군 환자를 위한 최초의 치료제인 Joenja(성분명: leniolisib)를 승인받았다. 활성화된 PI3K Delta 증후군은 미국에서 확인된 환자가 200 명에 불과하며, 반복적인 호흡기 감염과 면역조절장애를 특징으로 한다.
하반기에는 일라이 릴리의 도나네맙(Donanemab, Aβ mAb/알츠하이머), MSD 의 소타터셉트(Sotatercept, ACVR2A-Fc antagonist/폐동맥 고혈압) 등이 FDA 승인 신청을 준비하고 있다.
<상반기 FDA 승인 신약 리스트>


2. EMA 승인 내역
올해 상반기 두가지 신약이 FDA 와 EMA 에서 동시에 승인을 받았다.
(!) Chiesi/Protalix 의 Fabry 병 치료제 Elfabrio 와 (2) Roche 의 DLBCL 치료제 Columvi 이다.
Chiesi/Protalix 가 공동개발한 희귀 유전성 대사 질환인 파브리병 치료제인 Elfabrio(성분명: pegunigalsidase alfa)는 올해 5월 두 기관에서 승인을 획득했다. 파브리병은 α-galactosidase A 결손으로 인해 Gb3(globotriaosylceramide)가 세포내에 축적 되어 임상적 증상을 유발하는 질환으로, 다양한 임상시험(BALANCE, BRIDGE, BRIGHT 등)에서 Elfabrio 가 환자의 Gb3 수치를 감소시키는 효력을 입증하였다.
로슈는 CD20xCD3 이중 특이적 항체 Columvi(성분명: Glofitamab-gxbm)의 FDA(올해 6 월), EMA(올해 7월) 승인을 순차적으로 획득했다. 컬럼비는 현재 임상 1/2 상 NP30179 연구결과를 기반으로 미만성 거대 B 세포 림프종의 3차 치료제로 조건부 승인을 획득한 상태이며, 추가 임상시험 결과를 통해 유익성을 입증해야 한다.
<상반기 EMA 승인 신약 리스트>

지식
동향

