기술동향
사람과 쥐의 배아줄기세포 차이
- 등록일2004-10-27
- 조회수16836
- 분류기술동향
-
자료발간일
2005-02-26
-
출처
KISTI
-
원문링크
-
키워드
#배아줄기세포
사람과 쥐의 배아줄기세포 차이
(Differences between human and mouse embryonic stem cells)
전문연구위원 / 강계원
1. 서론
□ 배아줄기세포주(ES Cell Lines)는 쥐의 배반포에서 세포덩어리(Inner Cell Mass, ICM)를 배양하면서 처음으로 만들어졌다. 배가 착상되기전에 세포를 분리하여 세포를 배양함으로써 집합체로 세포 군집이 자라고 키메라와 유전자 전이된 여러 가지 조직으로 분화하는 능력을 보여주었다.
□ 이 세포를 배양하여 외배엽, 내배엽, 중배엽의 파생세포로 분화하는 것도 확인하였다. 쥐의 배아줄기세포주를 만들면서 이 세포의 증식과 생장인자 의존도 그리고 발현에 대한 표적인자에 대해서도 많이 이해하게 됐다.
□ 쥐의 초기 배반포에서 배아줄기세포의 발현유전자로 전사인자, POU영역에 OCT3/4, 호메오복스 영역의 SOX-2, Zinc Finger Protein(REX-1), 전사활성인자(UTF-1), 탄수화물의 에피토프(SSEA-1와 SSEA-3)가 식별되고 있다. 이러한 유전자를 식별하는 데는 배가 착상하기 전에 항체를 이용하여 찾아내고 있다.
□ 쥐의 배아줄기세포(ES Cells)는 영양외배엽(Trophoectoderm)으로 분화하지 않고 배의 섬유아세포가 놓인 배양 장려기(Culture on a Feeder Layer)에서 계속 번식시킬 수 있다. 이러한 Feeder가 없이 백혈병 억제인자(Leukemia Inhibitory Factor, LIF)나 이와 비슷한 세포활성물질(Cytokines)을 첨가하여 증식시킬 수도 있다.
□ 이렇게 증식되는 세포는 많은 양의 말단효소(Telomerase)를 유지하고 염색체형(Karyotype)도 안정되어 있다. 여러 차례 반복배양을 하면 키메라나 기형종(Teratoma)를 형성한다.
□ 최근에 영장류와 사람에서도 ES세포를 분리하게 되었는데 처음에는 여러 마리 원숭이에서 시도했고 그 다음에는 사람에서 다섯 배아줄기 세포주를 만들었다. 그 후 여러 실험실에서 반복되어 지금은 NIH에 등록되어 연구에 활용할 수 있는 세포주 만도 64 개가 있다(http://escr.
nih.gov). 그러나 실제로 지금 충분한 자료와 특성을 분석할 수 있는 세포는 10주 미만이다.
□ 최근 연구에서는 제한적이기는 하지만 사람과 쥐의 배아줄기세포주가 차이가 있다고 본다. 사람의 ES세포에서 발현되는 세포 표면의 당지방질 혹은 당단백질 마커(marker)가 쥐의 배 항원(SSEA-1)과 비슷하다는 것이다. 사람의 배 종양에서 식별된 SSEA-3, SSEA-4, TRA-1-81, TRA-1-60 유전자들이 알려져 있다.
□ 사람의 ES세포는 쥐의 ES세포와 달리 세포의 증식이나 분화의 만능성을 유지하는데 백혈병억제인자(LIF)가 필요하지 않는 것 같다. 그러나 LIF가 다른 역할을 하는지 배종양세포(EC)에서 작용을 하는지는 아직 확실하지 않다.
□ 사람의 ES세포는 쥐에서와 달리 영양모세포와 같은 모양의 세포로 분화할 수 있는 차이점이 있다. 말단효소(Telomerase)에 있어서 아직 그 조절에 대한 구체적인 비교 방법은 없으나 사람과 쥐의 Telomerase는 생물학 적 차이는 있다고 보고 있으며 따라서 쥐의 배아줄기세포의 성질을 그대로 사람에게 적용시키는 것은 주의를 요한다.
□ 이 논문에서는 ES 연구에 흔히 사용되는 쥐의 배아줄기세포주(D3)와 사람의 ES 세포주(H1)를 같은 실험실에서 같은 조건에서 배양하여 비교하고 있다. 쥐의 ES세포를 실험하는데 이용되는 여러 가지 마커가 사람의 ES 세포에서도 이용될 수 있음을 보이고 있다.
□ 그러나 형태학적으로, 배의 항원염색. Marker의 발현, 시토킨의 발현, 세포주기, 세포사멸을 조절하는 유전자에는 차이가 있다는 사실이다. 이러한 차이는 사람의 세 개의 ES 세포주에서 고정적으로 나타나고 있어 종과 종 사이에는 근본적인 차이가 있다고 본다.
2. 방법
□ 세포배양 방법
○ 사람의 ES 세포주 H1은 위스칸신의 WiCell Research 연구소에서 분양받아 배양하였으며 배지는 20% 혈청을 보충한 DMEM/F12에 100mM L-Glutamine, 항생제, MEM 비필수아미노산, 0.55mM beta-Mercaptoethanol, 2mM Antimycotics, 4 ng/ml 섬유모세포 생장인자(Human Basic Fibroblast Growth Factor, bFGF)를 첨가하여 쥐배의 섬유모세포(Mouse Embryonic Fibroblast, MEF) Feeder에서 배양하였다.
○ MEF는 StemCell Technology사에서 구입했으며 MEF에 0.5% 소의 Gelatin을 입힌 배양 Dish에 DMEM으로 증식시켰다. MEF 유착배양에서는 10 Ag/ml Mitomycin C에서 3시간 동안 세포분열을 중지시켜 트립신(Trypsin)으로 처리하여 젤라틴을 바른 Dish에 옮겼다. 이 논문에서는 ES 세포를 Feeder를 통해 배양하는 방법을 자세하게 기록하고 있는데 세포를 접종한 후 8-10일이 되면 세포를 콜라겐분해 효소를 이용하여 RNA를 검사하게 된다.
○ 쥐의 D3 배아줄기세포 배양은 ATCC에서 얻은 세포주에서 섬유모세포 Feeder를 이용하여 배양하였고 배양 후에 세포를 Trypsin으로 분리 다시 소의 젤라틴으로 Coating한 배지(Dulbecco's Minimal Essential Medium, DMEM)에 LIF를 첨가하였다. 배지에는 이외의 여러 가지 필요한 요소 아미노산, 항생제를 첨가 배양하여 수확된 D3 세포는 면역염색으로 검증한다.
□ RT-PCR에 의한 유전자 탐색
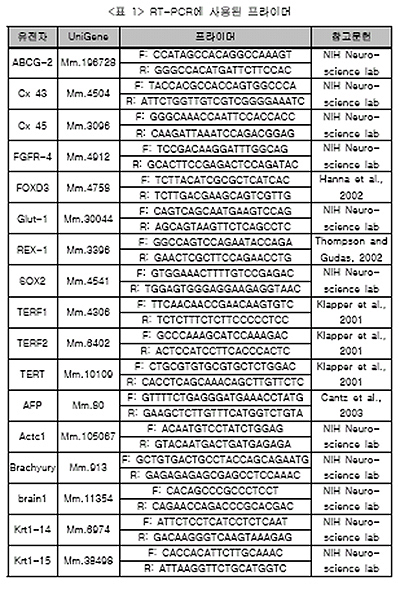
○ RNA는 Qiagen의 방법을 이용해서 분리하고 이 RNA를 근거로 cDNA 100ng에서 1ug까지를 생산했다. RedTaq DNA Polymerase를 이용하여 PCR을 35회 반복, 증식하여 한천에서 전기연동으로 분리 하였다. 이 논문의 <표 1>에는 100개가 넘는 RT-PCR에 사용된 Primer가 기재되어 있다.
□ 면역세포화학으로 검색하기 위해서는 세포를 Paraformaldehyde로 고정하고 다시 항체를 가진 배지에 접종하여 여러 차례 씻어내고 동위원소로 표적하여 세포 표면의 Marker로 세포를 식별하였다. 이러한 실험은 시약화사가 준비한 방법에 의하여 수행하고 있다.
□ 전자현미경조사는 배양한 H1이나 D3세포가 분화하기 전에 Glutaraldehyde로 고정하여 전자현미경에서 조사를 하는데 플라스틱에 Osmium Tetroxide로 고정하여 1um 두께로 잘라 관찰하였다. 이러한 시료제작은 표준제작법에 따랐다.
□ cDNA의 미세배열을 이용하여 사람과 쥐의 세포주기, 세포사멸, 세포활성인자의 유전자를 선택하기 위하여 방사선을 용하지 않은 GEArrayk Q series cDNA의 발현방법을 활용하였다. 사람과 쥐의 유전인자가 서로 같지 않은 것이 활용된 경우도 있고 실험은 두 번 반복해 수행했다.
□ 말단효소의 작용을 측정하기 위해서는 Southern Hybridization으로 염색체 말단의 반복증식조사법(Telomeric Repeat Amplification Protocol, TRAP)을 이용하였다. EST의 계산은 사람의 배아줄기세포의 발현에서 H1,H7,H9의 세포주와 배상체(EB) 그리고 분화한 세포군집을 조성해서 측정했다. 특정한 유전자에 대해서는 분화한 세포와 분화하지 않은 세포에서 EST를 비교하기도 했다.
3. 결과
□ 사람과 쥐의 ES 세포 형태나 일반적으로 사용하는 발현 마커를 이용하여 세포를 배양하면서 전자현미경, 면역세포화학 혹은 RT-PCR를 통해 평가해 보면 분화하지 않은 사람의 H1과 쥐의 D3은 많은 유사점도 있지만 상당한 차이점도 있다.
□ 전자현미경에서는 H1세포는 Feeder 세포 위에 2-4층의 세포가 형성되지만 D3 세포는 그층이 4-10개로 두터운 층이 만들어 진다. Phase Contrast로 보게 되면 사람의 ES 세포는 세포가 자라는 콜로니가 둥글고 그 갓 부분이 명확하게 구분이 되는데 반해 쥐의 세포는 콜로니의
모양이 불규칙하게 보인다.
□ H1이나 D3에 관계없이 핵과 세포질의 비를 보면 크게 나타나며 많은 리보솜을 갖고 있다. 이 세포들은 배지가 공급되는 방향으로 Villi를 뻗치고 있으며 세포끼리도 아주 치밀하게 붙어있다는 사실이다.
□ D3 세포가 H1 세포와 확실하게 다르게 보이는 하나는 D3에서 세포사멸현상 특히 이 세포 콜로니의 변두리에 많다는 점이며 쥐의 ES 세포에서는 약 4분의 1정도의 세포는 자가 포식되는 것으로 보인다. 높은 밀도의 전자를 가진 리소솜의 구조는 사람의 배아줄기세포에서는 흔하지 않는 형상이며 분화하지 않은 줄기세포에서 여러 가지 마커를 발현 시키는 사실이 다방면으로 확인되고 있다.
□ 쥐의 D3 세포에서는 SSEA-1을 발현하지만 SSEA-4는 발현하지 않는다는 사실은 확실하나 사람의 H1에서는 두 가지가 모두 특정 항원으로 배의 발달과정이 특정기간에 발현된다는 점이다. D3나 H1세포 모두가 SSEA-3를 발현하고는 있지만 쥐에서는 그 발현세포가 적다는 점이고 H1에서는 TRA-1-60와 TRA-1-81항원을 만들고 있다.
□ RT-PCR를 이용해 배아줄기세포의 특성유전자인 OCT3/4, SOX-2, BEX/REX-1, TERT의 발현을 조사해보면 D3와 H1의 형태학적인 면이나 항원의 검색이나 또는 세포의 만능성에서 차이는 없다는 점이다.
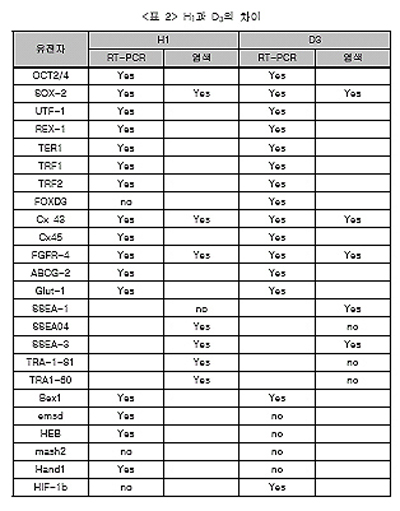
□ 추가적인 ES 세포의 마커를 살펴보면 분화하지 않은 세포에서 만능성에 관계된 유전자는 OCT3/4, SOX-2, UTF-1, FOXD3, FGFR-4와 말단효소와 관계된 인자 TERF1와 TERF2를 들 수 있고 그 외 배반포의 표면에 마커로 알려진 유전자도 많이 있어 이들 역시 H1이나 D3에서 쉽게 탐색되고 있다. 예를 들면 Gap Junction 단백질 Connexins-43과 45, Glucose Transporter GLUT1, 또 다른 수송단백질 BCRP-1/ABCG-1등이 있다. 이러한 마커의 사람과 쥐의 ES세포에 차이를 다음 <표 2>에서 볼 수 있다.
□ 분화된 세포에서 나타나는 마커
○ 사람의 ES 세포도 영장류에서와 같이 배양을 하게 되면 영양모세포로 분화하게 되는데 이 점은 쥐의 ES 세포와 다른 점이라 할 수 있다. 그래서 H1과 D3의 영양모세포에서 발현은 초기영양외배엽의 마커로 분석하게 되며 관련 유전자로는 Bex1/Rex3, Eomesodermin과 다른 전사인자, Mash2/Hash2, HEB, Hand-2와 HIF-1beta/ARNT 등을 이용하고 있다.
○ 이중에서도 Eomesodermin같은 단백질은 사람의 ES 세포에서 항상 나타나고 Mash2나 Hash2같은 사람의 Homolog는 RNA준비과정에서 사람과 쥐에 늘 나타나는 것으로 보인다. ES 세포 마커는 물론 다른 줄기세포 마커를 이용하더라도 사람과 쥐의 세포를 구별하는데 도움을 얻을 수 있다고 본다.
□ 세포의 번식과 세포사멸유전자의 발현으로 본 D3과 H1의 배아줄기세포의 비교를 나타낸다.
○ 면역세포화학이나 RT-PCR를 이용해 세포의 분화과정을 관찰하면 사람과 쥐의 세포는 세포 주기를 조절하는 문제나 세포활성물질에 대한 반응에 있어서도 차이가 있는 것으로 보인다. 96개의 이러한 유전자를 Microarray로를 제작하면서 이 중 80개는 사람과 쥐에 Homolog의 유전자를 사용하였으며 나머지는 사람의 유전자를 Array로 만들었다.
○ 유전자의 거의 반은 발현을 하고 있어 ES 세포가 증식하는 것을 확인 했으며 11개의 유전자는 잘 못 짝이 지워졌고 3개는 사람에서는 발현되나 쥐에서는 없는 것으로 보인다. 어떤 유전자는 세포의 번식시기에 따라 다른 형태로 발현되는 것도 알 수 있었고 E2F와 Tyrosine 3-Monooxygenase 같은 유전자는 Array에는 없었으나 쥐의 ES 세포에서 발현되는 사실도 확인했다.
○ 그리고 Ki67, PCNA, cyclins이 세포증식의 마커로 확인되었으나 종양억제유전자 ATM, Rb, 망막모세포증 같은 단백질이나, BRCA1는 담색하지 못했다.
□ 세포의 주기와 사멸에서 사람과 쥐의 발현이 차이가 있는 것과 같이 시토킨의 양이나 신호의 정도에도 차이가 있다고 보고 있으며 시토킨 관련 뼈 형성 단백질(Bone Morphogenetic Proteins, BMPs), 콜로니 촉진인자(Colony-Stimulating Factors, CSFs), 섬유모세포 성장인자 (Fibroblast Growth Factors, FGFs), 인터페론(Interferons, INFs), 인슈린 유사생장인자(Insulin-like Growth Factors, IGFs), 인터루킨 (Interleukines,ILs), 혈소판 유래 성장인자(Platelet-Derived Growth Factors, PDGFs), 형질전환 생장인자(Transforming Growth Factors, TGFs), 종양괴사인자(Tumor Necrosis Factors, TNFs), 혈관내피성장인다(Vascular Endothelial Growth Factors , VEGFs)등에 대해서도 발현을 확인 했으며 D3세포가 H1에서 보다 대체로 많이 발현된다는 사실이다.
□ LIFR/gp130 의한 신호전달
○ 사람의 배아줄기세포는 자체 증식하는데 백혈병억제인자, LIF가 꼭 필요한 것은 아니며 다만 쥐의 경우에는 있어야 하는 것으로 보인다. LIF가 필요한지를 알기위해서는 LIF의 수용체나(LIFR) 신호전달의 변환단벡질(gp130)을 활용하게 되며 이러한 단백질이 H1세포에서는 인식되지 않는데 반해 D3에서는 인식되고 있다.
□ 분리된 배아줄기세포에서도 사람과 쥐의 특성은 보존된다는 사실이며 사람과 쥐의 배아줄기세포에서 분화 능력이나 분화를 확인할 수 있는 마커, LIFR/gp130, 세포사멸에 관련된 유전자 그리고 세포활성물질이 본질적으로 다르다고 생각하고 있다.
□ 그러나 한편에서는 그것보다는 이러한 차이는 줄기세포를 어떤 계통의 세포를 얻어 어떻게 유지하느냐에 따른 것으로 보는 견해가 있다. 그래서 이러한 문제를 확인하기 위해서 여러 실험에서 얻은 ES 세포주를 50회나 번식하도록 배양하여 RNA를 채취 유전인자와 마커를 조사하였다. 사람의 H1세포에서는 FOXD3, ARNT, Beta-Tubulin Class III, 그리고 GATA2가 발현되지 않았으나 D3세포에서는 나타났다.
□ 또 Microarray 분석에서도 사람과 쥐의 ES 세포에는 여러 개의 차이를 발견하고 있어 이러한 여러 가지 증거를 종합할 때 사람의 ES 세포와 쥐의 ES 세포는 세포학적으로 다르다는 것이다.
4. 결론
□ 이 논문에서는 사람과 쥐의 배아줄기세포 안에서 분화되지 않은 상태로 유지되고 있는 약 400개의 유전자를 발현시켜 비교하였다. 발현 마커가 분화의 만능성에 있어서는 사람과 쥐의 세포가 비슷하다는 결론을 얻었으며 이러한 결론은 최근에 Microarray를 이용하여 연구한 내용과도 일치하는 사실로 분화하지 않은 세포를 배양하여 분화의 신호를 감지할 수 있다는 것이다.
□ 면역염색으로 마커를 식별하는 방법과 또 Primer를 통해 마커를 확인하는 방법과 같이, 이 논문에서 사용된 방법은 배아줄기세포 배양에서 좋은 Monitoring으로 활용할 수 있을 것으로 본다. 이용된 Primer는 특정한 cDNA파편을 확대해 가는데 활용되고 있는데 수용체나 전환체의 발현은 없거나 낮은 반면 대사경로의 억제제는 높다는 사실이다.
□ RT-PCR을 이용해 사람과 쥐의 태아조직을 검사한 결과는 배의 항원에는 차이가 있다는 것과 영양외배엽으로 발달하는 능력에도 차이가 있음을 확인했다. 백혈병억제인자의 수용체 발현에 있어서도 사람의 배아줄기세포에서는 아주 미약하거나 없는데 반해 쥐의 경우는 쉽게 탐색된다는 점이다.
□ 이러한 결과는 백혈병억제인자가 없어도 사람의 줄기세포는 미분화 상태를 유지할 수 있음을 알 수 있다. 또한 기형암(Tratocarcinoma)의 경우 LIF의 신호가 변경되고 시토킨의 신호전달 경로가 억제된다. 쥐에 있어서도 LIF에 관계없이 자체재생기능을 가진 경우를 발견하고 있지만 사람에 비하면 아주 미약한 정도로 보인다.
□ 최근에 호메오박스 단백질 나노그(Nanog)가 LIF와 관계없이 자체재생에 관여하는 것으로 보이며 이 Nanog는 지금까지 조사된 사람의 세포주에는 보존되어 있다. 사람과 쥐의 ES세포에서 FoxD3의 차이인데 쥐에서 FoxD3의 발현은 여러 차례 확인된 바 있으며 다만 이 논문에서 발현이 확인되지 못했다. 다른 논문에서는 사람의 ES 세포에서도 발현된 예도 있기는 하나 쥐에서는 내배엽으로 발달하는데 중요한 인자로 알려져 있다.
□ 이번 연구는 세포주기, 세포사멸, 그리고 시토킨 유전자의 발현에서 차이가 있다는 사실을 발견했으며 이러한 차이는 다만 양적인 것 뿐 아니라 신호를 전달하는 과정에서 차이가 있다는 점이다.
□ 요약해 보면 배아줄기세포에서 자체재생을 조절하거나 분화를 유도하는 전반적인 조절 전략은 여러 종에서 비슷하다는 결론을 얻었다. 그러나 중요한 차이는 존재하며 이러한 차이를 식별하고 분화단계에서 필요한 마커를 찾아 특성을 확인 개발하는 것은 중요한 일이다. 이러한 마커가 개발되면 지금까지 설립된 60여 개의 ES 세포주에 적용하여 실험해 볼 필요도 있다. 이 저자들은 이러한 실험은 계속하고 있으며 앞으로 설립될 세포주에도 적용되어 종간의 분자수준의 차이는 물론 기능을 이해하는데 노력하고 있다.
전문가 제언
□ 최근에 줄기세포를 이용한 세포치료와 조직 재생에 대한 연구에 많은 관심을 갖고 있으며 특히 배아줄기세포의 가능성이 알려지면서 손상된 장기를 줄기세포를 이용하여 대체할 수 있지 않을까 하는 기대까지 하고 있다. 그러나 사람의 배아줄기 세포연구는 배를 파괴하고 또 다른 인간의 복재 가능성 같은 윤리적인 문제와 연관되어 있어 많은 연구가 다른 동물, 그 중에도 쥐를 이용하여 연구되고 있다. 쥐의 배아줄기세포는 1981년에 배반포에서 세포덩어리를 배양하는데서 처음으로 만들어졌으며 사람의 경우는 1998년에 불임치료에 이용된 배에서 분리 배양에 성공하였으며 지금 까지 60여 세포주가 미국 NIH에 등록되어 있다. 그러나 이 중에도 충분한 자료를 갖고 분석할 수 있는 사람의 세포주 수는 10개 미만이다.
□ 배아줄기세포에서 유전자의 발현을 면역세포 화학적인 방법이나 RT-PCR, 또는 cDNA Array 등으로 분석해 보면 상당한 유전자의 발현 과정이 분화하기 전의 세포에서 분화된 세포로 연계하여 식별가능하다는 점이다. 이러한 식별 가능한 마카로는 SSEA항원, OCT3/4, SOX-2, REX-1, TERT, UTF-1, TRF1, TRF2, Connexin43, 그리고 Connexin45, FGFR-4, ABCG-2 와 Glut-1등이 있다. 이러한 마커는 대체로 사람과 쥐의 배아줄기세포에서 발현이 비슷하게 나타나고 반면에 Vimentin, h-III Tubulin, Alpha-Fetoprotein, Eomesodermin, HEB, ARNT, 그리고 FoxD3, LIF Receptor Complex LIFR/IL6ST (gp130)등은 차이를 보이고 있다.
□ 국내에서 배아줄기세포에 대한 연구에 많은 관심을 갖고 있으며 사람의 배아줄기세포를 쥐에 이식하여 인간과 쥐의 유전자가 섞인 쥐를 생산하는 기술을 세계에서 처음으로 개발했다고 밝힌 바 있다. 사람과 쥐의 배아줄기세포는 비슷한 점도 많으나 뚜렷하게 다르다는 점도 발견되고 있다. 이러한 차이는 배양이나 세포주에 따른 것이 아니고 본질적으로 다르다는 점이며 동물의 연구결과를 사람에게 적용할 때 간과하지 말아야 한다.
지식
동향

