기술동향
시스템생물학과 바이오신약 개발
- 등록일2004-09-01
- 조회수15888
- 분류기술동향
-
자료발간일
2005-01-18
-
출처
biozine
-
원문링크
-
키워드
#시스템생물학
시스템생물학과 바이오신약 개발
|
류성언 한국생명공학연구원 단백질체시스템연구센터 |
 |
시스템생물학연구의 개념
지난 세기 중반부터 현대 분자생물학 연구기법이 도입된 이래 수십년간 생물학 연구는 생명현상에서 중요한 역할을 하는 특정 유전자, 단백질, 대사산물의 기능을 분석하여 전체 기능조절을 설명하려고 하는 최소화주의 원칙을 가지고 진행되어 왔다. 그러나 생명체에 있어서 그 구성성분들은 각각 따로 존재하며 기능하는 것이 아니라 서로간에 유기적인 상호작용을 하고 있으며 한 구성성분의 기능이 바뀌거나 양적인 변화가 있을 때 이는 그 생명체를 이루고 있는 다른 많은 구성성분에 영향을 미치고 이들 간의 작용-반작용에 의해서 전체적인 효과가 나타난다. 이는 마치 호수에 돌을 던졌을 때 돌이 떨어지는 곳에만 수면의 변화가 일어나는 것이 아니라 그곳에서 시작하여 호수 전체로 파도가 퍼져나가는 것과 비유할 수 있다. 시스템생물학에서는 생명체의 단위구성성분의 변화가 아니라 생명체를 구성하고 있는 전체 시스템의 총체적인 연구를 통해 생명현상을 정확하게 이해하고자 한다.
시스템생물학 연구의 대표적인 예로서 세포시스템을 특정자극에 의해 변환시키고 그에 따른 시스템 구성성분의 변화를 추적하여 이를 수학적 모델로 만드는 접근방법을 들 수 있는데 이를 통하여 외부자극에 의한 세포기능 변화를 전체적으로 이해 할 수 있다. 그러나 시스템생물학 연구의 궁극적인 목표는 한 자극에 의한 세포의 변화 뿐 만 아니라 세포기능 전체 및 생명체 전체의 종합적인 이해라고 할 수 있다. 시스템생물학 연구는 생명현상의 원천적 이해 및 신약개발에 막대한 파급효과를 가질 것으로 오래전부터 예상되어 왔지만 최근까지 본격적인 연구가 시작되지 못하였다. 그 원인은 세포내의 모든 구성성분을 전체적으로 연구할 수 있는 기술의 부재 때문이었는데 최근 인간유전체의 전체 해독을 필두로 해서 단백질체 분획, 질량분석, 고효율 구조규명 등 정밀분석기술의 발전으로 세포내의 시스템생물학 연구가 가능하게 되었다.
그림 1. 시스템생물학 연구의 흐름도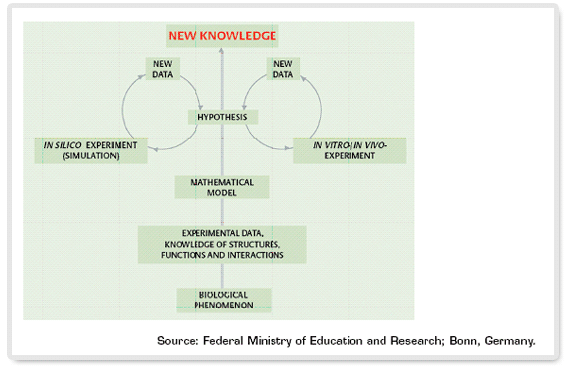
단백질체의 시스템생물학
생명체를 이해하기 위해서 우선 생명체를 이루는 최소단위인 세포의 기능을 이해해야 하는데 한 세포에만도 수십만종의 다른 구성성분이 존재한다. 이들 중에서도 실제로 세포기능을 조절하는 단백질들의 종합적인 정보가 세포기능을 이해하기 위하여 필수적인데 이를 위하여 시스템생물학적인 접근방법이 필요하다. 기존의 일반적인 단백질체 연구에서는 정상상태와 질병상태, 또는 자극이 주어지기 전과 주어진 후의 세포 단백질 중 차별발현되는 단백질들을 주로 선택해서 분석하고 이들의 기능을 연구해 왔다. 그러나 세포기능을 종합적으로 이해하기 위하여는 단순히 차별발현되는 단백질 뿐 아니라 단백질 발현의 역동적인 변화 프로파일 및 키네틱스, 세포소기관 이동, 수식화, 상호작용, 신호전달 경로 네트웍을 총체적으로 분석하고 이들을 정량적으로 모델링하여 특정 상태에서의 세포기능을 예측하는 과정을 수행하여야 한다. 또한 단백질의 기능을 정확하게 이해하고 세포기능을 효과적으로 조절할 수 있는 선택적인 조절제의 개발을 위하여는 유사 단백질군 전체의 삼차구조적 정보를 확보하여야 한다.
이러한 종합적인 연구를 위하여는 필연적으로 대규모이면서도 기술집약적인 연구가 필요하다. 이미 미국, 일본의 학계 연구그룹 및 Cellzome, SurroMed 등의 생명공학회사에서 본격적인 시스템생물학 연구를 하고 있으며, Beyond genomics 등 시스템생물학 전문 벤쳐회사들이 속속 탄생하고 있다 (2000년). 또한 1999년에는 시애틀에 시스템생물학연구소가 설립되어 면역체계의 통합적인 연구를 하는 등 시스템생물학 분야의 선도적 경쟁력 확보를 위하여 노력하고 있다. 독일에서는 간세포의 모든 구성성분을 분석하고 통합시스템을 구축하려는 연구를 진행하고 있으며, 2002년 Eli Lilly 는 시스템생물학을 이용한 신약개발 연구에 향후 5년간 $140 million (1,800억원)을 투자하기로 하였다. 미국에서는 NIH를 중심으로 9개의 대용량 구조규명 프로그램이 진행 중이고 (연간 500억원 규모), 일본에서는 이화학연구소를 중심으로 5년간에 약 3천 종류의 단백질의 구조 및 기능을 해석하려는 Protein3000이라는 프로젝트에 연간 5천억원의 연구비를 투자하고 있다.
바이오신약개발에의 응용
전통적인 신약개발에서는 특정 세포기능의 경로에서 중요하게 작용하는 단백질의 조절제를 사용해 왔다. 그러나 세포기능에는 여러 가지 조절경로가 동시에 작용하고 있으며 한 조절경로가 막혔을 때 다른 조절 경로가 이를 극복하기 위해 활성화 되거나 기능이 변화되어 정상상태와 다른 세포의 기능변화를 가져온다. 이러한 세포기능조절 경로의 중복성 내지는 불확실성 때문에 기존의 접근 방법으로 개발된 신약은 효능이 떨어지거나 부작용이 생기는 경우가 많았다. 그러나 세포의 구성성분 및 경로네트웍을 종합적으로 고려하여 그 변화를 시뮬레이션해서 분석하는 시스템생물학적 접근방법을 사용하면 신약표적 단백질 및 조절경로의 효율성을 쉽게 예측할 수 있다.
또한 세포기능조절에 필수적으로 작용하는 kinase, phospatase, protease 등은 비슷한 구조를 가지는 패밀리 단백질들이 다양한 생명현상에 관여하고 있기 때문에, 신약개발의 가능성을 가진 특정 단백질의 구조와 기능을 파악하여 좋은 agonist 나 antagonist를 개발하여도, 다른 네트웍에 관여하고 있는 비슷한 단백질에 영향을 주어 예상치 못한 부작용을 초래하는 경우가 많아, 신약개발의 커다란 장벽으로 작용하고 있다. 따라서 질병특이성과 효능이 높은 신약을 개발하기 위하여는 질병관련 세포기능조절 네트웍과 단백질군에 대한 구조/기능 정보를 통합하여 응용하는 시스템생물학적 접근방법이 매우 중요하다.
최근 보고된 시스템생물학 응용 신약개발의 예로서 2003 년에 공개된 Entolos 사의 천식치료제 표적검증관련 프로젝트, Predix Pharmaceuticals 사의 심장병치료제 개발 프로젝트 등을 들 수 있다. Entolos 사의 프로젝트에서는 질병관련 신호전달 경로, 유전체, 단백질체, 생리적 반응의 데이터 등을 축적한 패키지인 PhysioLab Platform을 사용하여 천식치료 표적으로 예측되어 온 PDE4 단백질의 저해시 천식이 완화되는 것을 증명하고 PDE4 저해제의 집중적인 스크리닝을 디자인하였다. Predix 사의 프로젝트에서는 CardioPrism 이라고 명명한 심장 모델링 시스템을 활용하여 심장병치료 후보약의 버츄얼 스크리닝, 심장독성 측정 등을 수행하고 있다.
그림 2. 시스템생물학을 이용한 질병표적 단백질의 발굴 및 검증
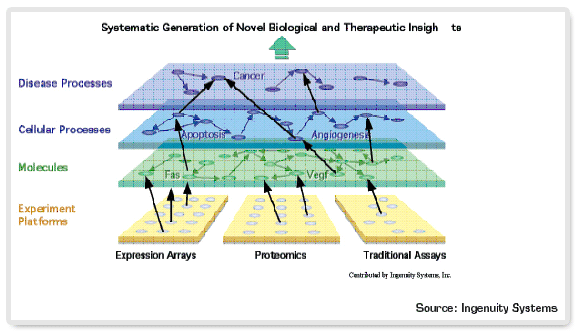
전망
시스템생물학적 접근 방법은 신약 후보물질이나 신약개발 표적 단백질의 발굴 및 검증에 획기적인 발전을 가져올 수 있으므로 선진국의 여러 제약회사에서 이미 적극적으로 도입을 시도하고 있다. 그러나 인간 유전체의 정보가 해독된 지금에도 해독된 유전자 서열이 생리적, 질병 진전과정에 어덯게 서로 연관되고 조절되는지에 대한 정보가 상대적으로 부족한 상태이다. 특히 생명체의 기능을 직접 담당하는 단백질들의 집합체인 단백질체의 기능조절 및 상호작용, 경로네트웍에 대한 전체적인 정보는 생명현상의 시스템적인 분석을 하기에는 너무나 부족한 상태이다. 따라서 앞으로 시스템생물학적 접근 방법을 이용한 생명현상의 총체적인 이해 및 신약개발에의 효과적인 적용을 위하여는 우선 세포의 기능조절을 담당하는 구성성분들의 전체적이고도 정량적인 분석 데이터의 축적이 무엇보다도 중요할 것이다.
시스템생물학 연구에는 이러한 생명현상의 구성성분에 대한 방대한 분석 데이터를 만들어 내는 생화학, 분석화학자 뿐만 아니라, 분석 데이터를 사용하여 시스템을 만들고 시뮬레이션할 수 있는 컴퓨터 과학자, 이를 통하여 얻어지는 가설들을 다시 세포내에서 검증할 수 있는 세포생물학자 등 여러 분야 과학자들의 긴밀한 협력이 필수적이며 이를 통하여 생명현상의 시스템적인 이해가 가능해 질 것이다. 즉 효율적인 시스템 생물학 연구를 위하여는 지금까지 각 분야의 과학자들이 독자적으로 자기 분야를 연구하는 방식을 탈피하여 다학제적인 공동연구의 체제 개발이 필수적이 될 것이며, 이러한 과정을 통하여 비로소 생명현상을 효과적으로 조절하는 방법을 개발하고, 질병에 의해서 비정상적으로 작용하는 세포 및 생명체 시스템을 정상적으로 복원하는 것이 가능해 질 것이다.
참고문헌
Alm, E. and Arkin, P. Biological networks. Curr. Opin. Struct. Biol. 13, 193-202 (2003).
Hanash, S. Disease proteomics. Nature 422, 226-232 (2003).
Ideker, T. et al. Integrated genomic and proteomic analysis of a systematically perturbed metabolic networks. Science 292, 929-934 (2001).
Kitano, H. Perspectives on systems biology. New Generation Computing 199-216, Ohmsha, Ltd. and Springer-Verlag (2000).
McDonald, W.H. and Yates, J.R. 3rd Shotgun proteomics and biomarker discovery. Disease Markers 18, 99-105 (2002).
Winnacker, E.L. Interdisciplinary sciences in the 21th century. Curr. Opin. Biotech. 14, 328-331 (2003).
Wiley, H.S., Shvartsman, S.Y. and Lauffenburer, D.A. Computational modeling of the EGF-receptor system: a paradigm for systems biology. Trends in Cell Biol. 13, 43-50 (2003).
-
다음글
- 시스템생물학의 완성
-
이전글
- 항균 펩타이드 대량생산기술 개발

