기술동향
면역세포 추적을 위한 나노바이오이미징
- 등록일2011-02-07
- 조회수22687
- 분류기술동향
-
자료발간일
2011-02-07
-
출처
생화학분자생물학회 웹진 2월호
- 원문링크
-
키워드
#면역세포#나노바이오이미징
- 첨부파일
면역세포 추적을 위한 나노바이오이미징
배판기, 목혜정, 정봉현
한국생명공학연구원 바이오나노연구센터
서론
항암면역세포치료제의 개발과 더불어 최근에는 여러 영상기법들을 이용한 생체분자 영상 (in vivo molecular imaging)에 관한 많은 연구가 진행되고 있다. 항암면역세포치료제 개발 연구에서 생체내에서 면역세포의 이동경로와 분포에 관한 정보는 면역세포치료요법의 효과 판정에 매우 중요하며, 면역세포를 이용한 치료 시기와 방법을 결정하는 데 있어서 면역세포의 표지 및 추적에 관한 연구가 절대적으로 필요하다. 본 총설에서는 항암면역세포치료제에 관하여 소개하고, 면역세포 추적을 위한 생체영상기술에 대한 연구동향과 면역세포 추적 분자 영상의 예를 기술하고자 한다.
표1. 바이오영상기술의 특성 비교 [1]

본론
2-1. 바이오영상기술
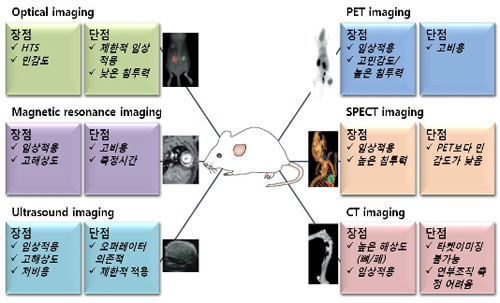
그림 1. 분자영상기법의 특성 [2]
CT, computed tomography; PET, positron-emission tomography; SPECT, single-photon-emission computed tomography.
| 2-1. 항암 면역세포 치료제 |
|
세포치료제 (cell therapy product)는 세포와 조직의 기능을 복원하기 위하여 자가 (autologous), 동종 (allogenic), 혹은 이종 (xenogenic)의 세포를 체외에서 증식, 선별하거나 세포의 생물학적 특성을 변화시키는 일련의 행위를 통하여 치료, 진단, 예방의 목적으로 사용하는 의약품을 말한다. 세포치료제는 사용하는 세포의 종류에 따라 체세포치료제와 줄기세포치료제로 구분된다. 면역세포치료제는 체세포치료제의 한 종류로써 환자의 혈액 속에 존재하는 면역기능을 담당하는 면역세포를 직접 채취하여, 체외에서의 배양을 통해 암세포만을 선택적으로 살해할 수 있는 면역세포의 수를 늘리거나 기능을 강화시킨 후 다시 체내로 주입하여 암을 치료하는 것이다. 면역세포를 활용한 세포치료제는 환자 자신의 면역체계를 이용하여 몸 안에 존재하는 암세포를 제거하고 재발을 방지할 수 있다는 장점을 가지고 있다. 항암면역세포치료제는 정상 세포에 영향을 주지 않고 종양만을 선택적으로 파괴하도록 하는 종양 특이 면역의 유도 및 기능 향상으로 기존의 항암 치료법과는 차별되는 새로운 기능성을 제시한다. 항암면역세포치료제로 사용되는 면역세포는 수지상세포 (dendritic cell, DC), 세포독성 T세포 (Cytotoxic T lymphocyte, CTL), 자연살해세포 (Natural Killer Cell, NK cell)가 있다. 세포성 면역반응을 유도하는 항원제시세포인 수지상세포는 포식작용 (phagocytosis), 세포내 이입 (endocytosis), 또는 흡음작용 (pinocytosis)을 통해 항원을 포획한 후 림프절로 이동하여 MHC (Major Histocompatibility) 분자를 발현하여 수지상세포 표면에 항원을 제시함으로써 암항원 특이적인 T 세포의 활성을 유도하는 역할을 한다. 자연살해세포와 세포독성 T세포는 외부항원을 직접 제거할 수 있는 기능을 가지고 있다. 자연살해세포는 항원특이성 수용체가 없어도 종양세포나 바이러스에 감염된 세포를 인식하는 능력을 가지고 있다. 하지만, 자연살해세포와는 달리 세포독성 T세포는 항원제시세포에 의해 암항원 특이적으로 활성화되어 암세포를 공격하여 제거한다. 암환자의 경우에는 종양세포를 직접적으로 제거할 수 있는 면역세포의 수가 부족하고 면역기능이 저하되어 있다. 따라서, 암세포 특이적 면역반응을 유도하여 암세포만을 공격하여 사멸시킴으로써 기존 항암치료와는 달리 부작용, 무통, 무독성으로서 인체 친화적인 차세대 암치료제이다.
|
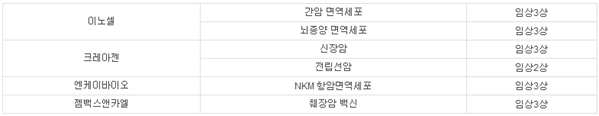
표 2. 국내에서 임상 진행 중인 면역세포치료제
|
2-2. 면역세포의 바이오이미징을 위한 나노바이오소재 |
|
세포내에서 일어나는 여러 분자수준의 변화를 영상화 하는 바이오이미징기술은 의학, 생물학, 화학, 영상의학, 핵의학 등의 융합으로 급속히 발전하고 있으며, 최근에는 나노기술이 접목되어 전세계적으로 가장 활발하게 연구가 진행되고 있다. 연구하고자 하는 생체 대상이 살아있는 상태에서 세포 또는 분자 수준에서 일어나는 현상들을 영상을 통해 직접 확인, 분석할 수 있기 때문에 질병의 조기 진단 및 치료에 있어서 생체분자영상은 매우 중요한 역할을 한다. 최근 나노기술과 영상분야의 융합은 질병의 진단 및 치료를 위한 새로운 분자영상 프로브의 개발을 가능하게 하였다. 나노입자 분자영상 프로브들은 분자영상을 위한 생체 특이성, 생체친화성, 영상기법에 필요한 영상 물질 부여를 위한 화학적 개질 등 나노입자의 특성 조절이 용이하여 다양한 성질의 변화가 가능하다. 현재 생체에 적용되고 있는 대다수 바이오이미징 프로브들은 화학적 개질을 통해 이미징 방법에 적합한 화학물질로 표지되고 있다. 예를 들어, 자기공명영상을 위한 상자성체 (paramagnetic, i.e. Gd (gadolinium)-킬레이트) 조영제와 초상자성체 (super-paramagnetic, i.e. SPIO (superparamagnetic iron oxide), USPIO (ultrasmall superparamagnetic iron oxide), CLIO (cross-linked iron oxide) 조영제, 광학영상을 위한 가시영역과 적외선 영역의 파장대의 형광프로브 (Fluorescent agent, Luciferase), 그리고 양전자 단층 촬영을 위한 방사성 물질이 표지된 프로브 (18F,11C) 등이 있다. 이들 바이오이미징 프로브들은 체내 체류시간이 짧아 빠르게 배출되며, 불안정하고 독성을 가지고 있는 단점을 가지고 있다. 이러한 문제점을 극복하기 위해, 생체친화성 고분자물질을 통해 개조된 바이오이미징 프로브들이 개발되고 있다. 다양한 기능성 생체고분자들을 접합시켜 제조된 이미징 프로브들은 독성이 낮고 혈류에서 오랫동안 머물 수 있어 생체 안정성이 우수하며, 비특이적 결합 (nonspecific interaction)을 줄임으로써 표적성이 향상되었다.
|
| 2-3. 바이오이미징기술을 이용한 면역세포 추적 |
|
면역세포를 이용한 암의 치료과정에서 면역세포의 이동에 관한 정보와 면역세포의 생체내 분포에 대한 정보는 세포치료제의 최적화된 투여경로, 투여량 그리고 투여횟수 및 시기 등을 결정함에 있어서 매우 중요한 요소이다. 분자영상방법을 이용하여 면역세포의 세포치료 과정을 모니터링하는 것이 질병치료 뿐만 아니라 항암면역세포치료제에 개발에 있어서 중요하다. 이러한 면역세포 추적 영상법을 통해 생체에 투여한 면역세포의 이동경로를 영상화 및 정량화 할 수 있고, 표적 조직에서 면역세포의 치료효과를 가름할 수 있으며 효과적인 세포치료을 위한 새로운 기술 개발에 중요한 기능을 담당한다. 또한, 바이오이미징 조영제의 세포내 전달 기술의 향상을 가져온다. 이상적인 면역세포 추적 기술은 세포 독성이 없고 민감도가 높아야 하며, 바이오이미징 프로브들이 표지된 세포내에 오랜 시간동안 유지 되어야 하고, 영상화와 정량화를 동시에 구현할 수 있는 다기능적이면서 어떠한 면역세포에도 높은 효율과 다양한 표지가 가능해야 할 필요성이 있다.
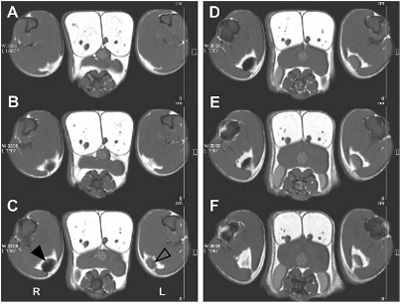
|
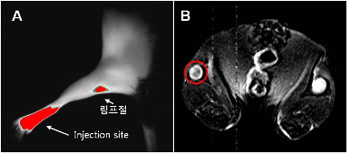
| 그림 2. SPIO 산화철 나노입자를 이용한 수지상세포의 영상기술 [3]. 표지된 수지상세포를 마우스 발바닥 피하에 투여 24시간 후 슬하림프절을 측정한 MRI 이미징이다. |
|
1) 수지상세포 (dendritic cell) 추적
수지상세포 (dendritic cell)를 이용한 암치료는 환자의 혈액에서 수지상세포를 추출 분화해 암특이 항원을 인식하도록 만든 후 다시 환자의 몸에 주입하는 방향으로 개발되고 있다. 암특이 항원을 인식한 수지상세포는 인체에 주입되어 다른 면역세포에 암세포항원을 제시함으로써 암세포를 죽일 수 있는 면역세포 (특히, T세포)를 활성화시킴으로써 결과적으로 인체내 면역세포가 암세포를 공격하게 된다. 수지상 세포를 이용한 기술은 부작용이 적기 때문에 난치병인 암에서의 효과가 인정되면 커다란 시장을 기대할 수 있다. 수지상세포를 이용한 항암치료법은 기존 화학요법제인 항암제가 가졌던 독성문제를 해결하고 다양한 암 종류에 대한 암특이 항원에 대하여 세포반응을 유발할 수 있어 암세포에 특이적이며, 전이 (metastasis)된 암세포까지 치료할 수 있을 것으로 전망된다.
|
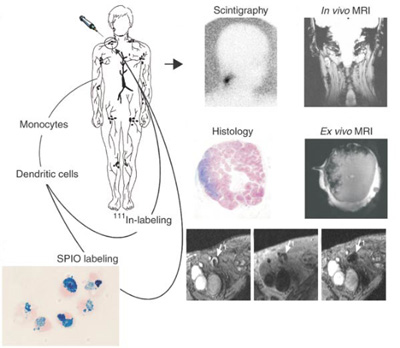
| 그림 3. MRI와 신티그램 촬영법을 이용한 수지상세포의 생체내 추적영상 모식도 및 모니터링 영상 [4]. |
|
최근 자기공명영상기법(MRI)을 이용한 수지상세포 추적연구에서는 산화철 나노 입자 조영제를 면역세포에 표식하여 생체내에서 영상화하였다. 초상자성체 조영제로는 MION (monocrystalline iron oxide nanoparticle), SPIO, USPIO, CLIO 등이 개발되고 있는 데, 이들 고분자조영제들은 인체 내에 오래 머물 수 있으며 임상에서 세포 추적 영상화에 실용화를 진행하고 있다. 표지가 어려운 세포는 세포막투과촉진 물질 (transfection agents), poly-L-lysine, 또는 TAT 펩타이드 등을 이용하여 나노 조영제로 사용하였다. Lutz 그룹에서는 마우스 골수에서 채취한 수지상세포를 SPIO 나노입자와 protamine sulfate와 함께 사용하여 효과적으로 표지하였다 [3]. 마우스의 발바닥 피하에 투여한후 표지된 수지상세포가 가까운 림프절로 이동한 영상과 분포도를 MRI를 이용하여 측정하였다 (그림 2). 또한, de Veris 연구팀에서는 SPIO 나노입자와 111In가 각각 표지된 수지상세포를 흑색종 (melanoma) 환자에 투여한 후 수지상세포의 치료과정을 모니터링하였다 [4]. 이들 표지된 수지상세포는 MRI와 신티그램 촬영법 (scintigraphy)을 통해 같은 위치에서 각각의 영상을 얻을 수 있다 (그림 3). 최근에는 perfluorocarbon 나노입자를 개발하여 19F-MRI를 이용하여 수지상세포 추적영상에 관한 연구가 진행되고 있다. 이들 perfluorocarbon 계열 나노입자 현탁액을 이용하여 세포를 용이하게 표지할 수 있을 뿐만 아니라 Gd 또는 산화철 나노입자를 이용한 1H-MRI에 비해 신호의 손실이 적고, 생체에 존재하지 않는 물질이라 뚜렷한 영상을 얻을 수 있다 [5].
|
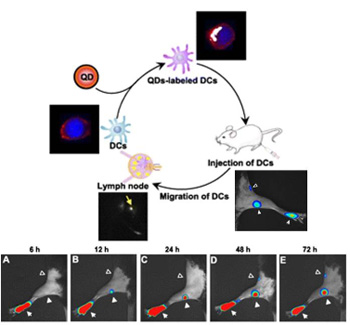
그림 4. 근적외선 형광물질을 이용한 수지상세포의 생체내 추적영상 [].
자연살해세포는 항원특이성 수용체 없이 인체 내에 침투한 각종 바이러스나 암세포를 공격하는 기능을 가지고 있다. 조혈줄기세포로부터 특정 암세포 등을 제거하는 자연살해세포로 분화시켜 암 치료 및 각종 난치병 치료에 활용된다.
1993년 Melder 그룹에서는 [11C]methyl iodide가 표지된 자연살해세포를 이용하여 암 표적을 위해 최초로 시도하였다 [9]. 섬유육종 (fibrosarcoma)를 이식한 마우스에 활성화된 11C-자연살해세포를 주입하여 PET를 통해 암 표적화된 자연살해세포를 측정할 수 있었다. 다른 연구 그룹에서는 FDA 승인 물질인 18FDG로 유전자 조작된 자연살해세포를 표식한 후 마우스에 이식한 유선육종 (breast sarcoma)에서 면역세포가 이동됨을 확인하였다 [10]. PET를 통해 자연살해세포의 이동을 측정할 수 있으나 PET 프로브의 반감기가 짧아서 모니터링에 제한적이다. 광학영상을 이용한 자연살해세포의 추적연구에서는 유전자 조작을 통해 GFP (green fluorescent protein) 또는 Luc (luciferase)를 세포내에서 발현하는 방법과 유/무기 형광시약을 이용하는 방법이 있다. Edinger 연구실에서는 GFP-Luc로 형질 전환된 자연살해세포를 이용하여 오랜 기간 동안 측정하였다. 형질전환된 세포를 림프종 (lymphoma)을 이식한 마우스에 투여시 12일째 암세포가 완전히 제거되고 형광신호가 6 개월 동안 지속됨을 관찰하였다 [11]. 이와 같이, 유전자 조작에 의한 발광신호를 측정하게 되면 세포 증식에 의한 신호가 사라지지 않아서 오랜 기간 측정할 수 있는 장점이 있다. 또한, 근적외선 형광물질이면서 안정성이 높은 DiD, Dio, DiI 등의 물질을 이용하여 전립선암에 대한 자연살해세포의 표적성에 대한 연구가 진행되고 있다 [12]. 마지막으로 산화철 나노입자를 이용하여 HER2/neu를 발현하는 유방암을 인식할 수 있도록 유전자 조작된 자연살해세포를 표식한 후 마우스에 투여 시 암세포에서 자연살해세포가 축적됨을 자기공명영상을 통해 측정하였으며, EpCAM (epithelial cell adhension molecule)을 발현하는 전립선암을 목표로 하는 자연살해세포를 이용 시 암세포에서 관찰되었다 [13]. 자연살해세포 추적을 위해 자기공명영상이 고가이기 때문에 많이 이용되지 않지만, 자연살해세포를 이용한 암세포에 대한 표적과 질병치료 과정을 모니터링할 수 있어서 활용성이 증대될 것으로 예상된다. 또한, 본 연구실에서는 서로 다른 자기공명 주파수를 갖는 4 종류의 perfluorocarbon과 각각 다른 파장을 내는 3종류의 양자점을 나노에멀젼 형태로 제조하였다 (그림 7)[15]. 면역세포치료제로 이용되는 수지상세포, 대식세포, 그리고 T세포를 서로 다른 성질을 나타내는 이들 나노바이오소재를 이용하여 각각 효과적으로 표지할 수 있었으며, 표지된 면역세포들을 마우스 피하에 주입하여 19F-MRI와 광학영상을 통해 면역세포들의 위치를 추적할 수 있었다.
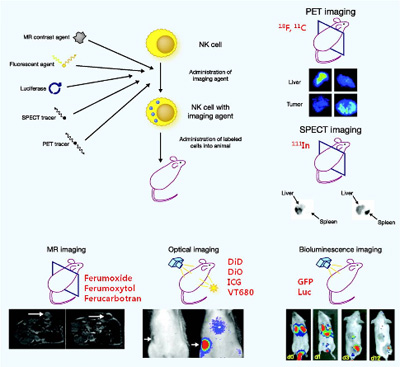
그림 6. 다양한 영상기법을 이용한 자연살해세포의 모니터링 영상 [14].

그림 7. 면역세포의 다중분석을 위한 이중모드 나노에멀젼을 이용한 영상기술 [15].
| 3. 결론 |
|
현재 미국이나 유럽 선진국을 중심으로 나노조영제, 근적외선 형광물질, 분자영상장비 및 영상기술개발에 관한 연구가 진행되고 있다. 바이오이미징기술은 세포/분자 수준의 질병 메카니즘, 진행과정 등을 해석할 수 있는 차세대 핵심 기술로 부각되고 있으며, 이를 성공적으로 수행하기 위해서는 생체 친화적인 프로브 개발, 다양한 이미징을 할 수 있는 장비 및 기술 개발, 질병을 조기진단 할 수 있는 바이오마커의 개발 등 다양한 분야의 발전이 요구된다. 차세대 성장 동력으로서 정부 차원의 막대한 연구비를 집중 투자하고 있는 세포치료제 개발에 있어서 분자영상 기술을 접목 시킬 경우, 세포치료제의 치료 기전, 치료 효과, 및 치료 후의 상태를 계속적으로 검증할 수 있는 도구로써, 새로운 세포치료제의 개발 및 원천 기술의 확보, 더 나아가서는 세포치료제의 활용분야 등에서 다양하게 활용될 수 있는 핵심분야로 자리잡을 것으로 사료된다. 이를 위해 앞으로 면역세포 분자영상 뿐만 아니라 질병의 진단과 치료를 동시에 수행할 수 있는 테그라노시스 (theragnosis)에 대한 연구가 가속화 될 것으로 기대된다.
참고문헌
2011년 Bioin 베스트 동향 선정 및 바이오인 만족도 조사로 인하여 해당 원문을 활용 중입니다. 관련출처 관계자께서는 양해부탁드리며, 설문조사기간 이후에는 해당출처에서 자료를 직접 확인 할 수 있도록 조치하겠습니다.
|
|
|
|
|
-
이전글
- RNAi에 분야에 현실적 문제와 해결책 그리고 향후 전망
-
다음글
- G protein-coupled receptors: novel targets for drug discovery in cancer
지식
동향


 0222.pdf
0222.pdf