출처 : 지능형 바이오시스템 설계 및 합성 연구단
미생물을 이용한 이타콘산 생산 및 동향
한국생명공학연구원 최종현 박사
1. 개요
화석연료의 고갈 및 환경 오염에 대한
관심이 높아지면서, 석유 화학 기반의 원료를 바이오 화학 기반의 원료로 대체하려는 시도가 꾸준하게 이뤄지고 있다. 이러한 원료 물질들 중
이타콘산 (methylene succinic acid)은 석유 화학 유래의 주요한 원재료인 acrylic acid, acetone
cyanohydrin, maleic anhydride 및 sodium tripolyphosphate 대체할 수 있어 2004년에는
Department of Energy's biomass program에서 선정한 가장 가치 있는 12개의 화합물 중 하나로 선정되기도
하였다.
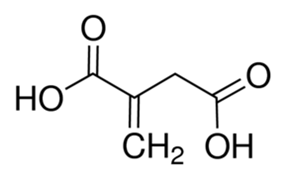
이타콘산은 5개의 탄소를 갖는 dicarboxylic acid로 maleic
anhydride와 유사한 구조를 갖고 있다 (그림 1). 이타콘산은 citric acid의 증류 과정 중 생성되는 것이 최초로 확인되었으며,
그 이후 Aspergillus terreus의 탄수화물 발효과정에서 자연적으로 이타콘산이 생산되는 사실이 밝혀진 이후로, 현재까지 전 세계적으로
활용되는 대부분의 이타콘산은 이 곰팡이의 당 발효를 통하여 생산되고 있다. 그러나 이타콘산의 높은 생산 단가는 시장 확대에 큰 걸림돌로, 생산
단가를 낮추기 위해, 즉 생산량 증대를 위해 발효 조건의 최적화, 대사공학 기술의 적용 및 대체 숙주의 발굴 또는 개발 등의 다양한 방법들이
시도되고 있다. 그럼에도 불구하고 수십 년 동안 이타콘산의 발효 생산 효율은 크게 증가하지 않고 있다. 본 보고서에서는 이타콘산의 생산 효율
증대를 위해 과거에 수행되었던 여러 연구들을 살펴보고 앞으로의 연구 동향에 대해 고찰해 보고자 한다.
그림 1. 이타콘산의 구조
2. 이타콘산의 활용성 및 시장성
이타콘산은 흰색 결정의 unsaturated dicarboxylic acid로 두
개 중 하나의 carboxyl group은 methylene group과 결합되어 있는 분자량 130.1g의 유기산이다(Okabe et al.
2009). 이타콘산은 다양한 폴리머의 합성에 적당한 이중 결합을 갖고 있고 (그림 1), 두 개의 카르복실 그룹은 중합체 형성과정에서 단량체의
함유량을 낮춰 균일한 중합체 합성이 가능해 다양한 분야에서 활용되고 있다 (그림 2)(Okabe et al. 2009; Willke and
Vorlop 2001). 1950년대에는 이타콘산 폴리머의 알칼리 염 또는 황화물의 형태로 세제 또는 샴푸에 활용되었다. 또한 이타콘산의 메틸,
에틸, 바이닐 에스터 형태의 폴리머는 플라스틱, 접착제, 고무와 같은 성질을 갖는 탄성 중합체 및 섬유 접착제로도 이용되었다. 1990년대에
이르러서는 치과, 안과 및 약물 전달 등의 생체 의학 분야로의 적용 범위 확대가 시도되었다. 특히 polyacrylic acid 또는
polyitaconic acid와 같은 카르복실 그룹의 중합으로 제작된 나노 크기의 히드로겔 (hydrogel)은 함유한 화합물을 일정한 농도로
지속적으로 분비시키는 특징을 갖고 있어 약물 전달체로써 높은 활용 가능성을 보였다(De et al. 2004). 이외에도 이타콘산은 glass
ionomer cement (GIC)의 제작을 위해 활용될 수 있다. GIC는 약 30년 전에 소개된 치아 복원을 위한 유용한 부속물이다.
Calcium-aluminosilicate glass 분말과 acrylic acid의 중합체 또는 공중합체로 구성된 GIC는 치아 구조물 또는
뼈대가 되는 금속과의 결합력이 높고, 치아의 에나멜과 양립 가능할 뿐만 아니라 불소의 방출을 통해 만성 염증 등의 원인이 되는 치아 골조직이
붕괴 상태인 카리에스를 억제하는 효과를 갖고 있다. Acrylic acid와 이타콘산의 공 중합체는 Calcium-aluminosilicate
glass 분말과 acrylic acid의 중합체와 동일한 특성을 갖는 GIC의 제작이 가능하다. 이 공중합체는 이타콘산이 활용된 제품들 중
의료분야에서 시장성이 확보된 최초의 접착제이기도 하다.
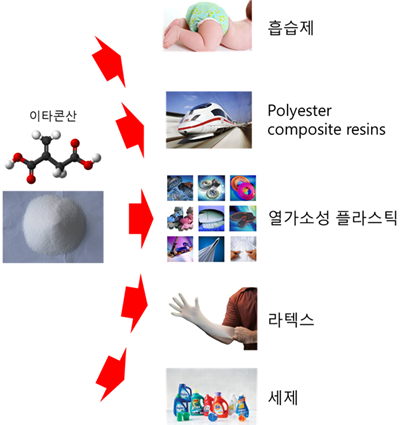
그림 2. 이타콘산의 활용성
이타콘산은 과거에는 중국을 포함한 Pfizer Food science, Iwata
chemical, Rhodia 등의 미국, 일본 및 프랑스 위치한 공장에서 생산이 되었었으나 현재는 대부분이 중국에서 생산되고 있다. 2011년
기준 시장규모는 약 7천 450만 달러로, 전 세계적으로 약 4만1400톤가량 거래되었으며 대부분 SBR latex 생산에 활용되고 있다. 앞서
설명한 것과 달리 다양한 활용 가능성을 갖는 이타콘산이지만, 현재는 특정 범위에 한정되어 활용되고 있는데, 그 원인은 이타콘산의 높은 생산
비용이다. 이타콘산의 판매 가격은 시장에 공급되는 양과 순도에 따라 차이가 있으나, 대략 1.5~2$/kg의 가격대를 형성하고 있다. 이는
원재료로 활용되는 glucose, citrate 및 succinate 등과 비교하면 1.5배가량 높은 가격일 뿐만 아니라, 이타콘산의 시장
확대를 위해 대체해야 할 acrylic acid, acetone cyanohydrin, maleic anhydride 및 sodium
tripolyphosphate 등과 비교해서도 가격이 높다. 석유 화학 기반의 원료 물질인 Acrylic acid, acetone
cyanohydrin, maleic anhydride 및 sodium tripolyphosphate을 이타콘산으로 대체할 경우, 예측 거래량은
16만톤을 넘고 시장규모는 111억 달러까지 확장이 가능하다. 또한 최근 환경오염 문제 및 지속가능한 성장 등에 관심이 높아지는 현재의 시류를
고려한다면 이타콘산의 시장성 확대 가능성은 매우 높다. 이에 따라 최근에도 이타콘산의 생산 단가를 낮추기 위해 발효를 위한 탄소원 대체, 발효
조건 조절 및 정제 과정 개량 등이 꾸준하게 시도되고 있다. 그럼에도 불구하고 이타콘산을 생산하는 균주는 여전히 A. terreus이며 생산량
역시 80g/L 부근에서 크게 증가하지 못하고 있다(Kuenz et al. 2012).
3. 이타콘산의 생산
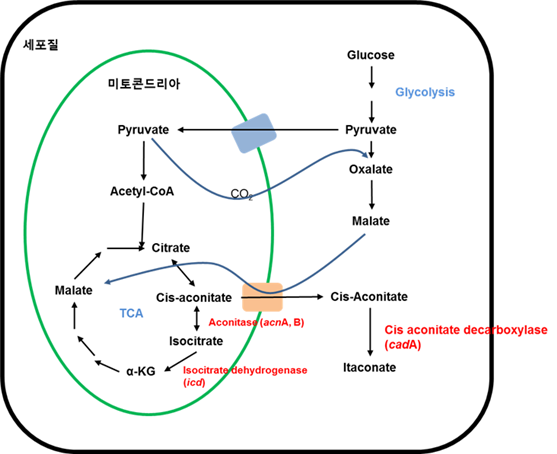
A. Terreus의
이타콘산 생합성 경로는 1957년에 Bentley 와 Thiessen에 의해 제안되었다. Citric acid cycle의 첫 번째 단계에서,
citrate가 aconitase에 의해 cis-aconitate로 전환되면, cis-aconitate를 cis-aconitate
decarboxylase (CadA)가 이타콘산으로 전환한다. 이 경로는 이 후 탄소의 동의 원소를 이용하여 확인되었다 (Bonnarme et
al. 1995). 그러나 CadA는 세포질에 존재하는 단백질로 미토콘드리아에서 일어나는 TCA cycle의 중간 산물인
cis-aconitate가 이타콘산으로 전환되기 위해서는 세포질로의 이동이 필요하다 (그림 3). 그러나 cis-aconitate의 이동이
malate-citrate antiporter를 통해 이뤄질 것이라는 가설만 존재할 뿐, 현재까지 어떻게 이동되는 정확하게 밝혀지지 않고 있다
(Jaklitsch et al. 1991). A. terreus 외에 U. zeae, U. maydis (Haskins et al. 1955),
Candida sp (Tabuchi et al. 1981) 및 Rhodotorula sp. (Kawamura et al., 1981)의
미생물들도 자연적으로 이타콘산을 생산하는 것으로 확인되고 있으나, 이들이 이타콘산을 생산하는 방법은 A. terreus와 동일하게 CadA를
통한 경로가 이용될 것이라 예상되고 있다. 최근에는 macrophage-derived cell에서도 이타콘산이 생산되며, CadA 단백질의
활성을 갖는 것이 확인 되었으나 CadA를 암호화 하는 유전자는 밝혀지지 않았다.
비록 이타콘산이 왜 동물 세포 내에서 생산되는지 그 이유가 정확하게 밝혀지진
않았으나, 이타콘산이 glyoxylate shunt에 주요 효소인 isocitrate lyase의 활성을 저해하는 사실로부터 유추하였을 때,
macrophage-derived cell이 이타콘산을 항 박테리아 물질로 활용하기 위해 생산할 것이라 예상하고 있다. 이와 더불어 이타콘산은
fructose-6-phophate 2-kinase를 저해할 수 있어 중심 탄소 대사에 직접적인 영향을 미칠 수 있으며, glyoxylate
shunt의 저해와의 조합을 통해 내장 지방 축적을 감소시킬 수 있음이 쥐를 대상으로한 실험에서 확인되기도 하였다(Sakai et al.
2004).
A. terreus에서 이타콘산 생합성의 필수 효소인 CadA는 490개의
아미노산을 갖는 55 kDa 크기의 단백질로, MmgE/PrpD family의 2-methylcitrate dehydratase와 높은 서열
유사성을 갖는다. CadA의 최적 pH는 6.2로 2.45 mM (37 ℃, pH6.2)의 Km 값을 가지며, pH 7.5에서도 활성을 가지나
최적 활성과 비교해 약 20%가 감소되는 것이 확인되었다. CadA가 이타콘산 생산에 필수 효소라는 사실은 A. terreus NRRL1960을
다양한 pH 및 산소 포화도 하에서 회분 배양을 하며 채취한 시료의 전사체 분석을 통해(Li et al. 2011), 전사체 분석 과정에서
이타콘산의 생산량이 높은 조건에서 CadA의 전사체의 전사량이 높아지는 결과로 확인하였다. CadA 전사체의 전사량 증가와 더불어
putative Major Facilitator Superfamily에 속하는 transporter를 암호화 하는 전사체의 양도 증가하는 것이
관찰되었다. 이 transporter가 앞서 언급한 것처럼 이타콘산의 전구체를 미토콘드리아에서 세포질로의 이동과 관련이 있는지는 명확하지 않으나
이타콘산 생산에 영향을 미치는 것이 확인되었다. 이타콘산의 생산량과 CadA 전사량의 증가의 인과관계는 CadA의 안정성이 in vitro에서
높지 않다는 사실과 CadA의 전사량을 높였을 때 이타콘산 생산량이 증가한 실험을 통해 다시 한 번 검증되었다(Kanamasa et al.
2008).
그림 3. A. terreus의 이타콘산
합성경로
현재 산업적으로 생산되는 이타콘산은 약 80 g/L로 상당한 양이지만, citric
acid가 200 g/L가 생산되는 점을 감안 할 때 충분하지 못한 생산량이다. 또한 이론적으로 A. terreus를 이용해 생산가능한
이타콘산의 양이 240 g/L임을 감안 한다면 현재의 생산량은 턱없이 낮아 이타콘산의 생산량 증대를 위한 다양한 대사 공학적 연구들이 수행되고
있다.
A. terreus에서 이타콘산의 생산 증대를 위한 개량은 전구체인
citrate를 생산하는 해당과정에 영향을 받을 것이라는 예상에서부터 시작되었다. 특히 해당과정에서 citrate와 ATP에 의해 활성이
저해되는 phosphofructo-1-kinsae (pfkA)가 이타콘산 생산에 큰 영향을 미칠 수 있을 것이다. 이에 근거하여 citrate의
과생산 곰팡이인 A. niger에서 citrate와 ATP에 의한 활성 저해가 감소된 truncated version의
phosphofructo-1-kinsae (pfkA)의 유전자를 A. terreus에 도입해 이타콘산 생산이 증대되는 결과를 얻을 수
있었다(Capuder et al. 2009). 이와 달리 TCA cycle이 호기 조건에서 원활하게 작동한다는 사실에 근거해
Vitreoscilla부터 유래한 hemoglobin 유전자를 A. terreus에 도입함으로서 이타콘산의 생산성을 증대한 예도 있다 (Lin
et al. 2004). 그러나 A. terreus 경우 대사 공학적 기술의 적용을 위한 기본적인 정보들이 아직까지는 부족하다. 이러한 점을
우회하기 위해 유기산인 citrate 과생산에 활용되고 있는 A, niger 에 CadA 유전자 도입해 이타콘산 생산 숙주로의 개량이 시도되기도
하였으나, 이타콘산의 생산량은 0.7 g/L 로 매우 낮았다.
A. terreus를 숙주로 이타콘산 생산량 증대를 위한 시도에 걸림돌은
대사 공학의 적용을 위한 기본 정보의 부족만이 아니다. 일 예로, 이 곰팡이의 생리학적 특성 또한 이타콘산 생산 증대에 장해물이 될 수 있다.
앞서 언급한 것처럼 이타콘산의 생산량은 산소의 공급에 영향을 크게 받는 것을 확인할 수 있는데, filamentous growth를 하는 A.
terreus의 생태학적인 특성은 원활한 교반을 할 수 없게 하며, 이타콘산 생산 수율의 재현성 감소에 원인이 된다. A. terreus가 갖는
이러한 단점들을 극복하고자, 발효 공정이 쉽고 숙주에 개량이 용이한 효모 및 대장균을 이타콘산 생산 숙주로 전환하고자 하는 실험이 최근에
수행되고 있다.
Saccharomycess cerevisiae를 이타콘산 생산 숙주로
전환하고자, in silico modeling을 통해 ade3, bna2 및 tes1 유전자의 knockout과 CadA 의 과발현 및 고농도
배양을 수행하여 168 mg/L를 생산한 예가 있다 (Blazeck et al. 2014). 또한 CadA가 이종 숙주에서 불용성 응집체로
발현되는 것을 막기 위해 낮은 온도 배양 과 발효 과정 중 부산물로 생산되는 lactate와 acetate의 생산량 감소를 위한 lactate
dehydrogenase 와 phosphate acetyltransferase를 암호화하는 유전자의 knockout 을 통해 대장균에서 690
mg/L의 생산성을 달성하기도 하였다 (Vuoristo et al. 2015). 최근에는 이타콘산의 전구체인 citrate가 aconitase에
의해 isocitrate로 전환된 후 isocitate dehydrogenase (icd)에의해 α-ketoglutarate로 전환되는 것을
막기 위해 icd 를 knockout 시킨 auxotroph에 acontase를 암호화하는 acnB 와 CadA의 과발현을 통해 105 시간동안
4.34 g/L 의 이타콘산을 생산하기도 하였다. 비록 이 실험에서 보여준 이타콘산의 생산성은 기존 보고들에 비해 월등하게 높으나,
glutamate를 추가적인 공급이 필요한 점, 소모된 탄소원 (30 g/L) 대비 낮은 이타콘산 전환률 (약 14%), 끝으로 A.
terreus를 숙주로 이용한 경우와 비교하여 극히 낮은 생산성은 아직도 해결해야 할 문제이다 (Okamoto et al.
2014).
4. 고찰
비록 최근 유가 하락과 에너지 재
활용률의 증가로 화석 연료 기반의 화학 산업이, 과거 예상한 것처럼 바이오 화학 산업으로 빠르게 대체되지 않을 것이다. 그럼에도 불구하고 환경
오염 및 제한 적인 자원에 대한 불안함은 여전할 것이다. 또한 이타콘산은 석유 화학 기반 제품을 바이오 화학 기반으로 생산하려는 여타 물질들과
다르게, 세계적으로 소모되는 양의 대부분이 이미 바이오 화학을 기반으로 생산되고 있다. 따라서 이타콘산의 생산 단가에 대한 문제가 개선될 경우
생산 공정의 전환에 따른 추가적인 비용 없이 빠르게 시장 규모를 늘릴 수 있을 것이다. 그러나 A. terreus를 숙주로 활용한 생산 수율 및
생산량은 수 십년 동안 크게 개선되지 않고 있는 점과 이를 극복하기 위해 대사 공학 적용이 용이한 미생물들을 이타콘산 생산 숙주로 전화하려는
시도가 꾸준하게 이뤄지고 있으나 기존의 공정을 뛰어 넘는 생산성을 얻은 결과는 없다는 점 등은 앞으로 해결해야 한다. 그러나 유전체 분석,
대사회로 분석 데이터 축적 및 새롭게 개발되고 있는 유전자 조작 관련 도구들을 고려할 때, A terreus 또는 비 자연적 이타콘산 숙주의
개량은 예상 보다 빠르게 이뤄질 수 있을 것이다.
참고문헌
1. Blazeck J, Miller
J, Pan A, Gengler J, Holden C, Jamoussi M, Alper H. 2014. Metabolic engineering
of Saccharomyces cerevisiae for itaconic acid production. Applied Microbiology
and Biotechnology 98(19):8155-8164.
2. Bonnarme P, Gillet B, Sepulchre AM,
Role C, Beloeil JC, Ducrocq C. 1995. Itaconate biosynthesis in Aspergillus
terreus. J Bacteriol 177(12):3573-8.
3. Capuder M, Solar T, Bencina M, Legisa
M. 2009. Highly active, citrate inhibition resistant form of Aspergillus niger
6-phosphofructo-1-kinase encoded by a modified pfkA gene. J Biotechnol
144(1):51-7.
4. De TK, Bergey EJ, Chung SJ, Rodman DJ, Bharali DJ, Prasad PN.
2004. Polycarboxylic acid nanoparticles for ophthalmic drug delivery: an ex vivo
evaluation with human cornea. J Microencapsul 21(8):841-55.
5. Haskins RH,
Thorn JA, Boothroyd B. 1955. Biochemistry of the Ustilaginales. XI. Metabolic
products of Ustilago zeae in submerged culture. Can J Microbiol
1(9):749-56.
6. Jaklitsch WM, Kubicek CP, Scrutton MC. 1991. The subcellular
organization of itaconate biosynthesis in Aspergillus terreus. Journal of
General Microbiology 137(3):533-539.
7. Kanamasa S, Dwiarti L, Okabe M, Park
EY. 2008. Cloning and functional characterization of the cis-aconitic acid
decarboxylase (CAD) gene from Aspergillus terreus. Applied Microbiology and
Biotechnology 80(2):223-9.
8. Kuenz A, Gallenmuller Y, Willke T, Vorlop KD.
2012. Microbial production of itaconic acid: developing a stable platform for
high product concentrations. Applied Microbiology and Biotechnology
96(5):1209-16.
9. Li A, van Luijk N, ter Beek M, Caspers M, Punt P, van der
Werf M. 2011. A clone-based tranomics approach for the identification of
genes relevant for itaconic acid production in Aspergillus. Fungal Genet Biol
48(6):602-11.
10. Lin YH, Li YF, Huang MC, Tsai YC. 2004. Intracellular
expression of Vitreoscilla hemoglobin in Aspergillus terreus to alleviate the
effect of a short break in aeration during culture. Biotechnol Lett
26(13):1067-72.
11. Okabe M, Lies D, Kanamasa S, Park EY. 2009.
Biotechnological production of itaconic acid and its biosynthesis in Aspergillus
terreus. Applied Microbiology and Biotechnology 84(4):597-606.
12. Okamoto S,
Chin T, Hiratsuka K, Aso Y, Tanaka Y, Takahashi T, Ohara H. 2014. Production of
itaconic acid using metabolically engineered Escherichia
coli. The Journal of General and Applied Microbiology
60(5):191-197.
13. Sakai A, Kusumoto A, Kiso Y, Furuya E. 2004. Itaconate
reduces visceral fat by inhibiting fructose 2,6-bisphosphate synthesis in rat
liver. Nutrition 20(11-12):997-1002.
14. Tabuchi T, Sugisawa T, Ishidori T,
Nakahara T, Sugiyama J. 1981. Itaconic Acid Fermentation by a Yeast Belonging to
the Genus Candida. Agricultural and Biological Chemistry
45(2):475-479.
15. Vuoristo KS, Mars AE, Sangra JV, Springer J, Eggink G,
Sanders JP, Weusthuis RA. 2015. Metabolic engineering of itaconate production in
Escherichia coli. Applied Microbiology and Biotechnology 99(1):221-8.
16.
Willke T, Vorlop KD. 2001. Biotechnological production of itaconic acid. Applied
Microbiology and Biotechnology 56(3-4):289-95.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.




 미생물을 이용한 이타콘산 생산 및 동향_최종현 박사.pdf
미생물을 이용한 이타콘산 생산 및 동향_최종현 박사.pdf