기술동향
RNA 구조 기반 세포내 온도감응센서
- 등록일2015-08-25
- 조회수6537
- 분류기술동향
-
자료발간일
2015-08-21
-
출처
지능형 바이오시스템 설계및합성 연구단
- 원문링크
-
키워드
#온도감응센서#RNA#ncRNA#mRNA#UTR
- 첨부파일
출처 : 지능형 바이오시스템 설계및합성 연구단
RNA 구조 기반 세포내 온도감응센서
한국과학기술원 화학과 이영훈 교수
1. 개요
mRNA와는 달리 단백질로 번역되지 않는 ncRNA는 세포내 다양한 대사과정을 조절하는 인자로 알려져 있다. 대표적인 ncRNA로는 리보솜의 일부분을 이루는 rRNA, 특정 mRNA의 발현과 안정성을 조절하는 sRNA 등이 알려져 있다. 하지만 mRNA에 자체에도 ncRNA의 특성이 일부 보존되어 있는 경우가 있다. mRNA는 암호화 염기서열을 가지고 있어 ncRNA라 부르지 않지만 번역되지 않는 영역인 5' 및 3' UTR (untranslated region)이 존재한다. mRNA의 UTR에는 sRNA와 결합하는 염기서열, Shine-Dalgano 염기서열, RNA 가수분해효소 절단 염기서열 등 mRNA의 발현과 안정성을 조절하기 위한 부가요소들이 있다. 또한 mRNA의 UTR은 독특한 이차구조를 형성하여 위에 언급한 염기서열들을 각각에 해당하는 인자들로 부터 영향을 받지 않도록 하기도 한다.
UTR 영역의 이러한 특성들은 RNA 이차구조의 변화에 의해서 조절되는데, RNA 이차구조에 영향을 주는 인자들 중 비생물적 인자로 온도변화를 꼽을 수 있다. 온도가 이상적인 생장조건에서 벗어날 때 세포는 스트레스를 받게 되고, 이를 극복하기 위하여 온도 스트레스 관련 특정 유전자들을 발현 혹은 억제한다. 이 경우 특정 유전자들의 발현은 mRNA UTR 영역의 이차구조가 온도에 따라 변화됨으로써 조절될 수 있다. 이러한 특성의 RNA 분자들을 RNA 온도센서 혹은 RNA 온도계라 부른다. 온도에 따라 변화되는 UTR 이차구조는 대장균의 rpoH 유전자, Synechocystis sp. PCC6803의 hsp17 유전자, Salmonella 종의 fourU 구조 등에서 발견된다.
hsp17 mRNA의 5' UTR에 존재하는 RNA 온도센서는 44개 누클레오티드로 이루어져 있는 비교적 간단한 구조를 가지고 있다 (그림 1). 이러한 hsp17 mRNA의 온도유도성 RNA 온도 센서는 2011년 Kortmann 등과 2015년 Wagner 등의 연구를 통하여 자세히 조사되었다 [1, 2]. Hsp17은 열충격 단백질로 평소에는 mRNA UTR 영역의 줄기 구조가 견고하게 형성되어 있어 Shine-Dalgarno 염기서열과 시작 코돈이 가려져 있는데, 열충격 조건에서는 온도가 올라가면서 5' UTR의 이차구조가 풀리면 리보솜이 결합할 수 있어 Hsp17의 번역이 개시될 수 있다. 이는 hsp17 유전자는 필요한 상황에서만 번역이 일어나도록 히는 조절 장치를 가지고 있다는 것을 의미한다. 온도를 감지하는 hsp17 mRNA의 UTR의 특성을 연구하기 위해 Kortman 등은 UTR에 몇 가지 돌연변이를 도입하여 온도를 감지하는 기능에 변화를 주었다. 인위적으로 UTR에 돌연변이를 도입하여 제작한 RNA 온도센서는 기존의 RNA 온도센서와 달리 항상 번역을 허용하거나 반대로 항상 번역을 억제하는 특성을 가지고 있다 (그림 1). 이러한 발견은 세포내에 이미 존재하는 RNA 온도센서 요소에 몇 가지 조작을 가해주면 원하는 특성을 가진 RNA 온도센서를 개발할 수 있는 가능성을 보여주는 것이다.

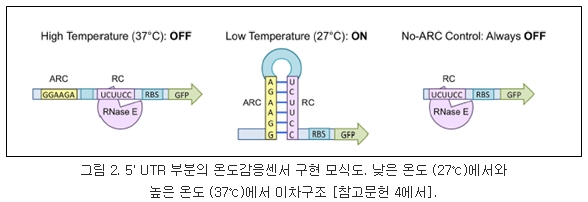
위와는 다른 접근 방법으로 RNA 온도센서가 작동하는 온도를 미리 예측하여 UTR을 디자인하려는 연구도 수행되었다. 2013년 Chursov 등은 RNA 온도센서의 염기서열에 따라 설정 온도에서 구조가 어떻게 변하는지에 대한 정보를 알 수 있는 프로그램을 구축하였다 [3]. 또한 2015년, Hoynes-O’'Connor 등은 처음부터 RNA 온도센서를 디자인하여 목표로 하는 유전자 앞에 삽입, 번역정도를 온도로 조절할 수 있는 시스템을 구축하였다 [4] (그림 2). 이 경우 UTR 영역에 RNase E에 의해 인지되어 mRNA 분해로 이어지는 염기서열 (RC), RC에 상보적으로 결합하여 줄기-고리 구조를 이룰 수 있게 하는 anti-RC (ARC), 마지막으로 리보솜 결합염기서열을 삽입하여 번역이 일어날 수 있도록 하였다. 37℃의 높은 온도에서는 UTR의 이차구조가 풀려 RNase E가 RC를 인지하고 mRNA 분해를 일어나게 함으로써 GFP가 발현되지 않게 하였다. 반대로 27℃의 낮은 온도에서는 줄기-고리 구조가 비교적 견고하게 형성될 수 있도록 하여 mRNA가 분해되지 않고 정상적으로 GFP가 번역되게 하였다. 이 연구가 Kortmann 등 [1]과 2015년 Wagner 등 [2]의 연구와 다른 점은 이미 세포내에 존재하는 RNA 온도센서에 변화를 준 것이 아니고 처음부터 인공적인 UTR구조를 예측하여 디자인 했다는 것이다.
위에서 소개한 일련의 연구들을 통하여 기존에 알려진 ncRNA와 mRNA UTR의 특성을 결합하여 mRNA 자체에서 발현을 조절할 수 있는 RNA 온도센서의 특성을 분석하고 새로운 개념의 RNA 온도센서를 구축할 수 있다는 것을 알 수 있다. 이와 같은 연구들은 ncRNA를 통한 세포내 대사조절이 단순한 mRNA와의 상보적인 결합을 넘어 온도변화와 같은 비생물적 변화를 통해서도 유도될 수 있다는 점을 시사해 준다.
참고문헌
1. Jens Kortmann, Simon Sczodrok, Jorg Rinnenthal, Harald Schwalbe and Franz Narberhaus (2011) Translation on demand by a simple RNA-based thermosensor. Nucleic Acids Res., 39, 2855?2868
2. Dominic Wagner, Jorg Rinnenthal, Franz Narberhaus and Harald Schwalbe (2015) Mechanistic insights into temperature-dependent regulation of the simple cyanobacterial hsp17 RNA thermometer at base-pair resolution. Nucleic Acids Res., 43, 5572?.5585
3. Andrey Chursov, Sebastian J. Kopetzky, Gennady Bocharov, Dmitrij Frishman, and
Alexander Shneider (2013) RNAtips: Analysis of temperature-induced s of RNA secondary structure. Nucleic Acids Res., 43, W486?.W491
4. Allison Hoynes-O’'Connor, Kristina Hinman, Lukas Kirchner and Tae Seok Moon (2015) De novo design of heat-repressible RNA thermosensors in E. coli. Nucleic Acids Res., doi: 10.1093/nar/gkv499.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향


 RNA 구조 기반 세포내 온도감응센서_이영훈 교수-1.pdf
RNA 구조 기반 세포내 온도감응센서_이영훈 교수-1.pdf