기술동향
자가 소비: Autophagy(자기 소모, 자식 작용)와 Apoptosis(세포소멸)의 상호작용
- 등록일2015-12-30
- 조회수21114
- 분류기술동향
-
자료발간일
2015-12-29
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#세포소멸#자식작용#자가소비#Autophagy#Apoptosis
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
자가 소비: Autophagy(자기 소모, 자식 작용)와 Apoptosis(세포소멸)의 상호작용
본 자료는 Self-consumption: The interplay of autophagy and apoptosis. Nat Rev Mol cell Biol. 2014; 15(2): 81-94 의 논문을 한글로 번역, 요약한 자료입니다.
목차
1. 서론
2. Autophagy가 apoptosis에 선행한다.
3. Autophagy에 의한 apoptosis의 억제
4. Apoptosis의 의한 autophagy의 억제
5. Autophagy가apoptosis을 활성화한다.
6. Intercellular crosstalk
7. 결론
1. 서론
자가 파괴 작용에는 autophagy와 apoptosis가 있는데 세포질 기관의 전환 혹은 전체 세포의 전환에 따라 결정된다. Autophagy와 apoptosis는 많은 병리학적 과정에 영향을 미치며 이 현상은 서로 영향을 끼친다.
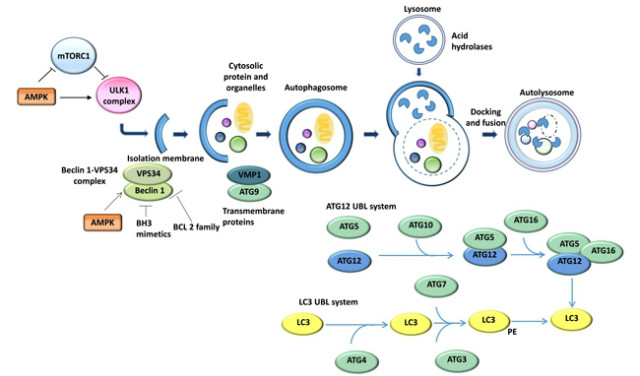
BOX 1. autophagy 경로는 phagophore 라 불리는 분리된 막의 형성으로부터 시작된다.
세포막을 비롯한 세포 내 다양한 소기관으로부터 분리된 막 근원이 자식포(autophagosome)을 형성한다. mTOR complex1은 autophagy를 억제하는 기능을 하고, ULK1 (UNC 51 like kinase 1)?FIP200 (FAK family kinase-interacting protein of 200 kDa)?ATG13?ATG101 complex과 같은 다양한 분자구성물질의 활성으로 autophagy가 시작된다. vacuolar protein sorting 34 (VPS34)?Beclin 1 complex는 BCL 2 family로 부터 항 세포자멸 단백질에 의해 비활성 상태로 있다가 활성상태가 되면 분리된 막이 nucleation된다. ATG9 과 vacuole membrane protein 1 (VMP1)는 Golgi, endosomes, autophagosomes 사이에서 재사용된다. 자식포를 형성 하기 위해 분리된 막이 확장되는 과정에는 두가지 ATG12 UBL system과 LC3 system의 ubiquitin-like (UBL) protein conjugation systems 이 존재한다.
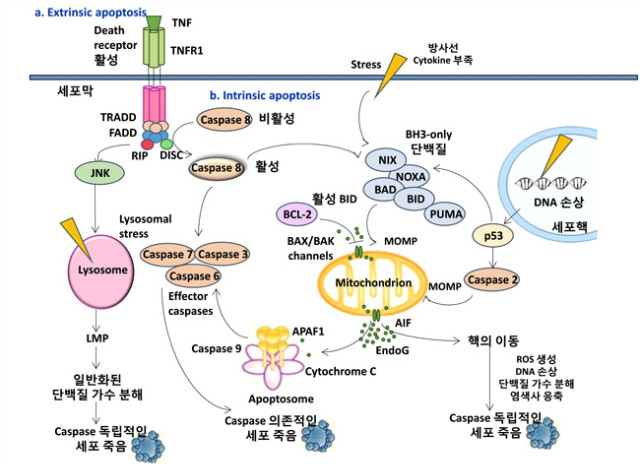
BOX 2. Extrinsic apoptosis. CD95, TNFR1, TRAILR 와 같은 death receptors에 ligands이 붙으면서 일어나는 반응이다. 이렇게 결합하면 FADD, TNFR1 associated death domain (TRADD), 카스파제 8를 불러들인다. 활성화된 카스파제8은 하단 반응 카스파제들을 활성화 시키거나 BH3 (BCL 2 homology 3)-only protein BID (BH3 interacting domain death agonist) 의 길이를 짧게 하여 intrinsic apoptosis을 활성화 시킨다.
Intrinsic apoptosis. 미토콘드리아 외막 투과 (MOMP)는 미토콘드리아의 막 사이 공간으로부터 cytochrome c 을 세포질로 방출을 일으킨다. 세포질에 있는 cytochrome c는 카스파제9과 apoptotic protease-activating factor 1 (APAF1; the apoptosome)사이에서 카스파제 활성 복합체를 만든다. 그리고 BH3 only proteins의 활성으로 MOMP는 일어난다. 따라서 MOMP로 인해 미토콘드리아의 막 사이공간로부터 soluble proteins을 자유롭게하는 초분자 채널을 형성한다. DNA 손상은 p53에 의해 apoptosis를 일으키는 단백질을 변형활성하고 카스파제 2를 활성화한다. 카스파제 2은 MOMP을 유도하고 다른 카스파제들을 활성화한다. MOMP의 결과로 방출되는 미토콘드리아의 단백질 사이에 apoptosis-inducing factor (AIF) 와 endonuclease G (EndoG)는 카스파제와 관련없이 독립적으로 세포의 죽음을 촉진할 수 있다. Cathepsins 역시 MOMP을 작동시켜 intrinsic apoptotic pathway을 자극한다.
Macroautophagy는 이중막 소낭(자식포) 안에서 세포질부분의 격리, 분리로부터 일어나고, 이는 리소좀과 결합하여 자가 라이소좀을 형성한다. 이 안에서 자가 소화 작용의 cargo는 분해된다. 이 이화작용은 다수의 autophagy와 autophagy 관련된 단백질에 의해 가능하게 된다. 이화작용은 우선적으로 부족한 영양 요소에 반응한 세포 내 적응 기작으로 생각된다. Autophagy의 첫 번째 단계로는 자식포의 형성이므로 autophagy의 활성은 주로 자식포의 축적으로 가늠한다. 그러나 자식포의 축적은 형성의 비율이 증가될 때와 자식포가 리소좀과 합쳐지는 과정이 막힘으로 자식포가 제거되는 비율이 감소될 때 역시 가능할 수 있다. 따라서 주의 깊게 autpophagy는 관찰되어야 한다. Apoptosis는 프로그램화 된 세포사멸의 여러 타입 중 하나로 핵의 응축 또는 파열, 세포막 기포와 같은 형태적 변화가 일어난다. 이것은 고사체의 형성을 이끈다. Apoptosis는 미토콘드리아 외막 투과[mitochondrial outer membrane permeabilization (MOMP)], caspase3,6,7의 활성, 대부분의 세포 내 거대분자를 분해하는 이화 가수 분해 효소의 활성과 같은 생화학적 변화를 일으킨다. Autophagy와 apoptosis는 종종 같은 세포 안에서 일어나기도 하지만 보통 autophagy가 apoptosis 보다 먼저 일어난다. 이는 특히 스트레스의 정도가 죽음을 초래할 정도의 치명적이지 않다면 자가 소화 작용 반응을 일으키고, 극심한 상태가 지속되거나 강렬한 역치(한계치)에 도달할 때 세포고사 혹은 apopatosis가 아닌 세포 죽음 프로그램을 활성화 한다. 이는 스트레스에 적응하거나 대처하기 위한 전략으로 여겨지다. 그럼에도 불구하고, 세포의 apoptosis가 시작되면 필수적인 autophagy 단백질이 카스파제에 의해 잘려지기 때문에 autophagy는 비활성화 된다. 그러나 특정한 상황에서 자가 소화 작용 반응에 수반되는 autophagy에 필수적인 단백질이 세포의 필수적 부분을 이화시킴으로써 세포고사나 괴저성 프로그램의 활성을 촉진함으로써 세포의 죽음을 초래한다.
이 리뷰에선 autophagy와 apoptosis 사이의 복잡한 관계에 대해 건강한 상태와 질병에서의 동물 세포의 마지막 숙명을 결정지을 수 있는 신호전달 교차에 중점을 두어 토론해보고자 한다.
2. Autophagy가 apoptosis에 선행한다.
세포죽음을 일으키는 많은 자극은 궁극적으로 autophagy를 유발한다. 이 autophagy는 apoptosis가 세포를 분해하기 전에 일어난다. Apoptosis가 약화되어 있을 때 예를 들어 BCL-2-associated X protein (BAX), BCL-2 antagonist or killer (BAK)와 같은 apoptosis를 일으키는 단백질이 제거되거나 카스파제 억제제를 첨가함으로써 autophagy는 더 유도된다. Autophagy는 스트레스에 적응하기 위해 반응한 급격한 전리 방사선, 화학 요법의 항암 물질, 성장인자 수용기의 억제 혹은 필수 영양분의 결핍과 같은 다양한 외부 신호에 반응한 세포죽음 경로의 활성에 의해 유도된다.
The p53 protein
p53은 DNA 손상, 국소 빈혈 재관류, 영양분 스트레스와 같은 스트레스에 의해 활성화되는 신호전달 완성물로 기능을 한다. p53은 세포질에 존재하다가 DNA에 손상이오면 스트레스에 활성화 되는 키나아제에 의해 인산화가 일어나면서 핵으로 이동한다. 세포질에 존재하는 p53은 autophagy protein FIP200 (FAK family kinase-interacting protein of 200 kDa; Atg17 in yeast)와 결합해서 autophagy를 억제한다. 따라서 ULK1 (UNC-51-like kinase 1)?FIP200?ATG13? ATG101 complex의 활성을 막고 자식포 형성을 억제한다. 더욱이 세포 내 스트레스 상황에서는 세포질에 존재하는 p53은 시클로필린 D와 결합하거나 미토콘드리아 투과 이행 구멍의 열림을 촉진하여 미토콘드리아 기질로 침투한다. 이는 산화적 인산화에 필요한 프로톤 기울기를 소멸시킨다. 낮은 강도에서 투과도 전이 기공 열림이 제대로 기능 하지 않는 미토콘드리아는 autophagy에 의해 제거될 수 있다. 그러나 역치를 넘는 미토콘드리아 외막 투과를 야기시킬 수 있는 투과도 전이 기공 열림은 사멸로 이어질 수 있다. 핵에서 p53이 그것의 보조 요소와 후생적 지표에 영향을 미치는 무수한 유전자를 변형활성 시킨다. 이러한 전사적 프로그램은 스트레스에 대한 적응, 세포주기 억류, autophagy 혹은 apoptosis를 야기시킨다. p53은 다양한 유전의 프로모터에 붙어 β1, β2 and γ-subunits of AMP-activated protein kinase (AMPK), AMPK의 다양한 조절자, mTOR1 complexes, autophagy 핵심 경로의 단백질과 리소좀 단백질과 같은 autophagy를 조절하는 다양한 단백질을 조절한다.
http://www.nature.com/nrm/journal/v15/n2/fig_tab/nrm3735_F1.html
Figure 1 | apoptosis와 autophagy 모두 유도하는 신호 a p53. p53은 어디에 위치하는 지와 활성 상태에 따라 autophagy를 유도하기도 하고 막기도 한다. p53이 세포질에 존재할 때 FIP200와 결합하여 ULK1 complex 활성을 방해함으로 autophagy를 억제한다. 스트레스 상황에서 p53은 핵으로 이동하여 the β1, β2 and γ subunits of AMP-activated protein kinase (AMPK), damage-regulated autophagy modulator 1 (DRAM1), sestrin 1, sestrin 2, phosphatase, tensin homologue (PTEN)와 같은 다양한 autophagy를 유도하는 유전자의 프로모터 영역에 붙어 autophagy를 촉진한다. 핵에 존재하는 p53은 또한 다양한 apoptosis를 일으키는 유전자의 전사를 유도한다. 특정상황에서 p53은 미토콘드리아로 이동한다. 미토콘드리아 외막 투과 (MOMP)을 일으키고, 우선적으로 mitophagy를 유도하지만 mitophgy의 보호 능력을 넘는 강한 자극은 apoptosis을 일으킨다. b BH3 (BCL 2 homology 3) only proteins과 BH3 mimetics. BH3 domain을 통해, Beclin 1은 BCL 2 family 로부터 apoptosis를 일으키는 단백질과 결합한다. 이 결합은 Beclin 1의 autophagy를 일으키는 기능을 억제하지만 BCL 2 family proteins 의 항 세포 고사 활성을 방해하지는 못한다. BH3 only proteins와 BH3 mimetics은 Beclin 1과 BCL-2의 결합을 방해하여 autophagy의 활성을 증가시킨다. BCL 2 interacting mediator of cell death (BIM)은 Beclin 1와 결합하여 autophagy를 억제한다. 미토콘드리아에 존재하는NIX (NIP3 like protein X) mitophagy를 선호한다. c Death associated protein kinase (DAPK). 이 kinase는 BCL 2와 분리되고 vacuolar protein sorting 34 (VPS34)과 결합하여 Beclin 1을 인산화하여 autophagy를 자극한다. DAPK는 VPS34를 인산화하여 활성화시키는 protein kinase D (PKD)을 활성화한다. d JUN N terminal kinase (JNK). JNK은 BCL 2 또는BIM을 인산화시켜 Beclin 1을 자유롭게 하여 autophagy를 유도한다. 즉 Beclin 1?VPS34 복합체를 형성하여 autophagy을 활성화시킨다. 또한 인산화된 BCL-2는 즉 비활성화된 BCL-2는 항 세포 자멸 기능을 감소시켜 apoptosis을 촉진한다.
BH3 only proteins
몇몇 BH3 (BCL-2 homology 3)-only 단백질은 autophagy와 apoptosis를 활성화 할 수 있는 두 가지 능력을 가진다 (FIG. 1b). Apoptosis를 유도하기 위해서는 BH3-only 단백질이 직접적으로 BCL-2 family로부터 다중 도메인 단백질과 결합한다. 이로 인해 항 세포 자멸 역할의 기능을 중화시키고 apoptosis을 일으키는 기능을 자극하게 된다. 이것은 세포 내 소기관 위치, 그들의 인산화 상태 그리고 각각의 단백질 간의 결합의 친밀도에 의해 영향을 주는 복잡한 cascade 반응이 일어나게 된다. BAD, BID, BNIP3, NIX, NOXA, PUMA를 포함한 몇 개의 BH3-only 단백질은 autophagy의 중심적인 조절자인 Beclin 1과 BCL-2 family {BCL 2, BCL XL (BCL extra large)}와 같은 항 세포자멸 단백질 또는 MCL1 (myeloid cell leukaemia sequence 1) 사이의 억제적 결합을 경쟁적으로 방해함으로써 autophagy를 촉진할 수 있다 (FIG. 1b). 약물학의 BH3 유사체는 비슷한 효과를 지닌다. BCL-2 또는 BCL-X로부터 분리된 Beclin 1는 vacuolar protein sorting 34 (VPS34) 와 결합하여 autophagy를 촉진한다. BH3-only 단백질 NIX는 자식포에 존재하는 autophagy protein light chain 3 (LC3)의 기능적 유사성을 지니는 GABA 수용체 결합 단백질(GABARAP)과 직접적으로 결합함으로써 손상된 미토콘드리아를 선택적으로 제거하는 것을 자극한다. 예외적으로 BIM은 직접적으로 Beclin 1과 결합하여 autophagy는 막고 apoptosis를 유도하는 BH3-only 단백질의 예이다. 이런 예외를 제외하고는 Beclin 1와 결합하는 대부분의 단백질은 autophagy와 apoptosis를 같은 방향으로 조절한다. BH3-only 단백질이 연속적으로 autophagy와 apoptosis를 자극한다는 메커니즘은 확실하게 밝혀지지 않았지만 한가지 가능성은 미토콘드리아가 죽음에 이르는 투과에 대항하여 보호하고 있을 때, BH3?only 단백질이 autophagy를 유도하고 스트레스가 높을 때는 BH3-only 단백질이 미토콘드리아 외막 투과를 유도하여 세포 자멸 cascade를 일으킨다는 것이다(BOX 2).
Ser/Thr kinases
DAPK, JNK, AKT와 같은 Ser/Thr 키나아제는 autophagy와 apoptosis을 순차적으로 또는 동시에 조절한다. Beclin 1은 BCL-2 또는 BCL-XL와 결합함으로 autophagy를 막고 있는데 DAPK가 Beclin 1에 인산화시켜 BCL-2 또는 BCL-XL와의 결합에서 떨어지게 하여 autophagy를 자극한다. 또한 DAPK는 protein kinase D (PKD)를 활성화 하고 VPS34를 인산화시켜 autophagy를 촉진한다 (FIG. 1c). JNK는 BCL-2를 인산화하여 Beclin 1과 BCL-2의 결합을 방해하여 apoptosis을 일으킨다. 동시에 BCL-2의 인산화로 인해 자유로워진 Beclin 1은 VPS34와 복합체를 이루어 autophagy를 작동시킨다. JNK는 DLC1으로부터 BIM과 Beclin1가 분리할 수 있게 BIM을 인산화한다 (FIG. 1d). JNK와 같이 autophagy와 apoptosis를 모두 조절하는 또 다른 키나아제는 AKT이다. PI3K?AKT 축에 의한 성장 자극 신호는 autophagy와 apoptosis을 억제한다. 이는 PI3K 또는 AKT가 억제되면 두 가지 과정을 유도한다는 것을 의미한다. AKT는 Beclin 1과 BAD을 인산화하여 autophagy를 일으키거나 apoptosis를 일으키는 기능을 억제하기 위한 14-3-3와의 결합을 자극한다. 더욱이 Akt의 성장인자에 의한 활성은 mTOR을 유도하거나 ULK1 complex (Atg1 complex in yeast)을 억제함으로 autophagy를 억압한다. 요약하면 DAPK 혹은 JNK는 활성화되면 AKT는 비활성일 때 autophagy와 apoptosis가 일어난다. 또한 이 두 현상은 세포가 약한 스트레스를 받을 때에는 세포보호 autophagy가 일어나고 더 강하고 지속적인 스트레스를 받을 때에는 apoptosis를 일으키는 것으로 보인다.
Oncogenes
Oncogenes은 autophagy와 apoptosis 모두 유도한다. 원종양 형성 유전자인 MYC의 활성은 대부분의 세포에서 암의 생존을 막기 위해 apoptosis를 유도한다. MYC의 활성은 단백질 번역을 증가시켜 소포체 스트레스를 일으키게 되는데 이 스트레스로 인해 비접힘단백질 반응신호에 관여하는 Protein kinase RNA-like endoplasmic reticulum kinase(PERK)가 활성화 되고 세포의 생존을 위한 autophagy를 유도시킨다. MYC이 apoptosis 또는 autophagy 의존적 생존을 유도하는지는 세포의 전후 사정에 의해 결정된다. Oncogenic H-RASV12와 K-RASV12은 세포의 생존과 종양형성 변형을 위해 autophagy를 자극한다. 이는 미토콘드리아의 대사적 기능과 에너지 유지를 위함이나 세포의 노쇠기를 예방하기 위해 일어나는 것으로 생각된다. 그러나 확실히 자리잡은 종양에서는 RAS?PI3K?mTOR signaling pathway에 의해 autophagy를 억압하고 RAS의 억제는 autophagy를 강화시켜 암세포의 죽음을 보호한다.
3. Inhibitory crosstalk
Autophagy와 apoptosis는 대체적으로 서로 억제하면서 교차 조절한다. 따라서 autophagy는 apoptosis가 일어나는 것을 막고 apoptosis의 활성은 autophagy의 억제와 연관된다.
Autophagy에 의한 apoptosis의 억제
Autophagy가 apoptosis를 일으키는 경향을 줄어들게 하는 원리적 메커니즘의 하나는 mi-tophagy이다. 미토콘드리아는 미토콘드리아 외막 투과에 의해 일어나는 intrinsic apoptosis가 시작 될지 아닐지 결정짓는 생존신호가 모여드는 전쟁터로 여겨진다. 많은 단백질, 지질, 대사산물은 미토콘드리아의 내막과 외막의 기능이나 상태에 영향을 준다. 세포가 죽는 동안에, 미토콘드리아 외막 투과는 미토콘드리아로부터 AIF와 endonuclease G와 같은 이화성 가수분해효소와 cytochrome c 와 SMAC과 같은 카스파제 활성제를 방출시켜 생물에너지적 재앙을 일으키는 inner mitochondrial transmembrane potential (Δψm)을 소멸시킨다 (FIG. 2A). 이로 인해 intrinsic apoptosis가 일어난다. 손상 받은 미토콘드리아는 부분적으로 세포고사 프로그램을 활성화 하는 경향이 있어 autophagy에 의한 손상 받은 미토콘드리아의 제거는 apoptosis 유도를 위한 역치값을 증가 시킬 수 있다(BOX 2).
http://www.nature.com/nrm/journal/v15/n2/fig_tab/nrm3735_F2.html
Figure 2 | 죽음신호에서 autophagy의 효과. A?C | autophagy 에 의한 apoptosis와 anoikis 의 억제 A | 미토콘드리아 외막 투과 (MOMP)는 이화 가수 분해인 apoptosis-inducing factor (AIF) 또는 endonuclease G (EndoG)와 카스파제 활정제인 (cytochrome c, 와 SMAC (second mitochondria-derived activator of caspase)을 세포질로 방출시킨다. 이러한 변화를 intrinsic apoptosis의 귀환 불능 지점이라 한다. 손상 받은 미토콘드리아의 선택적 autophagy 즉 mitophagy 는 apoptosis를 일으키는 요소의 방출을 제한하여 intrinsic apoptosis 을 지연시킨다. B apoptosis 의 extrinsic pathway 는 죽음 수용체에 trimeric ligands가 붙음으로 일어난다. [CD95(receptor)-FasL(ligand), TNFR1-TNF, TRAIL-TRAILR1, 2] 이 과정에서 중요한 현상은 카스파제8의 활성이다. Autophagy에 의해 활성화된 카스파제 8의 선택적 제거는 death receptor 자극 후 extrinsic apoptosis 시작을 지연시킬 것이다. 카스파제 8에 의해 유도된 apoptosis는 잠재적 MOMP 유도물질인 BH3 only protein BID (BH3 interacting domain death agonist)의 절단과 활성에 달려있다. Mitophagy는 또한 죽음 수용체를 통해 죽음신호를 억제할 것이다. C autophagy 에 의한 SRC protein 의 선택적 제거는 방해된 focal adhesion kinase (FAK) signalling 에 반응하여 과한 활성을 갖게 된다. extracellular matrix 로부터 cell detachment 에 유도되는 anoikis 의 시작을 지연시킨다. D,E | 세포죽음에서 autophagy의 역할. 세포 보호 작용으로 여겨지지만 자식포 또는 ATG proteins 특정상황에서 죽음 신호에 관여한다. Da 자식포는 카스파제8의 활성을 위한 플랫폼으로 작용한다. Db | 노랑초파리에서 Bruce (BIR-containing ubiquitin-conjugating enzyme; an orthologue of the mammalian inhibitor of apoptosis proteins (IAPs))와 같은 apoptosis를 일으키는 단백질의 선택적 autophagy는 apoptosis를 유도한다. Dc | 리소좀의 분해 용량의 포화상태로 인한 자식포축적은 미토콘드리아 투과 이행 구멍의 열림을 촉진한다. Ea | C6 ceramide 또는 tunicamycin과 같은 apoptosis를 일으키는 자극은 anti-apoptotic BCL 2 또는 MCL1 (myeloid cell leukaemia sequence 1) 단백질과 ATG12의 결합을 유도한다. 따라서 그들의 기능을 막아 apoptosis 를 증가시킨다. Eb ATG7은 lysosomal photodamage 후에 apoptotic pathway의 시작점 중 하나인 리소좀의 막 투과를 촉진한다.
그렇다면, 어떻게 autophagy가 손상 받은 미토콘드리아를 분해하기 위해 선택적으로 겨냥 할 수 있을까? respiratory chain (호흡연쇄) 혹은 미토콘드리아 내막의 투과의 기능을 상실시키는 ΔΨm의 감소는 mitophagy을 위한 꼬리표인 voltage-dependent anion-ive channel 1 (VDAC1), mitofusin 1 (MFN1), MFN2을 포함한 미토콘드리아 외막에 붙어있는 단백질의 Lys63-linked 유비퀴틴화를 자극한다. 이 ΔΨm의 소멸이 손상된 미토콘드리아 표면에 축적되는 PINK1를 분해하기 위한 단백질 분해효소가 작동하지 않게 멈추게 하여 손상 받은 미토콘드리아를 선택적으로 겨냥 할 수 있다. PINK1는 자가 소화 작용의 분해를 위한 기관을 겨냥하는 미토콘드리아 외막에 물질을 유비퀴틴화하는 E3 유비퀴틴 리가아제인 PARKIN (Parkinson’s disease protein)를 불러들이고 인산화한다. ΔΨm 소멸뿐 아니라 핵분열을 통한 미토콘드리아의 조각나짐은 미토콘드리아의 부적절한 분해에 대항하기 위한 메커니즘으로 여겨지며 mitophagy을 일으키기 위해 요구된다. ΔΨm의 소멸 하에 분해되지 않은 굶주린 세포에서의 미토콘드리아는 mitophagy로 가지 않음을 의미한다. 대조적으로 PTP의 열림 상태에서 ΔΨm 손실과 조각나짐이 보여지는 미토콘드리아는 autophagy에 의해 제거될 수 있다.
Autophagy는 또한 시토졸에서 apoptosis를 일으키는 단백질의 존재를 선택적으로 감소시킴으로 세포의 죽음을 완화시킬 수 있다 (FIG. 2B). Autophagy는 선택적으로 유비퀴틴화된 특정 단백질을 표적할 수 있다. 이 변형은 그들이 autophagy 수용체, 유비퀴틴화된 기질과 LC3 둘 모두에게 붙는 sequestosome 1 (SQSTM1; also known as p62)을 포함한 다양한 어댑터와의 결합을 가능하게 한다. 그 예로 autophagy가 억제되지 않으면 apoptosis를 일으키는 단백질인 BAX가 부족한 대장암 세포는 TRAIL에 유도된 세포 죽음에 저항성을 갖는다. 이는 autophagy가 활성 카스파제 8의 선택적 제거를 매개하기 때문이다. 비슷하게 tumour necrosis factor (TNF)-induced hepatocyte apoptosis 모델에서, 간에만 특정적으로 Atg7를 제거하여 autophagy의 억제시키면 청소 작업을 제대로 작동하지 못하여 카스파제 8 활성이 증가됨을 보였다. Autophagy는 키나아제 SRC를 표적 할 수 있다. 따라서 암세포에서 이 FAK에 의한 방해된 신호 때문에 anoikis을 피하게 해준다(FIG. 2C). 마지막으로, SQSTM1이 과발현하면 활성산소의 생산과 세포 죽음을 자극하여 au-tophagy는 감소된다.
Apoptosis의 의한 autophagy의 억제
강하고 장기간의 스트레스는 세포 죽음 양상 중의 하나인 apoptosis를 일으키는데 이때 카스파제의 활성이 동반된다. 다양한 단백질의 절단에 의해 세포고사 형태가 나타난다(BOX 2). 카스파제는 autophagy에 필요한 단백질을 분해하고 소화시킬 수 있어서 autophagy를 비활성화 시켜 세포보호적 기능을 중단시키거나 세포의 죽음을 촉진시키는 기능을 하는 것으로 생각된다. 카스파제의 표적들 중에는 ATG3와 Beclin 1이 있으며 이들의 분해는 autophagy는 기능을 손실시킨다. Autophagy protein AMBRA1 (activating molecule in BECN1-regulated autophagy 1)은 카스파제에 의해 회복되지 않게 분해된다.
세포 죽음을 가속화하는 autophagy 단백질의 분해에 관한 역할과 동일하게 카스파제 절단으로 인한 결과로 autophagy protein fragments (autophagy 단백질 부분)은 apoptosis를 일으키기 위한 기능을 위해 요구된다고 생각한다. 카스파제 3, 카스파제 6 또는 카스파제 9에 의한 Beclin 1의 절단되면 Beclin 1의 카르복시 말단 조각을 만들고 세포 내 미토콘드리아에 위치하고 in vitro에서 cytochrome c의 방출을 야기시키도록 미토콘드리아의 투과활성을 강화시킨다.
특히 카스파제 3에 의해 Beclin 1 잘려질 때, apoptosis를 일으키기 위한 기능을 하는 ATG4D가 BH3-like 도메인에 의해 매개된다. 비슷하게, ATG5이 칼페인 (calpain)에 의해 절단되면 미토콘드리아로 이동하고 apoptosis으로 유도하는 아미노 말단 조각을 생산한다. ATG5 조각은 또한 BCL-XL와 결합한다. 이러한 발견은 ATG4D, ATG5, Beclin 1의 발현을 상향 조절한다. 이로 인해 증가된 전사는 autophagy를 자극할 뿐 아니라 카스파제가 활성으로 단백질의 전구체가 세포고사를 가속화 한다. 카스파제 10은 BCL-2-associated tranion factor 1 (BCLAF1)를 분해하고 TNF가 죽음 수용체에 결합하여 apoptosis을 유도한다.
4. Autophagy가 apoptosis을 활성화한다.
Autophagy는 자가 소화 작용의 세포 죽음으로 알려진 과정으로 세포 죽음에 관여한다(BOX 3). Autophagy에 필수적인 관련 유전자의 억제, 감소, 삭제에 의해 autophagy가 억제되면 세포의 죽음은 예방한다. 마지막 세포 죽음 과정은 다른 세포 죽음 형태인 apoptosis이나 necroptosis보다 autophagy에 의해 매개된다. 그러나 autophagy의 유도가 apoptosis의 활성을 촉진한다는 몇 예가 있다. 더욱이 autophagy에 필수적 역할을 갖는 단백질은 apoptosis를 일으키기 위한 신호에도 관여한다. 이런 맥락에서, 몇 ATG 유전자는 독점적으로 역할을 하지 않을 뿐 아니라 세포 이물 흡수, 단백질 분비와 같은 다른 중요한 세포과정에 관여한다. 따라서 이런 과정으로부터 유전자나 혹은 단백질의 기능을 구별하는 것은 중요하다.
그렇다면 어떤 메커니즘을 통해 autophagy가 apoptosis의 유도를 선호 할 수 있을까? 분해과정보다 자식포형성은 세포에 팬 스핑고신(pan-shpingosine) 키나아제인 SKI I와 프로테아솜 저해제 bortezomib를 처리했을 때 카스파제 8의 활성과 함께 나타낸다(FIG. 2Da). 이런 맥락에서, 카스파제 8은 death receptor adaptor protein FAS-associated death domain (FADD)과 ATG5와 복합체를 형성하고, ATG5, LC3, SQSTM1와 함께 위치하여 ATG5-, FADD-, SQSTM1-의존적이게 활성화된다. SKI-I 또는 bortezomib이 처리된 세포는 Atg3 또는 Atg5 제거에 의해 autophagy 초기 단계를 억제시키면 카스파제 8의 활성을 감소시킨다. 반면 bafilomycin A1를 처리하여 autophagy의 후반 단계를 억제시키면 카스파제 의존적인 세포 죽음을 증가시켰다.
이러한 실험 결과는 자식포 형성이 카스파제 8의 활성을 위한 발판이 됨을 나타낸다. 그러나 카스파제 8 활성은 주로 autophagy가 유도 될 때 일어나지 않는다. Autophagy 초기 단계에서 활동하는 ATG7이 간에만 특수적으로 없을 땐 TNF에 의해 in vivo에서 caspase 8 활성을 자극할 수 있다. 어떤 요소에 의해 활성을 갖는지는 아직 정확하게 밝혀지지 않았다. Autophagy는 아마 이 세포 죽음 경로의 내성의 억제제의 감소에 의해 apoptosis를 자극 할 것이다. 노랑 초파리 (Drosophila melanogaster) 에서 apoptosis는 주로 카스파제와 inhibitor of apoptosis proteins (IAPs)사이의 상호작용에 의해 조절된다. 이 IAPs 중 하나로 Bruce (BIR-containing ubiq-ui-tin-conjugating enzyme)는 autophagy에 의해 분해되는데 이는 왜 atg1, atg13, vps34의 변형과 같은 autophagy의 유전적 억제가 늦은 난자형성 단계에서 영양세포의 발생적 apoptosis를 예방하는지를 설명한다 (FIG. 2Db).
Autophagy는 apoptosis의 가장 중요한 형태가 없는 세포 죽음의 양상인 pyknosis와 kar-yorrhexis이거나 세포막을 초기에 파열시키는 특징을 지니는 necrosis를 일으킬 수 있다. Autopha-gy가 necrosis를 일으키는 경우는 섬유육종 세포에서 autophagy가 과산화 수소를 해독하는 카탈라아제를 분해하여 괴저성의 세포 죽음을 촉진한다 (FIG.2Dc). 또 다른 예로 심근허혈에서 au-tophagy가 심장을 보호 하는 것으로 생각되지만 축적된 자식포는 즉 과도한 autophagy는 혈액공급이 회복될 때 (재관류) 독성을 지닌다. 저산소 심장 근육 세포의 재관류시 자식포는 형성되지만 제거되는데 실패한다. 이는 조직 손상에 따라 자식포가 리소좀과 결합되는 과정에서 필요한 lysosome-associated membrane protein 2 (LAMP2)의 발현이 감소되어 일어나는 것으로 보인다.
자식포가 축적될 때, 심장 근육 세포는 미토콘드리아의 PTP의 억제제인 cyclosporin A(FIG. 2Dc)에 의해 미토콘드리아의 necrosis을 일으킨다. 자식포의 축적이 미토콘드리아의 PTP열림을 자극하여 apoptosis를 이끄는지에 대한 메커니즘은 아직 밝혀지지 않았다. ATG 단백질은 자가 소화 작용 과정에서 독립적으로 죽음 신호에 공헌한다. 그 예로 ATG12은 미토콘드리아의 경로를 통해 카스파제를 활성화하는 역할을 한다 (BOX 2). 따라서 ATG12의 고갈(다른 필수적인 ATG 단백질의 제거가 아닌)은 C6 ceramide, etoposide, paclitaxel, staurosporine, tunicamycin에 의한 세포고사 스트레스에 반응하여 카스파제의 활성을 감소시킨다(FIG. 2Ea). 이는 autophagy의 활성을 위해서가 아닌 apoptosis를 일으키기 위한 ATG12의 BCL-2, MCL1와의 결합을 매개하는 BH3 도메인과 연관 되어 있다. 비슷하게, ATG7은 lysosomal photodamage 후에 리소좀 막 투과를 촉진하여 apoptosis의 유도를 촉진한다 (FIG. 2Eb).
5. Intercellular crosstalk
괴저성의 세포로부터 방출되는 수용성 물질이 이웃세포의 autophagy를 유도할 수 있는데 이는 danger-associated molecular patterns (DAMPs)로 autophagy를 자극 한다. 과도한 DAMPs는 병리학적 죽음을 가중시킨다. Autophagy는 세포의 죽음을 최소화하여 심장 근육세포의 손실을 막고 국소빈혈에서 신경세포의 손실을 막는 역할을 한다. Apoptosis로 진행 되기 전에 일어나는 autophagy (‘pre-mortem autophagy’)는 이웃하거나 움직이는 식세포에 의해 인지되고 이식작용에 관여하여 죽은 세포의 운명을 결정 짓는다.
발달성 apoptosis가 일어나면 pre-mortem autophagy는 죽은 세포의 면역을 피하기 위해 필요하다 (FIG. 3a). Autophagy는 높은 레벨의 ATP를 유지하여 화학주성신호인 lysophosphatidylcholine (LPC)의 분비를 촉진하여 식세포를 불러들이고 식세포에 의해 죽은 세포를 잡아 먹을 것을 촉진하는 ‘eat-me’ 신호에 관여하는 phosphatidylserine (PtdSer)의 세포 표면 발현을 촉진한다. 따라서 발달성 apoptosis 과정에서 pre-mortem autophagy는 죽은 세포의 효과적 제거를 촉진하고 부적절한 면역 반응이 일어나지 않게 막는 역할을 한다. 암세포에서 리소좀의 외포작용은 LAMP1과 vesicle-associated membrane protein 7 (VAMP7)를 통해 리소좀과 세포막의 결합을 위한 작용이며 이 과정으로 리소좀의 내용물이 빠져 나오게 되고 또한 ATP 역시 방출된다.
http://www.nature.com/nrm/journal/v15/n2/fig_tab/nrm3735_F3.html
Figure 3 | 조직 내 죽은 세포의 제거를 위한 autophagy의 영향. a 발달성 세포 죽음이 일어나는 동안 pre-mortem autophagy은 잠재적 화학주성 신호인 lysophosphatidylcholine (LPC)이 방출되어야 하고 세포 표면의 ‘eat me’ signal phosphatidylserine (PtdSer)의 노출이 요구 된다. 이 두 가지가 일어나지 않을 땐, 포식세포의 모집이 약화된다. 따라서 죽은 세포가 잘 제거되지 못하고 면역반응을 증가시키고 발달에 장애를 일으킨다. b Pre-mortem autophagy 유도는 죽어가는 암세포로부터 ATP 방출을 위해 필수적인데 ATP방출의 억제는 면역세포의 모집에 문제를 일으켜 면역 체계의 활성에 문제를 야기시킨다. 이는 효과적인 항암치료를 위해 필요하다.
따라서 리소좀과 자가 라이소좀에 높은 레벨의 ATP를 유지할 수 있게 되는 것이다. Pre-mortem autophagy는 ATP의 방출이 요구되는데 이는 apoptosis 과정에서 세포로부터 식세포를 위한 중요한 화학주성 신호이다. Autophagy가 제대로 작용하지 않는 세포에서 ATP의 레벨이 낮게 되고 이는 골수와 림프 세포의 활성을 떨어뜨려 화학 요법이나 방사선 치료 후에 종양병상으로 만든다. 따라서 면역시스템의 세포가 외부 박테리아나 바이러스와 같은 외부 병원체를 인지하는 immunosurveillance을 감소시킨다(FIG. 3b).
6. 결론
Autophagy와 apoptosis 사이의 상호관계는 전후 사정에 의해 결정된다. Autophagy가 드물게 apoptosis 혹은 necrosis의 세포 죽음 프로그램을 선호 할 때가 있지만 주로 apoptosis와 autophagy는 상호적으로 억제하는 것으로 보인다. 대부분 autophagy는 apoptosis를 억제하거나 적어도 apoptosis를 유도하기 위해 필요한 스트레스의 역치값을 올린다. 이는 autophagy가 pro-apoptotic 보다는 anti-apoptotic 경향이 있음을 의미한다. 대부분의 세포는 스트레스를 받는 초기단계나 약한 정도의 스트레스일 때 autophagy을 유도하고 늦은 단계나 강한 스트레스에서 apoptosis를 유도하기 때문에 autophagy와 apoptosis의 상호작용은 전체적인 세포가 죽는 경향을 감소시킨다 (FIG. 4a,b). 세포고사 카스파제 활성은 autophagy에 필수적인 단백질을 분해하여 자가 소화 작용 과정은 멈춰지고 apoptosis를 일으키는 과정으로 바뀌게 된다 (FIG. 4c).
http://www.nature.com/nrm/journal/v15/n2/fig_tab/nrm3735_F4.html
Figure 4 | autophagy 와 apoptosis 사이의 기능적 관계. a apoptosis와 autophagy사이에 기능적으로 연관이 없다면 스트레스의 강도에 따라 autophagic pathway 혹은 apoptosis로 진행될지 결정된다. b autoph-agy가 apoptosis를 방해하면 세포는 세포의 죽음에 저항성을 갖게 된다. c 세포 보호적 autophagy, 스트레스의 강도가 낮을 때 autophagy는 apoptosis에 대항하여 초기 방어벽으로 여겨진다(1). 그러나 스트레스의 강도가 증가하면 autophagy는 억제되고 apoptosis가 일어나며, 세포보호적 물질이 세포 독성으로 바뀐다. 그 예로 ATG 단백질의 절단은 autophagic machinery을 비활성시킬 뿐 아니라 pro-apoptotic 성질을 지닌 단백질 fragments를 생산한다(2).
Autophagy는 조직이 심하게 상하게 되는 것을 막는데 그 예로 국소빈혈적 경색이 있다. 낮은 정도의 손상에서 (FIG. 4b,c), autophagy의 세포 보호적 기능을 하여 세포독성 효과를 이겨낸다. Autophagy는 치사량에 가까운 국소빈혈 전 경색에 대항하여 심장이나 뇌를 보호 하기 위해 일어나는 현상으로 여겨진다. 비슷하게, 쥐에서 amyotrophic lateral sclerosis (ALS)와 같은 중추 신경계의 퇴행성 질환에서 소포체 스트레스가 연루 되어 있는데 이에 맞서 보호하는 메커니즘으로 autophagy가 작동한다. 정확한 분자 메커니즘이 밝혀지지 않더라도 손상된 퇴행성적인 기관 그리고 치사적인 단백질의 aggregates를 autophagy 과정으로 제거 되어 세포의 죽음으로 가는 경향을 감소시킨다. 암에선 autophagy는 다양한 종양 형성유전자 물질 (PI3K, AKT, BCL-2, mutant p53)에 의해 억제된다. Autophagy의 억제가 세포 내 대사를 동요시킨다는 하나의 각본은 게놈 불안전성을 유발한다. 종양형성(발암)의 마지막 단계에서, autophagy는 복귀되고 autophagy는 화학 요법이나 방사선 치료에서 암세포의 저항성을 올린다. 따라서 암 치료를 위해 Chloroquine과 hydroxychloroquine과 같은 autophagy 억제제를 사용하고 있다.
노화가 autophagy의 점진적 기능장애 (제대로 작동하지 않는 미토콘드리아의 축적, 핵 게놈 불안정, 줄기세포 소모, 유사분열 후 세포의 강화된 손실, 면역체계의 점진적 약화, 부적절한 면역반응 결국에는 스트레스 상황에서 적응하기 위한 건강이익반응의 감소)와 관련 있다는 많은 증거가 있다. 더욱이, 칼로리 제한, 인슐린이나 인슐린 유사 성장 요소 신호의 억제, sirtuin 1 활성 또는 rapamycin, resveratrol, spermidine의 장기간 투약은 autophagy의 유도를 위한 방법이 되며 육체적 운동으로 인한 항당뇨 효과는 autophagy를 유도하기 위해 필요하다. 이런 맥락에서 다양한 질환의 치료 목적을 위한 잠재적 새로운 타깃을 찾기 위해 두 모델 autophagy, apoptosis사이를 관찰하는 것은 흥미로운 주제가 될 것이다.



☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0002448.pdf
pdf_0002448.pdf