기술동향
CRISPR/Cas9을 이용한 혁신적 게놈편집 연구 동향과 윤리적 논쟁
- 등록일2016-01-20
- 조회수8295
- 분류기술동향
-
자료발간일
2016-01-19
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#게놈편집 마우스#생명윤리#Genomics#CRISPR/Cas9#ZFN
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
CRISPR/Cas9을 이용한 혁신적 게놈편집 연구 동향과 윤리적 논쟁
목차
1. 서론
2. 본론
2.1 DNA의 이중나선절단을 이용한 유전자개변
2.2 제 1세대 인공누클레아제 : ZFN
2.3 제 2세대 인공누클레아제 : TALEN
2.4 제 3세대 인공누클레아제 : CRISPR/Cas9
2.5 게놈편집 마우스
2.6 윤리적 문제
3. 결론
4. 참고문헌
1. 서론
“보통 버섯의 50배 크기의 버섯을 재배하였다” 수년 전 필자가 무의식적으로 박수를 보냈던 기사이다. 이와 더불어, 농약에 강한 콩의 개발에 ‘성공하였다’, 해충의 위험이 적은 옥수수를 재배하는 것이 ‘가능하였다” 라는 ‘인위적’ 유전자공학의 연구결과에 감탄이 절로 나온다. 최근 다시 한번 필자를 놀라게 하는 기술이 바로 이러한 유전자재조합의 연구결과의 흐름을 제대로 이은 게놈편집 기술이다. 게놈편집 기술의 특이할만한 점은 pin point로 원하는 부위에 원하는 유전자 배열을 넣고 뺄 수 있음으로써 보다 빠르고 정확하게 유전자를 조작이 가능하다는 점이다 (아직까지는 100%의 효율을 나타내지는 않는다. 하지만 이것이 연구자의 입장에서는 재미있는 점이다).
근육양이 종래의 2배인 소, 전염병에 강한 돼지, 쉽게 상하지 않는 야채 등등 게놈편집 기술의 실용적 보급 범위는 점점 넓어 지고 있다. 근육양이 종래의 2배인 소를 예로 들자면, 근육의 성장을 억제하는 역할을 하는 미오스타틴 이라고 하는 유전자를 소의 DNA에서 잘라낸 후, 미오스타틴이 잘려나간 DNA를 소의 수정란에 주입한 결과, 근육의 양이 보통 소의 2배로 증가한 소가 탄생하였다. 아직은 개발단계에 있지만 향후에는 식량난에 어려움을 겪는 나라에 제공될 계획이 있다고 한다. 이 소를 개발하는 벤처기업에서는 현재 뿔이 없는 젖소를 개발 중이다. 먼저 젖소로부터 세포를 꺼내어 게놈편집을 통하여 뿔을 만드는 유전자를 잘라낸 후, 뿔을 만들지 않는 일반소의 유전자를 넣는다. 그 유전자를 젖소의 수정란에 다시 넣으면 뿔이 없는 젖소가 만들어지는 것이다. 뿔이 없으므로 농가에서 안전하게 우유를 짜는 작업이 가능하게 되는 효과가 예상된다고 한다.
이렇게 게놈편집이 실생활에서도 급속히 응용되고 있는 가운데, 어디까지 이 기술이 허용되는지를 우려하는 소리가 높아지고 있다. 본론에서 자세히 다루겠지만 현재의 주력 게놈편집 기술로 여겨지는 CRISPR/Cas9시스템에 있어서, 현시점에서의 문제점 (정확성이 완벽하다고 할 수 없음 등) 은 그 활발한 연구 속도로 비추어 보았을 때 조만간 해결될 가능성이 보인다고 말할 수 있기 때문이다. 실제로 2013년 CRISPR/Cas9시스템을 이용한 게놈편집에 관한 연구결과가 처음 발표된 이후로 아직 2년정도밖에 경과되지 않았지만, 그 막대한 파급력은 이루 말할 수 없다. 필자가 이번 동향리포트를 작성하기 시작한 이후 마무리를 지을 몇 주 동안에만 하더라도 CRISPR/Cas9시스템을 이용한 게놈편집을 다룬 수십 편의 새로운 논문이 개제되어 새삼 놀라지 않을 수 없었다. 번뜩이는 아이디어에 놀람과 동시에 그 결과에 고개를 끄덕이며, 또한 그 아이디어를 (아마도 다른 연구그룹 보다 빨리) 결과로 마무리 하기 위한 여러 연구자들의 노력을 상상하면 절로 고개가 수그러질 따름이다. 이렇게 빠른 속도로 연구가 확산되고 있다는 것은 얼마나 이 기술이 영향력이 있는지를 보여주며, 현재까지는 원숭이를 포함한 포유류를 이용한 연구가 이루어 지고 있으나 원리적으로는 인간 게놈에까지 응용이 가능하다고 여겨지고 있다. 그렇기 때문에 더욱더 이 기술을 이용하여 실제로 인간 게놈을 편집하는 것에 관한 윤리적 우려가 제시되고 있는 것이 사실이다.
본고에서는 게놈편집 기술의 원리와 연구 동향 및 이에 관해 논의가 되고 있는 윤리적 관점에 관하여 정리하였다.
2. 본론
2.1. DNA의 이중나선절단을 이용한 유전자개변
?게놈편집의 힌트는1994년에 보고된 ‘DNA의 이중나선절단 (Double strand break, DSB)이 상동재조합 (Homologous recombination, HR)을 촉진한다’고 하는 연구결과라 할 수 있다. 외부의 핵산을 게놈 안의 임의의 장소에 도입하는 방법인 유전자 타기팅 법을 마우스 ES세포에 응용한 결과 임의의 유전자가 개변된 마우스를 얻을 수 있었다. 즉, 생세포 안에서 DNA의 이중나선이 손상되면 DNA의 수식기관중의 하나인 비상동 말단결합 (non-homologous end joining, NHEJ)의 수식에러에 의해 몇 개의 염기배열이 도입 또는 결손 된다. 이때 타깃 DNA을 같이 도입하면 HR에 의해 타깃 DNA의 배열이 자연발생적으로 게놈상에 ‘우연히’ 넣어진다 (knock in). 다만 이러한 유전자 타기팅 법은 우발적으로 생기는 HR에 의존하기 때문에, 목적한 재조합이 일어날 확률은 극히 적다. 이 확률을 높이는 것이 게놈편집의 기본 컨셉이다.
인공 누클레아제를 이용하여 목적 DNA를 보다 고효율로 간편하게 절단함으로써 이러한 NHEJ 및 HR의 효율성이 높아지게 되었고, 어떠한 인공 누클레아제를 사용하였는가에 의해 게놈편집의 세대를 나눌 수 있다 (그림).
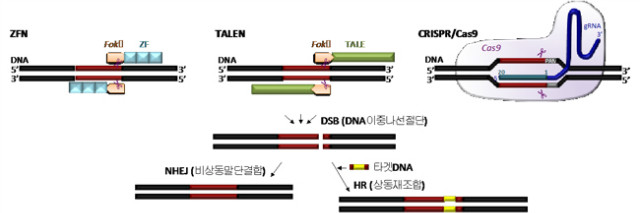
2.2. 제 1세대 인공누클레아제 : ZFN
특정한 염기배열을 인식하여 절단하는 효소라 하면 아마도 가장먼저 제한효소가 떠오를 것이다. 하지만 제한효소가 인식하는 부분은 5,6개 정도의 적은 수의 염기배열이기 때문에, 약 30억개의 염기로 이루어진 인간의 DNA에 제한효소를 도입한다면, 그 효소의 인식배열과 비슷한 부분을 잘못 인식해 버릴 가능성이 크다. 다시 말하자면, 목적배열만을 정확히 인식하여 절단하기가 좀처럼 쉽지 않을 것이다. 여기서 충분한 절단부위 인식특이성을 갖게 하고자 인공적으로 작성된 누클레아제가 바로 1996년에 보고된 ZFN (zinc finger nuclease)이다. ZFN의 구조와 기능을 크게 두 부분으로 나눌 수 있는데, 하나는 목적배열에 맞춰 디자인이 가능한 DNA와 결합하는 도메인이고, 다른 하나는 DNA을 절단하는 도메인이다. 자연계에 존재하는 제한효소 중에서 Fok1이라는 효소는 그 내부 중에 DNA을 인식하는 부분과 절단하는 부분이 떨어져 있다는 점이 밝혀졌고, 그렇기 때문에 절단기능을 갖는 도메인만을 쉽게 분리가 가능하였다. 때문에 Fok1을 절단도메인으로 응용하였다. 한편, 결합도메인으로는 생물계에 널리 존재하는 DNA 결합모듈인 ZF (zinc finger)가 채용되었다. ZF은 1모듈이 3염기를 인식하기 때문에, 이것을 예를 들어 3개 연달아 잇는다면 9염기를 인식하게끔 된다. ZF에 Fok1의 절단도메인을 링커를 끼고 연결시킨 것이 ZFN이다. Fok1의 절단도메인은 hetero dimer를 형성하였을 때 기능한다. 그렇기 때문에, 3개의 ZF이 연결된 ZFN로 인하여 목적하는 9개의 염기배열을 인식하게끔 하고, 그 근방의 9염기를 인식하는 구조의 ZFN을 페어로 도입하는 것에 의해 9x2=18염기의 목적 배열을 인식하게 된다. 이때에 말단에 위치하는 FokI의 절단기능이 작동하여 DSB가 도입되게 된다. 18염기 정도의 특이성이 있으면 이론상으로는 전체 게놈 DNA배열 중 한곳을 선택적으로 절단하는 것이 가능하게 된다.
하지만, ZF는 하나의 모듈이 3개의 염기를 인식하는 점으로부터 이론상으로는 3개의 모듈이 연결되었다면 9개의 염기에 특이성을 띄게 되지만, 실제로는 여러 개의 모듈을 연결하였을 경우 서로가 염기인식에 간섭(interference)을 일으키기 때문에 DNA 결합도메인의 인식 특이성이 저하되는 것이 많아, ZFN은 일부 연구자들 사이에서만 사용되고 있었다.
2.3. 제 2세대 인공누클레아제 : TALEN
그런 중에 2010년 ZFN의 DNA 결합도메인을 식물병원세균인 Xanthomonas이 갖는 전사인자인 TAL effector로 바꾼 TALEN ((tranion activator-like effector nuclease)이 개발되었다. TALEN을 이용한 게놈편집의 원리는 앞서 말한 ZFN을 이용한 것과 유사하지만, 다른 점은, TALE은 DNA에 결합할 때 한 개의 모듈이 한 개의 염기를 인식하기 때문에 연속적으로 연결해도 서로간의 염기인식을 간섭하지 않는다는 점이다. 일반적으로는 약 17개의 모듈을 연결하여, 페어로 총 34개 정도의 염기쌍에 특이성을 갖게 된다. TALEN의 개발초기 단계에서는 포유류의 게놈편집에 응용할 경우에는 효율이 낮다는 문제가 있었지만, 2013년에 DNA 결합모듈 연속부위의 아미노산배열을 개량한 Platinum TALEN이 개발되어, 포유류세포에서도 높은 절단효율이 얻어진다는 점이 보고되었다.
2.4. 제 3세대 인공누클레아제 : CRISPR/Cas9
CRISPR/Cas9 (clustered regularly interspaced short palindromic repeats/CRISPR-associated protein 9)는 정확히 구분하자면 RNA유도형 누클레아제이며, 앞서 말한 ZFN 및 TALEN과 같은 키메라단백질 타입의 인공 누클레아제와는 약간 개념이 다르다. CRISPR/Cas9은, ZFN 및 TALEN과 같이 표적배열에 맞추어 매번 인공 누클레아제 융합 단백질을 구성할 필요가 없으며, gRNA (guide RNA)의 배열을 oligo DNA로 합성하여 목적벡터에 집어넣고 그 후 범용적인 Cas9와 공발현시킴으로써 부위특이적 누클레아제로서 기능하게 된다. 다시 말하자면, ZFN 및 TALEN 시스템에서는 단백질과 DNA의 상호작용을 이용하여 염기배열을 인식하였다면, CRISPR/Cas9 시스템에서는 RNA와 DNA의 상호작용을 이용하여 염기배열을 인식한다. 또한 ZFN 및 TALEN은 페어로 존재할 때에 DSB가 기능하는데 반해, CRISPR/Cas9은 한 개의 gRNA에 의한 염기인식으로 DSB가 일어나게 된다.
CRISPR/Cas9 시스템에서 gRNA가 인식하는 염기배열은 20염기정도이며, 그 3’쪽에 Cas9가 인식하는 PAM (protospacer adjacent motif) 배열이 필요하다. 현재 널리 이용되고 있는 Streptococcus pyogenes 유래 Cas9 (SpCas9) 가 인식하는 PAM 배열은 (5’-NGG-3’)이며, gRNA를 디자인하는데 있어서 엄밀한 제약을 수반하지는 않는다. 이와 같이, 한 종류의 gRNA와 한 종류의 Cas9를 발현시키면 게놈편집을 실행할 수 있고, 게다가 Cas9는 공통의 것을 사용하기 때문에, 실질적으로는 gRNA의 배열을 oligoDNA로 합성하여 목적벡터에 도입하는 것만으로 게놈편집이 가능해지게 된다. CRISPR/Cas9에 관한 연구가 급속히 발전할 수 있었던 이유는 이러한 벡터 디자인 및 구축의 간편함이다. CRISPR/Cas9이 다른 인공 누클레아제와 비교되는 또 하나의 장점은, 복수의 표적을 동시에 편집 가능하다는 점이다.
CRISPR/Cas9을 포함한 게놈편집기술에 있어서 현재 가장 중요시 되고 있는 문제는, 타깃 염기배열과 유사한 배열이 게놈상에 존재할 경우 그 부분을 인식하여 잘라버리게 되는 현상 (off-target)이며, off-target 리스크를 없애기 위한 연구가 절대적으로 필요하다.
2.5. 게놈편집 마우스
인공 누클레아제를 이용한 게놈편집의 발전에 따라, 지금까지는 곤란하게 여겨졌던 배양세포에서의 효율적 게놈편집이 가능해졌다. ES세포 및 iPS세포를 이용한 재생치료를 시야에 넣은 연구를 포함하여, 저가, 고효율로 인공 누클레아제를 이용한 게놈편집 마우스 작성 또한 가능해짐에 따라 앞으로 의학적 치료 연구에의 폭넓은 응용이 기대되고 있다. 특히 종래의 유전자 타기팅 법에 의한 마우스작성법은, 게놈 DNA배열을 개변한 ES세포를 수립하고 키메라마우스를 섞어서 작성하는 것이 일반적이었으나, 이러한 작성법은 약 1년의 시간이 필요하다는 점을 포함하여 연구전략상 손쉽게 선택할 수 있는 방법이라 말하기는 어렵다고 볼 수 있었다. 이러한 중에 등장한 CRISPR/Cas9을 이용한 게놈편집 마우스의 작성은 종래의 과제를 해결할 수 있는 혁신적 방법으로 주목을 받고 있다.
CRISPR/Cas9시스템을 이용한 미생물 게놈편집 및 포유동물 배양세포에의 응용이 보고되고 나서 동물개체에의 응용 가능성이 제시되었을 무렵, 2014년4월 Huang 그룹에 의해 마우스 수정란의 게놈편집 연구결과가 보고되었다. eGFP knock-in 마우스의 eGFP배열 파괴를 목적으로 한 이 연구는, 효율은 20% 정도로서 그렇게 높지는 않았으나 가능성을 충분히 보여준 결과로서 주목할만하다. 그 해 5월 Jaenisch 그룹에 의해 수정란에 복수의 표적배열에 대응하는 gRNA 세트를 공주입 함에 의해 복수배열을 동시에 파괴하는 것이 가능하며, 내재배열과 상동한 배열을 갖는 합성 oligoDNA를 CRISPR/Cas와 공주입 함에 의해 타깃 knock-in 마우스의 작성 또한 가능함이 보고되었다. 보다 최근인 2015년에 MIT Pleogh 그룹에서 ‘NHEJ을 억제함으로써 CRISPR/Cas9시스템의 효과를 증가시킨다’ 라는 연구결과를 보고하였고, 그들은 세포뿐 아니라 마우스를 이용해서도 이 효과를 검증하였다. 이 연구에 참여한 Dr. Dougan은 최근 하버드의대 Dana-Farber 암연구소에 연구실을 구축하여 게놈편집 체세포 핵이식 마우스 작성과 off-target 리스크 해결을 위한 활발한 연구를 진행 중이다 (필자가 소속하는 연구실을 이 자리를 빌어 소개해본다).
게놈편집 후 마우스에서 나타나는 off-target의 해결법으로서, 야생형 마우스와의 교배에 의해 표적유전자의 변이는 그대로 유지하면서 오프타깃 절단이 없는 다음세대의 마우스를 선택하는 방법이 있다. 또한 누클레아제 불활성 Cas9 nickase를 사용한 nicking을 이용한 off-target 절감 효과에 관한 연구도 활발히 진행되고 있다. 특히 임상응용에 위해서는 더욱이 off-target을 없애기 위한 신중한 검토가 필요하다.
2.6. 윤리적 문제
2015년 1월, 게놈편집기술로 인한 논리문제 및 사회적 영향에 관해 NAPA 회의가 진행되었다. 1975년 유전자재조합기술에 관해 논의된 Asilomar 회의에 이은 제 2의 Asilomar 회의라고 불리어지기도 하는 이 회의에 대해 3월 Science는 리포트를 개재, 같은 시기 네이처에서도 전문가의 코멘트를 개재하였다. 이 회의의 요점은, 유전자편집을 배아 및 생식세포에 사용하는 연구는 ‘당분간’ 행하지 않는다 이었다. 그 이유는 다음과 같다. 1) 아직까지 정확한 기술이 아니다. 원숭이를 이용한 실험에서도 100%의 정확성이 얻어지고 있지 않다. 2) 목적한 유전자 이외의 유전자에까지 영향을 미칠 수 있다. 3) 윤리적 문제에 대해 아직 논의가 진행되고 있는 중이다. 이와 더불어, 앞으로 보다 국제적 회의 및 포럼을 적극 개최하여, 게놈편집의 정확성을 포함한 새로운 기술에 관해 정보를 공유하며, 더욱 깊이 있는 연구를 행하도록 한다. 하고도 하여, 전면금지 라고 하기 보다는 조금 더 기술이 발전하기 까지 기다린다 라고 보는 편이 나을 수도 있겠다.
NAPA 회의가 개최된 계기라고 볼 수 있는 논문이 바로 Protein&Cell에 개재된 CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes 이라는 논문이다. 논문 제목에서부터 알 수 있듯이, 인간 수정란의 유전자를 편집하고자 한 내용으로, 인간의 수정란의 유전자편집이 세계에서 처음으로 보고된 논문으로서 주목을 끌었다. Protein&Cell에 개재되기에 앞서 Nature, Science에 투고가 되었지만 거부가 되었다고 한다. 핵심 연구결과가 negative하였기 때문에 (미숙한 수법으로 인하여 유전자의 예상외의 부분에 많은 변이가 들어갔기 때문에 앞으로 더욱 정확성을 높이는 것이 필요하다 라고 저자도 논문상에 기술을 하였다), 개제하기에 불충분한 연구 결과라 판단되었을지도 모른다. 또한, 논리적 문제를 고려하여 거절이 되었을 가능성도 있다. 학술지에 개재되었다라고 함은 학술지가 그 성과 및 연구를 인정한다고 하는 의미가 되기 때문에 그 연구가 순식간에 가속화 될 수가 있다. Nature, Science에서 그 이후 인간수정란의 유전자편집에 대하여 다소 부정적인 견해를 비추는 기사를 내었다. 이 논문이 개재된 Protein & Cell에서도 개재 이후 Urgency to rein in the gene-editing technology라는 제목의 기사를 개재하여 다시 한번 주목을 받았다.
게놈편집기술의 임상연구를 긍정적으로 생각할지 부정적으로 생각할지는 개개인의 차이가 있다고 본다. 그렇기 때문에 더욱더 이러한 찬반여론을 받아들이고, 논의를 거쳐, 어디까지 가능하고 가능해서도 되는지, 기초연구와 임상연구의 구분기준 및 허용범위 등을 토의하는 학회 및 회의가 활발히 개최되는 것이 중요할 것이다.
3. 결론
2000년대에 완성된 인간게놈해독 프로젝트에 의해 인간은 약 30억개의 염기쌍으로 구성 되어있는 것이 밝혀졌고, 30억개의 게놈 DNA 중의 한 부분을 특이적으로 절단하는 것이 게놈편집 기술에 의해 이론적으로 가능하게 되면서 이 기술은 순식간에 생명과학연구에 있어서의 기반적 기술로 확립되었다. CRISPR시스템은 Cas9 누클레아제를 표적배열에 유도하는 gRNA를 간편히 디자인 할 수 있으며, 포유류 세포에서 고효율로 기능하고, ES 및 iPS세포주를 포함한 세포레벨에서의 실험, 마우스, 랫트, 토끼 등의 실험동물 레벨에서의 성공 등, 그 연구 성과는 급속히 발전하고 있다. 임상연구에 있어서는 윤리적 문제가 제기되고 있지만, 게놈편집은 유전자의 기능해석에 필수적인 기술이라 말할 수 있으며, 앞으로도 적극적 기초연구가 기대된다.
4. 참고문헌
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향


 pdf_0002457.pdf
pdf_0002457.pdf