기술동향
진균에서 발견된 새로운 기능의 메틸전이효소들과 이에 의한 분화 조절
- 등록일2016-01-28
- 조회수7134
- 분류기술동향
-
자료발간일
2016-01-07
-
출처
지능형 바이오시스템 설계 및 합성 연구단
- 원문링크
-
키워드
#진균#메틸전이효소#분화조절#메틸화#전이효소
- 첨부파일
출처 : 지능형 바이오시스템 설계 및 합성 연구단
진균에서 발견된 새로운 기능의 메틸전이효소들과 이에 의한 분화 조절
우석대학교 한갑훈 교수
1. 서론
메틸화(methylation)은 일반적으로 세포내의 중요한 전사후조절 (posttranslational modification; PTM) 기작의 하나로, 핵내 메틸화효소 (methyltransferase; MTase)들은 DNA나 히스톤 단백질에 작용하여 분화, 노화, 질병 등에 관련된 중요한 유전자의 발현을 조절하는 것으로 알려져 있다(Hong et al., 2012). MTase의 활성화는 다양한 신호전달기작(signal transduction pathway)을 통하여 세포밖의 신호를 전달하는 과정에서 조절된다. 그러나 인산화(phosphorylation)의 경우와 달리 MTase 효소가 신호전달기작에 직접적으로 관여하는 예는 많이 알려져 있지 않고 있다. MAP kinase는 세포막에서 전해지는 신호를 인산화 모듈(kinase module)의 작용을 통하여 핵으로 그 신호를 전달하는 대표적인 케이스이며 효모의 분화관련 신호전달에서 포유류의 세포외 신호전달에 이르기 까지 잘 보존되어 있다(Saito, 2010).
다세포로 이루어진 진균(곰팡이)의 경우 Aspergillus nidulans의 경우와 같이 유전학적, 분자생물학적 연구가 잘 되어져 있는 모델시스템이 있으며 다년간에 걸친 연구에 따르면 진균의 분화는 이차대사산물의 생성과 밀접하게 연관되어 있음이 밝혀져 왔다(Yu, 2010). 이러한 이차대사산물들 가운데에는 인간의 건강이나 영양에 영향을 줄 수 있는 진균독소 등이 포함되어 있으므로 많은 연구가 이루어져 왔다. 최근의 연구결과에 따르면 진균의 분화 및 이차대사물질 생산은 유전적 조절뿐만 아니라 다양한 외부환경, 즉 빛, 영양성분, 산소의 농도 등에 많은 영향을 받으며 이들 외부환경의 존재여부에 따라 내부신호를 조절하는 조절기작이 있음이 알려지게 되었다(그림. 1). 이러한 조절기작은 VeA 단백질을 중심으로 한 velvet 복합체가 주로 담당하고 있다(Kim et al., 2002). 이 복합체의 핵심인 VeA 단백질과 이를 암호화하는 veA 유전자에 대한 연구는 애초에 1968년부터 veA1 돌연변이 균주가 분리되어 사용되어온 데에서 기인한다. 이 veA1 유전자 돌연변이는 유성분화를 억제하고 무성분화를 촉진하여 당시 주된 연구테마였던 대사과정 연구 및 무성포자 형성과정 연구 등에서 매우 유용하게 사용되어왔으나 그 유전자를 클로닝하는데에는 많은 시간이 필요하였다. 2002년에 국내 연구진에 의하여 veA 유전자가 클로닝되었고 veA1 돌연변이의 정체와 그 특성을 이해할 수 있게 되었는데 결과적으로 이 유전자 및 유전자산물은 유성생식와 무성생식의 균형잡힌 분화단계를 조절하며 이 과정에서 빛을 감지하여 신호를 전달하는데 필수적인 구성요소임을 알 수 있었다(Kim et al., 2002).
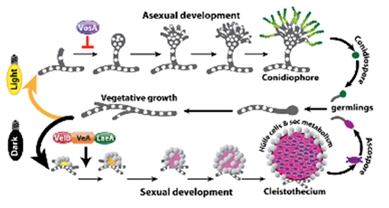
그림 1. 모델 사상성 진균 Aspergillus nidulans의 생활사에서 빛에 의한 분화조절과 velvet 복합체의 관계. 빛이 없을떄 VelB-VeA-LaeA 복합체에 의해 주로 유성분화가 유도됨을 알 수 있다(Sarikaya-Bayram et al., 2013).
최근의 연구들에 의하면 유성분화 및 그 결과로 얻어지는 자실체 생성의 경우 주로 빛이 없는 어두운 조건에서 촉진되고, 빛을 쪼여주면 자실체의 양이 줄어드는 반면, 무성생식으로 인한 무성포자의 형성은 증가하게 되는데 이러한 패턴은 VelB-VeA-LaeA 단백질로 구성된 핵내 velvet 복합체의 감소와 관계가 많다(Bayram et al., 2008). VelB와 VeA는 이량체(heterodimer)로 포유동물의 NF-kB와 구조적으로 유사한 velvet DNA-binding domain을 형성하며 VeA 단백질이 VelB와 LaeA간의 결합을 중재하는 역할을 한다. 이 velvet DNA-binding domain은 기존에는 알려져 있지 않던 DNA-binding domain으로 NF-kB와 아미노산 서열로는 상동성이 없지만 삼차원 구조를 비교했을 때 DNA 결합부위가 매우 유사함을 알 수 있었고 이를 통하여 진균에서 특이적으로 존재하는 DNA-binding 단백질과 이를 통한 전사조절기작이 밝혀지게 되었다(Ahmed et al., 2013; 그림. 2) LaeA는 MTase의 하나로 진균의 이차대사산물 생산과 유성분화 관련 기작을 조절하는 핵심 단백질로 알려져있다. 따라서, 이러한 velvet 복합체는 유성분화와 이차대사산물생산을 동기화(synchronize) 할 수 있는데 이는 빛 수용체에서 전달된 빛 신호에 의해 결정된다. 즉, velvet 복합체가 핵으로 이동되는 비율은 VeA 단백질이 빛 수용체인 phytochrome에 결합하는지의 여부에 의해 결정된다. VeA는 암(darkness)조건일 때 핵으로 이동되며 명(light)조건일떄는 핵으로의 이동이 제한된다. 실제로 앞서 언급한 veA1 돌연변이의 경우 유전자 앞부분에 점 돌연변이가 있어 N-말단이 일부 절단된 단백질을 생산하게 되는데 이 경우 N-말단에 존재하는 핵위치신호(NLS) 부위가 손상되어 빛의 존재여부에 상관없이 VeA 단백질의 핵 이동이 제한되게 되므로써 일어나는 현상임이 밝혀졌다(Bayram et al., 2008; 그림. 3).
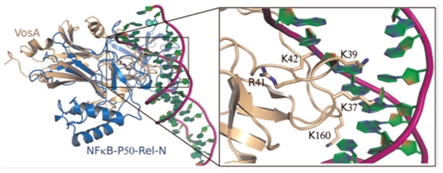
그림 2. Velvet 패밀리 단백질 VosA의 DNA-binding 부위와 NF-kB와의 구조 비교. 두 단백질이 구조적으로 많은 유사점이 있음을 알 수 있다(Ahmed et al., 2013).
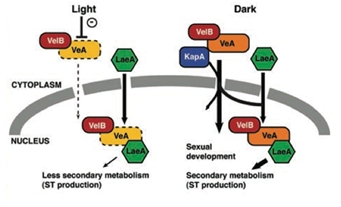
그림 3. 빛에 의한 유성분화 및 이차대사산물의 조절기작 모델. 빛이 없을 때 VelB-VeA heterodimer가 핵으로 잘 이동하여 LaeA와 결합 후 유성분화와 이차대사산물생성을 촉진한다(Bayram et al., 2008)
이렇듯, 국내 연구진에 의해 최초로 밝혀진 veA 유전자는 추후 다양한 진균에서 발견되었고 대부분 보존된 기능을 수행하는 것으로 알려지기 시작하였다. 현재 VeA 단백질을 매개로 빛 감지와 유성분화 및 이차대사물질 생산 조절 메카니즘은 많은 연구가 계속되고 있다. 초창기 국내 연구진들은 이러한 veA 유전자의 다양한 기능을 확인하고 VeA 단백질과 상호작용하거나 결합하여 작용하는 다른 단백질들이 있을 것으로 예상하고 yeast two hybrid(Y2H) 실험을 통하여 상호작용 단백질을 조사한 결과 최소한 3개의 유전자산물이 VeA 단백질과 결합한다는 결과를 확보하고 이들을 각각 vipA-C(veA interacting protein)로 명명하고 그 특성을 연구한 바 있다. 그 결과 vipA 유전자산물은 phytochrome 결합 도메인을 가지고 있는 밝혀지지 않은 유전자였고 vipB와 vipC는 메칠전이효소 도메인을 가지고 있는 것이 밝혀졌다. 그 당시에는 VeA와 LaeA간의 결합이 알려지지 않은 시기였으므로 왜 VeA와 서로 다른 MTase들이 결합해야 하는지 정확히 이해하기 힘들었다. 그러나 최근 보다 정교한 실험을 통하여 이러한 MTase가 세포막에서 핵으로 세포의 신호를 전달하는데 직접적인 기능을 수행하는 것이 밝혀지게 되었다.
Sarikaya-Bayram 등(2014)에 의하면, Y2H 뿐만 아니라 coimmunoprecipitation(coIP), bimolecular fluorescence complementation(BIFC)에 의해서도 VipC-VeA 결합이 확인되었다. 게다가 VipC는 또다시 두 개의 Vap(VipC-associated proteins)가 결합하여 VapA-VipC-VapB 복합체를 형성하는 것을 알게 되었다(그림. 4). 이들 중 VapA는 FYVE-like ZF 도메인을 가지고 있었는데 이 도메인는 DNA 보다는 세포막의 지질에 결합하여 membrane trafficking이나 신호전달 기능을 수행하는 것으로 알려져 있으며 실제로 BIFC 실험결과 VapA는 세포막에 결합하는 사실을 확인하였다. 반면 VapB는 SAM methyltransferase domain을 가지고 있는 MTase의 일종으로 밝혀졌으며 흥미롭게도 이 단백질은 기존에 국내 연구진에 의해서 연구된 smtA라는 유전자 산물과 동일한 것이었다. BIFC 결과에서는 VipC-VapB heterodimer는 세포막에도 존재하지만 일부는 핵내에도 존재하는 것이 드러나서, VapA-VipC-VapB 복합체는 아마도 VapA에 의해 세포막에 존재하다가 특정 신호에 의해 VapA에서 분리된 VipC-VapB복합체가 핵으로 이동하는 가설을 세울 수 있었다.
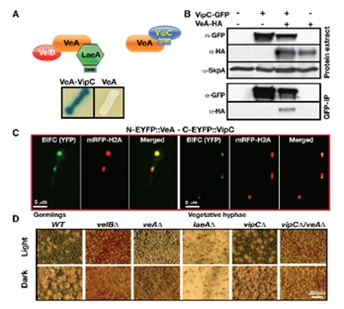
그림 4. VeA과 VipC의 상호작용. Y2H (A), CoIP (B), BIFC (C) 등의 실험을 통하여 두 단백질이 세포내에서 결합함을 확인하였고, 각각의 돌연변이들은 유성생식에 변화가 있음을 알 수 있다(D)(Sarikaya-Bayram et al., 2014).
각 유전자의 돌연변이 형질을 검토한 결과 비록 어떤 신호가 VapA와 VipC-VapB 상호작용을 약화시키는지는 밝혀지지 않았지만, 특정 신호가 전달되기 전까지는 VapA가 세포막에서 VipC와 VapB를 잡고 있어 이들의 분화관련 기능을 억제할 수 있도록 하다가 VipC-VapB가 VapA로부터 분리되어 핵으로 이동하게 되면 무성분화를 촉진함과 동시에 유성분화를 억제하는 기능을 수행하게 되며 VipC-VapB 뿐만 아니라 VipC-VeA 상호작용의 변화가 이러한 형질변화에 기여할 것으로 예상할 수 있다.
VipC-VapB heterodimer가 VapA로부터 분리되어 핵으로 들어가서 유전자 발현에 영향을 주는지 알아보기 위하여 VapA 돌연변이에서 몇 가지 분화에 관련된 중요한 유전자 발현 패턴을 비교해보았는데, 이는 VapA가 제거된 돌연변이에서는 VipC-VapB heterodimer가 훨씬 더 핵에 많이 들어가 있기 때문이다. 따라서 정상보다 많은 양의 VipC-VapB가 유전자 발현양상의 변화를 줄 수 있을 가능성이 있으며 실제로 이러한 상황에서 무성분화에 중요한 brlA와 abaA 유전자 발현량이 증가하였는데 이는 VipC-VapB가 무성분화의 활성화에 깊은 관여를 한다는 것을 알 수 있다. 일단 VipC-VapB dimer가 핵내로 들어가면 이들은 VeA와 물리적인 결합을 한다는 것이 CoIP나 BIFC 실험으로 밝혀졌다. 즉 핵내에서는 VipC-VeA-VapB 복합체가 형성되는 것이다. 흥미로운 점은 이렇게 핵내로 옮겨진 두 MTase는 heterochromatin 분포에 영향을 줄 수 있는 것이 드러났다. 특히 VapB의 경우 과발현을 시키면 H3K9me3를 50% 감소시키는 것이 밝혀졌고 vapA 돌연변이의 경우 VipC-VapB의 핵내 이동을 촉진시키는데 이때에도 H3K9me3 히스톤 마커의 레벨이 낮아지는 것을 관찰할 수 있다. 결론적으로 이러한 epigenetic 조절기작을 통하여 무성분화를 촉진하고 유성분화를 억제할 수 있을 가능성이 제기되는 것이다. 유전학적 모델(그림. 5)을 보면, 세포외부에서의 특정신호(아직 밝혀지지는 않았지만)에 의하여 VapA-VipC-VapB heterotrimer가 분리되어 VipC-VapB heterodimer가 핵으로 이동하게 되면 VelB-VeA의 핵내 이동을 억제하고 핵내에서 VipC-VeA-VapB heterotrimer를 형성함으로써 유성분화를 억제함과 동시에 VipC-VapB heterodimer는 H3K9me3 레벨을 저하시키면서 무성분화를 촉진하는 기작을 수행한다고 설명되어진다(Sarikaya-Bayram et al., 2014; 그림. 5).
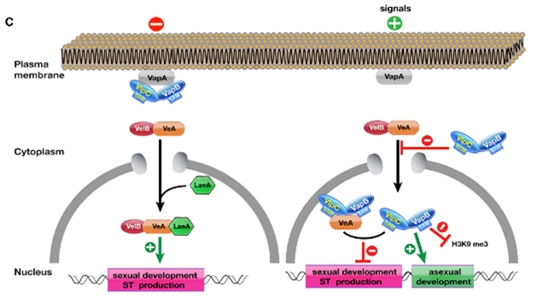
그림. 5. VapA-VipC-VapB 복합체의 기능에 대한 유전학적 모델. 이들은 세포외부의 신호를 받아 VipC-VapB가 핵으로 이동하면서 분화, 이차대사산물생산 그리고 epigenetic 조절기작을 수행하는 것으로 제안되고 있다(Sarikaya-Bayram et al., 2014).
결론적으로, 최근의 리뷰를 참고하면(Sarikaya-Bayram et al., 2015), 하나의 중계 단백질인 VeA 에 최소한 4개의 서로 다른 MTase 단백질들이 각각의 서로 다른 상황에서 존재하면서 상호작용을 하는 것임을 볼 수 있다. 이들은 이차대사산물 조절에 매우 중요한 LaeA가 포함되며, 그 외에 최근 알려진 VipB, VipC, VapB가 있으며 이들이 각각의 특이적인 환경에서 서로 다르게 결합하는 조건에 따라 유성분화, 무성분화, 이차대사산물 생성의 비율과 패턴이 달라진다. 그림. 6에서 보듯이 외부환경조건의 변화를 감지하고, 관련된 유전자들의 발현을 조절할 뿐만 아니라 epigenetic control을 통하여 세포의 반응을 이끌어내는 총체적인 신호전달기작이 VeA 및 관련된 MTase들이 수행한다는 새로운 사실을 알 수 있다.
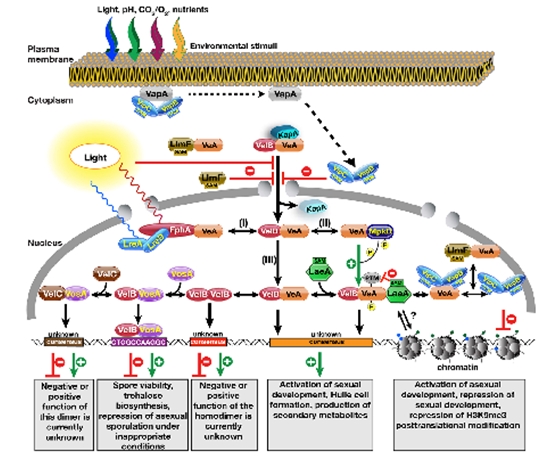
그림. 6. VeA 단백질과 결합하는 4개의 methyltransferases (LaeA, VipB, VipC, VapB)의 세포내 조절기작(Sarikaya-Bayram et al., 2015).
참고문헌
1. Hong, E., Lim, Y., Lee. E., Oh. M., and Kwon. D. (2012) Tissue-specific and age-dependent expression of protein arginine methyltransferase (PRMTs) in male rat tissues. Biogerontology 13: 329-336.
2. Saito, H. (2010) Regulation of cross-talk in yeast MAPK signaling pathways. Curr. Opin. Microbiol. 64: 585-610.
3. Yu, J. (2010) Regulation of development in Aspergillus nidulans and Aspergillus fumigatus. Mycobiol. 38: 229-237.
4. Kim, H., Han, K., Kim, K., Han, D., Jahng, K., Chae, K. (2002) The veA gene activates sexual developmentin Aspergillus nidulans. Fungal Genet. Biol. 37: 72-80.
5. Ahmed, Y., Gerke, J., Park, H., Bayram, O., Neumann, P., Ni, M., Dickmanns, A., Kim, S., Yu, J., Braus, G., Ficner, R. (2013) The velvet family of fungal regulators contains a DNA-binding domain structurally similar to NF-kB. PLoS Biol. 11: e1001750.
6. Sarikaya-Bayram, O., Bayram, O., Valerius, O., Park. H., Irniger, S., Gerke, J., Ni. M., Han, K., Yu, J., Braus, G. (2013) LaeA control of velvet family gulatory proteins or light-dependent development and fungal cell-type specificity. PLoS Genet. 6: e1001226.
7. Bayram, O., Krappmann, S., Ni, M., Bok, J., Helmstaedt, K., Valerius, O., Braus-Stromeyer, S., Kwon, N., Keller, N., Yu, J., Braus, G. (2008) VelB/VeA/LaeA complex coordinates light signal with fungal development and secondary metabolism. Science 320: 1504-1506.
8. Sarikaya-Bayram, O., Bayram, O., Feussner, K., Kim, J., Kim, H., Kaever, A., Feussner, I., Chae, K., Han, D., Han, K., Braus, G. (2014) Membrane-bound methyltransferase complex VapA-VipC-VapB guides epigenetic control of fungal development. Dev. Cell 29: 406-420.
9. Sarikara-Bayram, O., Palmer, J., Keller, N., Braus, G., Bayram, O. (2015) One Juliet and four Romeos: VeA and its methyltransferases. Frontiers in Microbiol. 6: 1-7.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 진균에서 발견된 새로운 기능의 메틸전이효소들과이에 의한 분화...
진균에서 발견된 새로운 기능의 메틸전이효소들과이에 의한 분화...