기술동향
Class III ADH 활성억제를 통한 간섬유화 치료기법 개발
- 등록일2016-04-05
- 조회수7408
- 분류기술동향
-
자료발간일
2016-03-31
-
출처
지능형 바이오시스템 설계 및 합성연구단
- 원문링크
-
키워드
#간섬유화 치료기법#간성상세포#간섬유화#자연살해세포#Class III ADH
- 첨부파일
출처 : 지능형 바이오시스템 설계 및 합성연구단
Class III ADH 활성억제를 통한 간섬유화 치료기법 개발

한국과학기술원 의과학대학원 정원일 교수
1. 개요
간섬유화(liver fibrosis)는 만성 간내 염증으로 인한 세포외 기질 (extracellular matrix)의 과다한 침착으로 정의되며, 이러한 세포외 기질의 만성적인 축적으로 인한 간내 미세 구조의 변형, 기능적 간세포의 감소 및 소실을 야기하는 간경변증 (liver cirrhosis)으로까지 진행된다. 간염바이러스, 약물중독 및 과다한 알코올 섭취와 같은 다양한 원인으로부터 야기되는 간질환이 만성화되면 간섬유화를 유도하며, 음주에 있어서 상대적으로 관대한 문화를 갖고 있는 한국의 경우 많은 성인 남성들이 다양한 수준의 간질환에 따른 간섬유화로 고통 받고 있으며, 이를 완치할 수 있는 치료제의 개발이 시급하다고 할 수 있겠다.
간섬유화를 유발시키는 데에 있어서 매우 중요한 역할을 하는 세포는 간성상세포들(hepatic stellate cells)이며, 이들 세포들은 특이적으로 간세포와 혈관세포 사이의 아주 좁은 공간인 Space of Disse에 존재하고 있다. 정상적으로 간성상세포는 우리 몸의 약 80%에 해당하는 레티놀 (Vitamin A lipid droplet)을 함유하고 있으며 신체내 레티놀(vitamin A) 항상성조절에 관여를 한다. 그러나 간손상과 같은 지속적 외부 자극에 의해 가지고 있던 레티놀을 소실하게 되며 동시에 활성화가 진행되어 콜라겐과 같은 세포외 기질의 합성 및 분비를 촉진시킴으로써 간섬유화를 유도하게 된다. 이와 같이 간성상세포가 레티놀 저장과 세포외 기질의 생성에 중요한 세포로 알려져 있지만, 여전히 세포외기질의 합성기전 및 레티놀의 대사에 관해서는 많이 규명되지 않았다.
하지만, 최근 다양한 수준의 연구를 통하여 간성상세포는 단순히 세포외 기질을 생산하는 역할 뿐만 아니라, 다양한 수준의 면역세포 및 간내 실질세포와의 끊임없는 상호 작용을 통해 communication을 하고 있다는 것을 알게 되었다 (Fig. 1). 특히, 간내에 존재하는 임파구들 중 자연살해세포 (Natural Killer cell: NK cell)는 마우스에서는 약 10%, 그리고 사람에게서는 약 30% 정도의 많은 부분을 차지하고 있다고 알려져 있다 (Racanelli & Rehermann, 2006). 최근 간내에 존재하는 자연살해세포의 활성이 간성상세포와의 상호작용을 통해 간섬유화를 억제하는데 있어서 효과적인 치료법이 되며, 이를 이용하여 자연살해세포를 이용한 치료법의 가능성을 제시하였다 (Jeong, Park, Radaeva, & Gao, 2006).
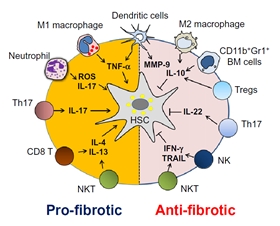
Fig. 1. 간성상세포와 다양한 면역세포들 간의 상호작용에 의한 간섬유화 조절기작. 섬유화를 촉진시키는 세포들은 M1 대식구, 호중구, Th17세포, CD8 T세포 및 NKT세포들이며 반대로 항섬유화 기능을 하는 세포들은 M2 대식구, 골수세포, Treg, NK 및 NKT 세포들로 알려짐 (Yi and Jeong, 2013, Journal of Gastroenterology and Hepatology)
이때 활성화된 간성상세포와 자연살해(NK) 세포간의 상호작용에 있어서 레티놀 대사체(retinoic acid)가 중요한 역할을 한다고 알려졌으나, 간성상세포의 어떤 효소가 레티놀 대사에 관여를 하며 또한 간성상세포의 활성화시 소실되는 레티놀은 그 주변에 존재하는 자연살해 세포에게 어떠한 영향을 주는 지 알려져 있지 않았다. 본 연구에서는 간성상세포와 자연살해세포에서 레티놀 대사에 중요한 역할을 하는 효소과 그 기능을 밝히고 간섬유화 치료에 어떤 의미를 가지는 지 연구를 실시한 바, 두 세포들에서 class III alcohol dehydrogenase (ADH3)가 레티놀 대사를 유도하며 이의 억제시 간섬유화의 호전을 관찰하였다.
2. 간성상세포의 레티놀 대사 및 간섬유화
레티놀은 생체에서 레티알데하이드 (retinaldehyde) 및 레티노익산 (retinoic acid)으로 변환되며, 생체 내에서 몇 개의 유도체가 발견되고 합성되기 때문에 통틀어 레티노이드 (retinoid)라고 부르고 있으며, 발생기에 세포의 정상적인 분화 및 유도에 필수적인 성분으로 알려져 있다. 최근 다양한 연구결과를 바탕으로 단순히 레티놀은 세포의 분화에 관여할 뿐만 아니라, 다양한 면역반응의 유도 및 인슐린 저항성과 같은 대사 질환의 진행에 있어서 중요한 역할을 한다고 알려져 있다 (Mucida et al., 2007;Tsuchiya et al., 2012;Ziouzenkova et al., 2007). 레티놀은 알코올 분해효소들 (alcohol dehydrogenases: ADHs)로 인해 레티알데하이드로 대사되며, 또다시 레티알데하이드 분해효소 (retinaldehyde dehydrogenases: Raldhs)에 의해 레티노익산(retinoic acid)으로의 대사 과정을 겪는다. 이렇게 대사된 레티노익산은 세포내 핵수용체인 RARs/RXRs들과 결합하여 다양한 gene expression을 이끌어 낸다고 잘 알려져 있다 (Fig. 2).
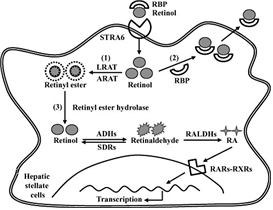
Fig. 2. 간성상세포에서의 레티놀의 대사과정. 간성상세포가 활성화 될 때, 레티놀은 alcohol dehydrogenase (ADHs)와 short- chain dehydrogenase (SDR) 에 의해 대사되어 레티날로 대사되며, 또한 retinaldehyde dehydrogenase (RALDHs)에 의해 레티노익산으로 대사된다 (Lee and Jeong, 2012, Journal of Gastroenterology and Hepatology).
주로 알코올 분해효소 (ADH)가 레티놀을 대사시키는데 있어서 매우 중요한 역할을 한다고 알려져 있으며, 특히 class I, class IV, 그리고 class III가 레티놀 대사에 있어서 중요한 효소로 잘 알려져 있다. 본 연구에서는 레티놀을 많이 함유하고 있는 간성상세포에서 레티놀의 대사를 주로 담당하는 효소가 ADH3 인 것을 확인하였고, 자연살해세포에서도 간성상세포와 마찬가지로 ADH3를 주로 발현하는 것을 확인하였다. 따라서 본 연구팀은 간섬유화 모델에서 ADH3의 억제를 통해서 간성상세포 및 자연살해세포의 ADH3 역할에 대해 실험을 진행하였다. 그 결과 ADH3가 간성상세포의 활성화를 유도하고 자연살해세포에서는 인터페론-감마의 생산을 감소시키는 것을 확인할 수가 있었다. 또한 사염화탄소 (carbon tetrachloride) 및 총담관 결찰 (bile duct ligation)을 통한 마우스 간섬유화 모델에서 ADH3의 역할을 규명하였으며, ADH3 결손 마우스는 대조군과 비교했을 때, 상대적으로 간섬유화의 진행이 억제된 것을 면역조직 염색 및 콜라겐 염색을 통해 확인할 수 있었다 (Fig. 3).
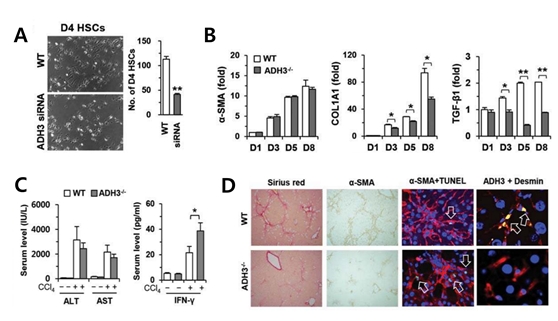
Fig. 3. ADH3의 결손은 간성상세포의 활성화를 억제시키고, 인터페론-감마의 생산을 증가시킴으로써 간섬유화의 진행을 억제하는데 중요한 역할을 수행한다.
놀랍게도 본 연구팀은 ADH3 결손 마우스에서 활성화된 간성상세포를 억제하거나 사멸시킬 수 있는 인터페론-감마를 분비하는 자연살해세포의 숫자 및 분율이 크게 증가해 있는 것을 관찰하였고, 이들 마우스에서 혈청 인터페론-감마 농도 또한 현저하게 증가되어 있는 것을 확인함으로써 ADH3의 발현에 따른 자연살해세포의 역할이 중요함을 확인할 수가 있었다. 이러한 발견을 뒷받침하기 위해서 wild type 및 ADH3 결손 골수세포를 이용하여 chimeric mouse를 제작하였고, 간성상세포의 ADH3가 결핍되었을 때 간섬유화의 진행이 감소되었으며, 자연살해세포의 ADH3가 결손되었을때도 비슷한 정도의 간섬유화가 억제되어있음을 확인함으로써 ADH3의 발현이 간섬유화의 진행에 있어서 매우 중요한 역할을 수행하고 있음을 실험적으로 증명할 수가 있었다.
3. 4-methylpyrazole (4-MP)의 간섬유화 진행 억제 기전
4-methylpyrazole (4-MP)은 비특이적으로 알코올 대사효소(ADH)를 억제하는 기능을 가진 물질로 현재 임상에서 에틸렌글리콜 및 메탄올 중독 환자의 치료로 사용되고 있으며 또한 세포 수준에서도 알코올 대사효소를 억제하는 보고가 존재한다 (Baud et al., 1988; Brent et al., 2001; Brent et al., 1999). 따라서 본 연구에서 4-MP의 광범위한 ADH효소 억제기능을 이용하여 간성상세포 및 자연살해세포에서 레티놀 대사에 관여하는 ADH3를 억제하여 간섬유화의 새로운 치료 물질로서의 가능성을 검증하고자 하였다. 실험동물 모델을 구축하기 위해서 사염화탄소 및 총담관결찰을 이용하여 간섬유화 모델을 만들고, 체내에서의 알코올 대사효소를 억제하기 위해 마우스 복강에 4-MP를 투여하였다. 10 μg/g 농도의 4-MP가 간섬유화 마우스 모델에서 항섬유화 효과를 기대하기 위해 사용되었고, 4-MP 투여 후 간섬유화의 진행이 현저하게 감소되었음을 간조직의 collagen 염색 및 alpha smooth muscle actin의 발현을 통해서 확인할 수가 있었다. 또한 4-MP에 의하여 알코올 대사효소(ADH3)가 억제되었을 때 간내 자연살해세포의 interferon-gamma의 발현의 증가, 활성화된 간성상세포의 억제 및 사멸을 확인함으로써 본연구팀은 간섬유화에 대한 4-MP의 항섬유화 기능을 가진 약제로서의 가능성을 제시할 수가 있었다.
4. 고찰
본 연구결과를 정리하면 Fig. 4와 같이 간성상세포가 레티놀을 대사하는 효소인 ADH3를 주로 발현하고 ADH3 의존적으로 레티놀 대사를 통해서 간성상세포가 활성화되는 반면, 활성화된 간성상세포를 억제하는 역할을 하는 자연살해세포의 경우에도 ADH3가 발현되는데, 이 세포는 간성상세포와 반대로 ADH3 에 의한 레티놀 대사가 세포의 기능을 억제시켜 결과적으로 활성화된 간성상세포에 대한 NK 세포독성이 저하되는 것을 관찰하였다. 결과적으로 레티놀 대사 효소인 ADH3가 간성상세포와 자연살해세포에서 발현하는데, 간성상세포에서는 positive regulator로서의 기능을, 자연살해세포에서는 negative regulator로서 작용함으로써, 결과적으로 간섬유화를 촉진시키는 것을 확인할 수 있었다. 따라서 간성상세포 및 자연살해세포의 ADH3 조절을 간섬유화 억제에 대한 새로운 치료학적 타겟으로 제시하고자 한다.
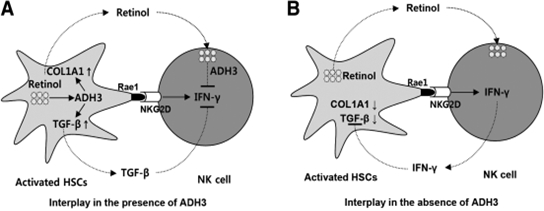
Fig. 4. 간섬유화의 진행에 있어서 세포 특이적 ADH3 발현의 역할. ADH3의 발현은 간성상세포의 활성화를 유도시키고 활성화된 RAE-1의 발현은 자연살해세포의 동원을 촉진시키게 된다. 하지만, ADH3의 발현이 일어나지 않을 경우, 간성상세포의 콜라겐 및 TGF-β의 발현이 현저하게 감소하게 되고, 간성상세포에 의해 활성화된 자연살해세포는 더욱 증가된 인터페론-감마의 생산을 유도함으로써 간섬유화의 진행을 억제시키는 역할을 하게 된다.
5. 참고문헌
Baud,F.J.,M.Galliot,A.Astier,D.V.Bien,R.Garnier,J.LikformanandC.Bismuth(1988)."Treatmentofethyleneglycolpoisoningwithintravenous4-methylpyrazole."NEnglJMed319(2): 97-100.
Brent, J., K. McMartin, S. Phillips, C. Aaron, K. Kulig and G. Methylpyrazole for Toxic Alcohols Study (2001). "Fomepizole for the treatment of methanol poisoning." NEnglJMed344(6): 424-429.
Brent, J., K. McMartin, S. Phillips, K. K. Burkhart, J. W. Donovan, M. Wells and K. Kulig (1999). "Fomepizole for the treatment of ethylene glycol poisoning. Methylpyrazole for Toxic Alcohols Study Group." NEnglJMed340(11): 832-838.
Jeong, W. I., O. Park, S. Radaeva and B. Gao (2006). "STAT1 inhibits liver fibrosis in mice by inhibiting stellate cell proliferation and stimulating NK cell cytotoxicity." Hepatology44(6): 1441-1451.
Lee, Y. S. and W. I. Jeong (2012). "Retinoic acids and hepatic stellate cells in liver disease." JGastroenterolHepatol27 Suppl 2: 75-79.
Mucida, D., Y. Park, G. Kim, O. Turovskaya, I. Scott, M. Kronenberg and H. Cheroutre (2007). "Reciprocal TH17 and regulatory T cell differentiation mediated by retinoic acid." Science317(5835): 256-260.
Racanelli, V. and B. Rehermann (2006). "The liver as an immunological organ." Hepatology43(2 Suppl 1): S54-62.
Tsuchiya, H., Y. Ikeda, Y. Ebata, C. Kojima, R. Katsuma, T. Tsuruyama, T. Sakabe, K. Shomori, N. Komeda, S. Oshiro, H. Okamoto, K. Takubo, S. Hama, K. Shudo, K. Kogure and G. Shiota (2012). "Retinoids ameliorate insulin resistance in a leptin-dependent manner in mice." Hepatology56(4): 1319-1330.
Weiskirchen, R. and F. Tacke (2014). "Cellular and molecular functions of hepatic stellate cells in inflammatory responses and liver immunology." HepatobiliarySurgNutr3(6): 344-363.
Ziouzenkova, O., G. Orasanu, M. Sharlach, T. E. Akiyama, J. P. Berger, J. Viereck, J. A. Hamilton, G. Tang, G. G. Dolnikowski, S. Vogel, G. Duester and J. Plutzky (2007). "Retinaldehyde represses adipogenesis and diet-induced obesity." NatMed13(6): 695-702.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 Class III ADH 활성억제를 통한 간섬유화 치료기법 개발_정원일 ...
Class III ADH 활성억제를 통한 간섬유화 치료기법 개발_정원일 ...