기술동향
조혈줄기세포(Haematopoietic stem cell) 생성을 위한 연구 진척
- 등록일2016-12-01
- 조회수9115
- 분류기술동향
-
자료발간일
2016-11-22
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#조혈줄기세포#줄기세포#Haematopoietic stem cell
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
조혈줄기세포(Haematopoietic stem cell) 생성을 위한 연구 진척
저자 : 한민준 (St. Jude Children’s Research Hospital)
요약문
유도만능줄기세포(induced pluripotent stem cell, iPS cell/iPSC)를 포함하여 여러 가지 줄기세포를 이용한 조혈줄기세포(haematopoietic stem cell)의 새로운 생성은 혈액학과 재생의학의 가장 중요한 과제입니다. 현재, 생체 이식 후의 완전한 생착(engraftment)과 multi-lineage 잠재력에서 결정적인 역할을 하는 기능성 조혈줄기세포를 효율적으로 유도하는 것은 어려운 과제로 남아있습니다. 우리는 여기서 최근의 조혈줄기세포 생성의 진행사항과 과거의 장애물을 극복한 사항들을 논의하고자 합니다. 또한 유도만능줄기세포의 잠재력과 성숙한 혈액 혈통 lineage 안에서의 유망한 발전에 대해서도 살펴보고자 합니다.
본 자료는 Progress towards generation of human haematopoietic stem cells. Nat Cell Biol. 2016 Nov;18(11):1111-1117 의 논문을 한글로 번역, 요약한 자료입니다.
목 차
1. 서론
2. 조혈줄기세포생성
2.1 테라토마에서 분리
2.2 직접분화(Directed differentiation)
2.3 역분화(Direct conversion)
3. 혈액세포 생성(Manufacturing blood cell products in vitro)
3.1 적혈구 생성(Red blood cells)
3.2 혈소판 생성(Platelets)
3.3 성체 골수단구세포 생성(Myelomonocytic cells)
4. 유도만능줄기세포 기반의 질환 모델의 잠재성
5. 향후 전망
6. 결론
1. 서론
모든 혈액의 발생과 유지는 성인의 골수에 존재하는 극소수의 조혈줄기세포에 의지하고 있습니다(그림 1). 골수(bone marrow)유래, 혈액(mobilized peripheral blood)유래, 혹은 제대혈(umbilical cord blood, UCB)에서 유래된 조혈줄기세포의 이식은 여러 유전적 질병 혹은 악성 질환 치료의 기준으로 사용되어 왔습니다. 하지만 조직 적합성 항원(Human Leukocyte Antigen, HLA) 일치 제공자에 따른 제한적인 가능성은 여전히 커다란 당면과제로 남아있습니다. 제대혈(UCB)의 특성상 항원 비적합성에도 불구하고 이식을 가능하게는 해주었지만 상대적으로 적은 수의 조혈줄기세포의 양은 생착을 지연시킬 수도 있고 이식 후 생착에 여러 가지 문제를 야기할 수도 있습니다. 체외에서의 제대혈 조혈줄기세포를 늘릴 수 있는 세포배양 방법이 여러 가지로 연구되어 왔지만 여전히 현재의 방법으로는 그다지 많지 않은 양의 장기적인 조혈줄기세포(long-term haematopoietic stem cell)의 증가에 만족해야 합니다. 결과적으로 줄기세포로부터 만들 수 있는 조혈줄기세포의 새로운 방법이 이 분야의 중요한 목표가 되었습니다.
줄기세포의 특징이라 함은 자기복제(self-renewal)능력과 모든 계통의 세포로의 분화가 가능한 다분화능을 포함하고 있습니다. 맨 처음 인간에게서 유래된 줄기세포는 1998년에 만들어졌고, 약 10년 후 체세포인 섬유아세포를 역분화하여 유도만능줄기세포가 만들어져 현재 세포치료 재생의학의 근간을 이루는 커다란 2개의 진일보가 이루어졌습니다. 인간 유도만능줄기세포는 환자에게서 유래된 전체 유전체를 그대로 가지고 있을 뿐만 아니라 이론적으로 질병의 모델, 치료제의 스크리닝 혹은 조혈줄기세포의 이식에 사용할 수 있는 세포들을 끊임없이 공급해줄 수 있기 때문에 질병의 연구와 치료에 강력한 도구로 사용될 수 있습니다. 최근의 연구 보고서들은 이러한 줄기세포에서 유래된 조혈줄기세포의 생성에 대하여 여러 가지 심도 있는 보고를 제공하고 있습니다. 이 논문에서는 특별히 현재 새로운 조혈줄기세포의 생성에 관한 이해와 미래의 응용 접근법에 초점을 맞추고자 합니다. 또한 임상에 사용될 수 있는 적합한 조혈줄기세포 분화 방법에 대해 이야기 하고자 합니다.
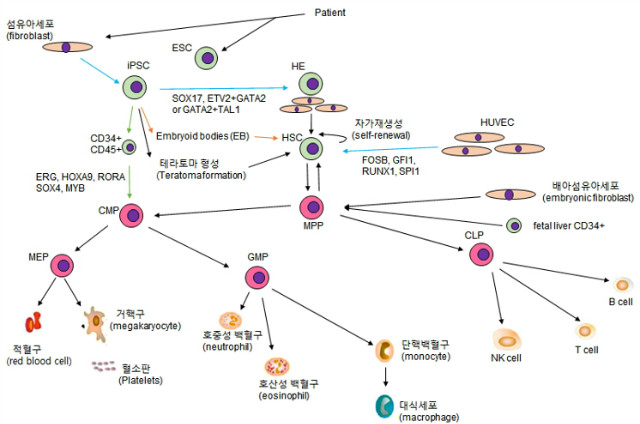
그림 1. 조혈기관 계통 모식도
2. 조혈줄기세포생성
조혈줄기세포 형성을 위한 몇 가지 전략들이 그 동안 개발되어 왔으며 여기서 대표적인 몇 가지 방법들을 살펴보고자 합니다.
2.1 테라토마에서 분리
유도만능줄기세포에서 유래된 테라토마(teratoma)에서 성공적으로 조혈줄기세포를 분리할 수 있다는 논문들은 원칙적으로 인간줄기세포가 특정한 실험 조건 하에 조혈줄기세포로의 분화가 가능하다는 것을 말해주고 있습니다. 이러한 실험들에서는 유도만능줄기세포를 면역결핍마우스에 피하주사 후 생성된 테라토마에서 조혈줄기전구세포의 마커로 알려진 CD34+CD45+가 성공적으로 분리되는 것을 보여주었습니다(그림 1). 처음의 연구에서는 이러한 전구세포들이 비록 매우 적은 양이지만 생착 가능성을 보여주었습니다. 두 번째 연구 그룹에서도 비슷한 현상이 보고되었고 유도만능줄기세포와 기질세포(stromal cell)를 함께 마우스에 주입해 주었을 경우 테라토마에서 유래된 전구세포 형성 효율이 더 좋아진다는 것이 보고되었습니다.
2.2 직접분화(Directed differentiation)
조혈계(Haematopoietic system)는 확연하게 다른 원시 단계(primitive stage)와 확정 단계(definitive stage)로 대표되는 연속적인 발생 단계로 이루어집니다. 먼저, 초기 배아의 원시단계에서 이루어지는 혈액생성은 일시적인 발생이며 대부분 핵을 가지고 있는 적혈구와 골수성 세포로 이루어집니다. 이러한 원시단계 발생은 궁극적으로 태아의 간과 골수에서 발생되는 확정단계로 역전됩니다. 확정단계에서는 원시단계에서와는 달리 림프성 혈액과 장기적인 혈액줄기세포(long-term stem cell)의 생성을 담당하게 됩니다. 현재까지 대부분의 연구는 줄기세포를 이용한 조혈줄기세포의 생성에 많은 역량을 쏟아붓고 있습니다. 이것은 “직접분화”로 명명되어진 체외에서의 발생과 분화를 모식적으로 연구하는데 초점이 맞추어져 있습니다(표 1).
최근의 가장 클래식한 분자적 관점의 혈액생성의 제어에 관한 연구동향은 조혈전구세포(haematopoietic progenitor)의 생착과 성장을 유도하는 특이한 homebox (Hox) gene에 관한 연구입니다. Hoxb4의 발현은 마우스 배아 줄기세포를 이용한 많은 다양한 세포배양 조건에서 자기 재생성(self-renewal)과 다양한 계통으로의 분화를 가능케 함을 보여주고 있습니다. 하지만 아직까지 인간의 배아줄기세포를 이용한 실험에서는 같은 결과를 보여주고 있지는 않습니다. 대부분의 직접 분화 연구에서는 BMP4, Acivin A, Notch ligand과 같은 다양한 사이토카인(cytokine)과 모르포겐(morphogen)을 혹은 조혈줄기세포의 미세환경을 맞추어주기 위한 다른 세포와의 공동배양을 사용하고 있습니다. 비록 이러한 연구들이 다양한 줄기세포로부터 조혈전구세포들을 생성할 수 있음을 보여주고 있지만 많은 체외 배양의 조혈전구세포들은 림프성 혈액으로의 분화가 어렵거나 생착이 잘 되지 않는 문제점을 보여주고 있습니다. 흥미로운 사실은 이러한 많은 직접분화의 방법들 대부분은 원시단계의 혈액생성을 재연하려고 하는 것인데, 원시단계의 발생과 분화는 일시적인 단계의 분화인데다 여기서 유래된 조혈전구세포는 요크색(yolk sac)의 전구세포와 아주 비슷합니다. 비록 이종기관이식을 통한 실험들은 이러한 원시단계의 조혈전구세포들이 체내(in vivo)에서 다시 완전히 성숙하게 분화될 수 있음을 보여주고 있지만, 현재까지의 지식과 이해로는 완전하게 어떻게 두 가지(원시단계와 확정단계)의 발생과 분화가 세밀하게 조정되어지는지 알지 못합니다. 예를 들면, 원시단계의 혈액생성의 경우 정확한 시간의 Activin-Nodal 신호 조절이 대단히 중요하지만 정반대로 Activin-Nodal 신호 조절의 억제와 Wnt-b-catenin 신호의 활성화는 확정단계의 혈액생성을 유도하게 됩니다.
이러한 전략적인 실험방법은 확정단계의 조혈계통의 세포들을 체외(in vitro)에서 대량 생산하게 하지만 현재까지 100% 완벽한 진짜 조혈줄기세포를 만들어낼 수는 없습니다. 줄기세포를 이용한 체외 조혈줄기세포 생성의 가장 중요한 한계는 현재까지 혈액생성 개체발생의 복잡성의 세세하고 정확한 이해의 부족과 이러한 복잡한 발생과정을 체외의 배양접시에서 구현해야 하는 도전에서 기인된 것입니다. 현재까지 알려진 연구에 의하면 확정단계의 조혈줄기세포는 임신 중기 여러 주요 동맥 haemo-genic endothelial (HE) 세포에서 발생한다고 알려져 있습니다. 조혈줄기세포는 배아발달시기 등쪽 대동맥(dorsal aorta)의 HE 세포에서 직접적으로 떨어져 나오게 됩니다. 등쪽 대동맥의 aorta- gonad-mesonephros (AGM)의 조혈줄기세포 발생과 분화를 유도하기 위해서는 Notch, Wnt, sonic hedgehog와 retinoic acid 같은 서로 다른 세포신호에 의한 상호작용에 의하여 매개되는 단계별 특이적이며 유도적인 신호가 요구됩니다.
...................(계속)
☞ 자세한 내용은 내용바로가기를 이용하시기 바랍니다.
-
이전글
- 유럽 바이오 의료 기술 관련 동향
-
다음글
- ASHG 2016 참관기
관련정보
지식
동향


 pdf_0002624.pdf
pdf_0002624.pdf