기술동향
대사과정에 대한 시스템생물학
- 등록일2017-07-06
- 조회수12133
- 분류기술동향
-
자료발간일
2017-07-04
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#게놈수준의 대사모델#대사공학#대사체학#단백질체학#시스템의학
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
대사과정에 대한 시스템생물학
김민석 / 서울대학교
[요약문]
대사과정(metabolism)은 수천 가지의 화학반응이 관련된 복잡한 현상으로, 이에 대한 전체론적(holistic) 연구를 위해서는 수학적 모델이 활용되어야 한다. 생물학에서 수학적 모델을 이용하는 것을 시스템생물학(systems biology)이라 한다. 이 논문에서는 시스템생물학의 기초 원리 및 대사과정을 연구하는데 이용되는 2가지 수학적 모델들(속도론 모델 및 게놈수준의 대사모델)에 대해 설명하고자 한다. 또한, 전사체, 단백체, 대사체, 대사흐름체와 같은 다양한 오믹스(omics) 기술들이 대사과정을 연구하는데 있어 어떻게 사용되는지 설명하고자 한다. 마지막으로, 시스템생물학이 대사과정 조절 기작의 분석, 미생물 세포 공장의 개발 및 인간 대사질환의 분석에 어떻게 응용될 수 있는지 기술하고자 한다.
[목 차]
1. 서론
2. 학문으로서의 시스템생물학
3. 대사과정에 대한 수학적 모델링
3.1 속도론 모델
3.2 게놈수준의 대사모델
4. 오믹스 데이터의 통합적 분석
4.1 전사체
4.2 단백체
4.3 대사체
4.4 대사흐름체
5. 응용
5.1 기초생물확
5.2 미생물 대사공학
5.3 인간 대사과정
1. 서론
모든 세포들은 주로 효소에 의해 촉매되는 수천 가지의 다양한 화학반응을 수행하며, 이를 통해 생명유지에 필요한 각종 구성 요소 및 에너지 등을 합성함으로써 삶을 유지해나간다. 세포 안에서 일어나는 모든 화학반응을 총칭하여 대사 또는 대사과정(metabolism)이라 일컫는다. 대사과정에 대한 연구는 그 역사가 매우 깊은데, 흔히 1920, 30년대를 대사과정 연구의 황금기라 부르며, 이 시기에 Embden-Meyerhof-Parnas 경로(EMP pathway, 다른 말로 해당과정 또는 glycolysis) 및 tricarboxylic acid 회로(TCA cycle, 다른 말로 Krebs cycle)와 같이 대부분의 생명체가 보유하고 있는 주요 대사경로(metabolic pathway)의 규명이 이루어진 바 있다. 이후 1950, 60년대에도 갈락토오스(galactose)를 글루코스-6-인산(glucose-6-phosphate)으로 변환하는 Leloir 경로 등 많은 대사경로의 발견이 이어져왔다. 이러한 고전적 개념의 대사경로는 오늘날 대사과정에 대한 이해의 근간을 이룬다. 하지만, 100년에 가까운 연구에도 불구하고 아직까지도 대사과정의 수많은 부분들이 규명되지 않은 채로 남아있다. 예를 들어, EMP 경로와 TCA 회로를 연결하는 피루브산(pyruvate)이 세포질에서 미토콘드리아 내부로 수송되는 경로는 그 중요성에도 불구하고 2012년이 되어서야 규명된 바 있다.
오랜 시간 동안 대사과정은 고전적인 개념의 대사경로(EMP 경로, TCA 회로 등)들로 나뉘어져 개별적으로 이해되어왔다. 하지만, 수많은 대사반응(metabolic reaction)들이 ATP, NADH, NADPH와 같은 조효소들을 이용하며, 이를 통해 같은 조효소를 이용하는 수많은 다른 대사반응들과 연결되어 있다. 대다수의 대사반응들은 다른 대사반응들과 높은 연결성을 지니며, 이러한 연결은 고전적으로 정의된 대사경로의 범위를 뛰어넘는 경우가 매우 빈번하다. 실제로 효모(yeast; Saccharomyces cerevisiae) 내의 대사물 중 적어도 10%는 10개 이상의 대사반응과 관련되어 있으며, ATP, NADPH, 글루탐산(glutamate)은 각각 최소 180, 80, 70개 이상의 대사반응에 참여하는 것으로 알려져 있다. 이와 같은 대사과정 내 요소들(대사물 및 대사반응)의 높은 연결도는 대사과정 전체에 있어 중요한 의미를 가진다. 예를 들어, 하나의 대사경로에만 변화를 주더라도 그 변화가 전체 대사 네트워크에 걸친 광범위한 변화를 초래할 수 있기 때문에, 대사과정의 요소들을 개별적으로 연구하는데 어려움이 자주 발생하곤 한다.
대사과정의 높은 연결도는 다음과 같은 사실들을 암시한다. 첫째, 세포가 적절히 기능하기 위해서는 여러 대사경로들이 균형 잡힌 활성도(항상성, homeostasis)를 가져야 하며, 이를 위해 대사과정 전체에 걸쳐 전사(tranion), 번역(translation), 효소활성(enzyme activity) 등 다양한 수준에서 매우 광범위하고 복잡한 조절 기작이 필요하다. 만약 이러한 조절 기작이 정상적으로 작동하지 않는다면 세포는 정상적으로 기능할 수 없다. 둘째, 대사과정의 높은 연결도와 항상성 유지를 위한 광범위하고 복잡한 조절 기작으로 인해, 대사공학(metabolic engineering, 미생물에 유전적 변화를 가함으로써 바이오연료, 플라스틱, 의약품 등 유용한 화합물을 생산하는 일)은 근본적으로 매우 어려운 일이다. 셋째, 인간의 대사질환에 대한 근본적인 원인을 찾고 이해하는 일은 매우 어렵다. 앞서 기술한 바와 같이 대사과정의 높은 연결도로 인해 한 대사경로에서 일어난 국소적인 변화가 대사과정 전체에 걸쳐 광범위한 변화를 일으킬 수 있기 때문이다. 따라서 대사질환의 발달 과정에 따라 대사 네트워크가 반응하는 과정을 이해한다면, 이를 신규 바이오마커 및 치료제 개발에 이용할 수 있다.
이 논문에서는 (i) 대사과정의 광역 조절 기작, (ii) 대사공학, (iii) 질병 발달에 따른 인간 대사과정의 변화에 대해 논의하고자 한다. 이를 위해 먼저 대사과정에 대한 전체적인 이해를 얻는데 이용되는 시스템생물학에 대해 설명하고자 한다.
2. 학문으로서의 시스템생물학
시스템생물학은 컴퓨터 모델링 및 수학적 모델링과 같은 전체론적 접근법을 활용해 복잡한 생명 시스템을 연구하는 학문이다. 시스템생물학에서는 생명 시스템을 네트워크 전체 수준에서 이해하고자 하며, 이는 생명 시스템의 일부분을 집중적으로 탐구하는 분자생물학의 기조와 대조를 이룬다. 또한 시스템생물학은 분자생물학에 비해 생명현상에 대한 정량적 이해를 추구하는 경향이 크다. 그러나 이러한 차이에도 불구하고, 시스템생물학은 분자생물학적 연구를 통해 축적된 대량의 생물학적 정보에 의존적이며, 시스템생물학을 통해 생성된 가설들은 종종 분자생물학을 통해 검증될 필요성이 있다.
시스템생물학에서 사용되는 연구 방법들은 크게 하향식(top-down) 방법론과 상향식(bottom-up) 방법론으로 나뉜다. 하향식 시스템생물학은 다양한 오믹스 기술을 통해 생성된 생명 시스템 전체에 대한 데이터에 기반을 두는 반면, 상향식 시스템생물학은 생명 시스템에 대한 구체적(수학적) 모델에 기반을 둔다. 두 가지 방법론은 모두 생명 시스템의 발생적 특성(emergent properties)을 이해하는데 이용될 수 있으며, 종종 상호보완적으로 활용되기도 한다.
3. 대사과정에 대한 수학적 모델링
수학적 모델들은 자연현상을 연구하는데, 또 복잡한 시스템을 공학적으로 설계하는데 있어 널리 이용된다. 수학적 모델을 활용함으로써 얻을 수 있는 가장 큰 장점 중 하나는 바로 자연현상에 대한 복잡한 정보를 적절한 추상화를 통해 간결한 형태로 나타낼 수 있다는 것이다. 예를 들어, Michaelis-Menten 식은 효소반응에 대한 정보를 단 2개의 파라미터(KM, kcat)로 표현할 수 있게 한다. 이로 인해, 수학적 모델은 생물학 및 생물공학 분야에서도 널리 활용되고 있다. 하지만, 아직도 생명현상의 많은 부분들이 규명되지 않았기 때문에, 살아있는 세포가 보이는 모든 생명현상을 포괄하는 수학적 모델은 아직 존재하지 않는다. 설사 모든 생명현상을 포괄하는 ‘완벽한’ 수학적 모델이 존재한다 할지라도, 그 활용도는 그리 높지 않을 수 있다. (예를 들어 1:1 축적을 가진 지도가 활용되긴 어려울 것이다.) 따라서 생물학에서 수학적 모델은 대상 시스템을 대체할 수 있는 ‘완벽한’ 모델이라기 보단, 생명현상에 대한 새로운 이해를 얻고 새로운 실험을 설계하는데 사용될 수 있는 연구 도구로써 기능하는 바가 더 크다.
생명현상에 대한 다양한 종류의 수학적 모델들이 존재하지만, 대사과정을 기술하는데 있어서는 속도론 모델(kinetic model)과 화학양론적 모델(stoichiometric model, 또는 게놈수준의 대사모델)이 널리 이용된다.
3.1 속도론 모델
대사경로가 적절히 기능하기 위해서는 대사물들의 농도가 적정 수준으로 조절됨을 통해 대사경로 내 효소들을 통한 대사흐름(metabolic flux)이 균형을 이루어야 한다. 만약 대사흐름의 균형이 깨지게 된다면, 특정 대사물이 급격히 축적될 수 있고 이는 해당 대사경로가 기능하는데 있어 치명적으로 작용할 수 있다. 세포 내 대사물의 농도는 외부 환경조건에 의해 크게 결정되지만, 효소들의 속도상수(kinetic parameter)들에도 큰 영향을 받는다. 보통 대사경로 상의 일부 효소만이 알로스테릭 조절(allosteric regulation)을 받는데, 아미노산 생합성 경로에서 나타나는 되먹임 조절(feedback regulation)이 그 대표적 예이며, 이와 같은 유형의 조절은 대사경로의 기능에 있어 매우 중요하다. 지금까지 많은 종류의 효소들에 대해 그 속도론적 성질들이 연구되었으며, 해당 정보들은 BRENDA 데이터베이스에 잘 정리되어 있다.
그러나 대부분의 효소 속도론 연구는 정제된 효소를 이용한 in vitro 분석에 기반하며, 포스포프룩토키나아제(phosphofructokinase)와 같이 여러 알로스테릭 조절자를 가진 몇몇 효소의 경우 in vitro 분석에 근거한 그 속도식(kinetic expression)이 매우 복잡하다. Matthias Reuss 교수 연구팀에서는 효모와 대장균의 해당과정을 수학적으로 모델링하고자 시도하였는데, 해당과정을 적절히 시뮬레이션 하기 위해서는 in vitro 분석에 의해 얻어진 효소들의 속도상수 값에 대해 상당한 보정이 필요하다는 것을 밝힌바 있다. Reuss 교수 연구팀은 먼저 동적 연속배양기(dynamic chemostat) 실험으로부터 해당과정의 중간산물 및 ATP, ADP, AMP의 농도를 초단위의 시간해상도로 측정하였고, 이 정량실험 결과에 근거하여 해당과정에 대한 속도론 모델을 개발하였다. 그들은 개발된 속도론 모델을 이용하여 이전에 in vitro 분석을 통해 밝혀진 알로스테릭 조절기작 중 상당수가 그들이 실험한 조건에서 기능하지 않음을 확인하였다. Reuss 교수 연구팀의 결과는 대사과정을 수학적으로 모델링하는데 있어 복잡한 효소의 속도식을 상당 부분 단순화시켜도 여전히 대사과정의 기능을 적절히 시뮬레이션 할 수 있음을 시사한다. 또한 그들은 효모의 해당과정 속도론 모델을 통해 해당과정으로의 대사흐름의 양은 포도당 수송체 수준에서 조절됨을 확인하였는데, 이는 해당과정 관련 효소들을 과발현시켜도 해당과정으로의 대사흐름이 증가되지 않았던 실험결과들과 부합한다.
이외에도 속도론 모델을 이용해 대사과정을 연구한 많은 연구들이 존재한다. Bas Teusink 교수 연구팀은 해당과정으로의 대사흐름의 양을 조절하는데 있어 ATP의 역할이 중요하다는 것을 속도록 모델을 통해 밝힌 바 있다. 다른 예로, Edda Klipp 교수와 Stefan Hohmann 교수의 공동 연구팀은 속도론 모델을 이용해 효모에서 Hog1p 경로가 삼투성 스트레스(osmotic stress) 조건에서 글리세롤 생산 조절에 어떻게 관여하는지 연구한 바 있다.
3.2 게놈수준의 대사모델
게놈수준의 대사모델(genome-scale metabolic model, GEM)은 주어진 생명체의 대사과정 전체를 다루는 모델로써, 유전체 정보에 근거하여 상향식 방법으로 구축된다(그림 1). GEM에는 주어진 생명체가 수행할 수 있는 모든 대사반응에 대한 화학양론적 정보가 담겨 있으며, 각 대사반응에 어떤 효소들이 관계되어 있는지에 대한 정보, 즉 유전자-단백질-대사반응 관계도가 포함되어 있다. 따라서 GEM을 이용하면 유전형과 대사기능 사이의 관련성을 확인할 수 있으며, 유전적 변이에 따른 세포의 대사적 차이 또한 예측할 수 있다.
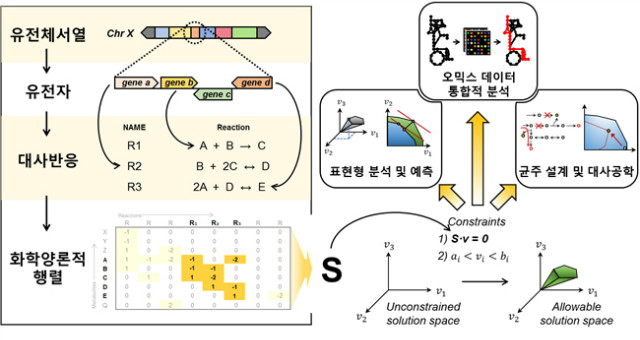
그림 1. 게놈수준의 대사모델의 구축과 응용
초기의 GEM들은 Bernhard Palsson 교수 연구팀에 의해 Haemophilus influenza, 대장균, Hel-icobacter pylori, 효모와 같이 유전체 서열이 먼저 밝혀진 미생물들에 대해 구축되었다. 현재는 수백 종의 미생물, 다양한 식물, 쥐와 인간의 세포에 대해서도 GEM이 구축되었다. GEM의 구축과정은 종종 대사과정 중 잘 알려지지 않았던 부분의 발견과 대치되는 실험 데이터에 대한 큐레이션을 수반하며, 이에 따라 GEM은 해당 생물에 대한 지식 베이스(knowledge base)로 기능하기도 한다. 대사과정에 대한 새로운 정보가 얻어지면 GEM에 새로운 대사반응이나 대사물이 추가되는 등의 방식으로 GEM의 갱신/확장이 일어나게 된다. 이에 따라 대표적 모델 생물인 대장균, 효모, 인간 세포의 GEM은 지속적으로 업데이트가 이뤄지고 있다. 가장 최신의 대장균 GEM의 경우, 1,075개의 녹아웃 균주에 대한 표현형 정보에 기반하고 있으며, 1,366개의 유전자, 2,251개의 대사반응, 1,136개의 대사물을 포함하고 있다.
GEM은 flux balance analysis (FBA)라는 모델링 개념에 근거하여 대사과정의 시뮬레이션에 활용될 수 있다. FBA는 유사정상상태(pseudosteady state)에서 각 대사물이 생성되는 양과 소모되는 양이 균형을 이룬다는 점에 근거하여, 적절한 목적함수(objective function)를 설정한 뒤 선형계획법(linear programming)을 이용해, 목적함수의 최적 값과 그에 상응하는 각 대사반응으로의 대사흐름을 추정하는 모델링 개념이다. 목적함수로는 세포 생장의 최대화(maximization of growth)가 가장 널리 사용되는데, 이는 미생물에서 매우 잘 작동하는 것으로 증명된 바 있다. 그 외에도 ATP 생산의 최대화(maximization of ATP production) 등도 목적함수로 이용될 수 있다.
GEM은 생물학 및 생물공학 연구에 다양하게 활용될 수 있다. 예를 들어, GEM은 서로 다른 세포들의 대사 기능적 차이를 비교하는데 이용될 수 있는데, 이는 생물공학에서 주어진 화합물을 가장 잘 생산할 수 있는 미생물을 선별하는데 응용되거나, 암세포와 기원세포의 대사 기능적 차이를 밝히는데 응용될 수 있다. 또한 GEM은 특정 생물 또는 세포가 다양한 탄소원 및 에너지원이 주어졌을때 어떤 기능을 보이는지 예측하는데 이용될 수도 있다. 예를 들어, GEM을 이용해 예측한 글리세롤에 기반한 대장균의 생장속도는 실제 실험값에 비해 상당히 높은 값을 보이는데, 이러한 불일치는 GEM에 대사과정의 조절 기작이 포함되지 않았기 때문으로 보통 해석된다. 하지만 역으로 생각해보면, 이는 대장균이 글리세롤에서 더 높은 생장속도를 가질 수 있음을 의미하기도 한다. 실제로 대장균을 글리세롤이 포함된 배지에서 실험실진화(adaptive laboratory evolution, ALE)를 시킨 결과, GEM을 통해 예측한 값과 일치하는 생장속도를 가지도록 진화된 바 있다. 이와 같은 결과는 다음과 같은 점들을 시사한다. (i)GEM을 이용해 세포의 대사기능을 예측할 수 있다, 하지만 대사과정에 대한 조절기작으로 인해 그 기능이 현저히 저해된 형태로 관찰될 수 있다. (ii)실험실진화를 통해 미생물이 GEM 예측과 같은 표현형을 가지도록 만들 수 있다.
GEM은 기본적으로 화학양론적 정보에 기반을 두지만, 일부 효소들에 대한 속도론적 정보(kinetic information)를 GEM에 추가하여 모델 예측의 정확도를 향상시키려는 연구들도 진행되고 있다. 또한, GEM은 기본적으로 대사과정에 대한 정보만을 포함하고 있는데, 최근 이에 더해 단백질 합성 과정(전사 및 번역 과정 포함), 단백질 구조 정보, 또는 단백질 분비 경로(secretory pathway)까지 GEM에 포함시키려는 연구들도 진행되고 있다.
4. 오믹스 데이터의 통합적 분석
오믹스 기술의 발달로 대사과정에 대한 심층 연구가 가능해졌다. 특히, 대사과정이 전사, 번역, 번역후 과정 및 대사물-효소 상호작용에 의해 어떻게 조절되는지 규명하는 것이 가능해졌다. 오믹스 데이터 분석은 전통적으로 통계적 방법 또는 군집 방법(clustering method)을 통해 이루어졌다. 그러나 이러한 방법들을 통한 데이터 분석은 생물학적 기작 또는 맥락이 고려되지 않는다는 한계점이 있다. 이러한 한계점을 극복하고 보다 유의미한 생물학적 정보를 도출해내기 위해, 다양한 네트워크 모델 기반 오믹스 데이터 통합적 분석 방법들이 개발된 바 있다.
4.1 전사체
최근 전사에 대한 분석은 차세대 염기서열 분석기술에 기반을 둔 RNA sequencing 기법을 통해 이뤄지고 있으나, 처음에는 DNA array 기법이 이용되었다. DNA array 기법은 효모의 이중영양적 생장(diauxic growth)에 따른 전사체 변화 분석에 처음 이용된 바 있으며, 이를 통해 이중영양적 생장 과정에 TCA 회로 및 호흡 관련 유전자의 발현 증대 및 해당과정 관련 유전자의 발현 감소가 동반됨이 밝혀졌다. 이후, DNA array 및 RNA sequencing 기법을 통해 대사과정의 변화를 측정하는 많은 연구들이 수행되었으나, 많은 경우 대사과정의 높은 연결도에 기인한 분석의 어려움으로 인해 새로운 생물학적 지식의 창출로까지 이어지지는 못했다. 이에 따라, GEM이 전사체 데이터의 통합적 분석에 활용될 수 있음을 처음 보여준 연구결과는 학계에 큰 반향을 일으킬 수 있었다. GEM을 이용해 전사체 데이터를 분석하는 방법은 크게 두 가지로, 하나는 유전자 발현량 정보를 이용해 대사흐름에 대한 제한조건을 추가한 뒤 FBA 계열의 알고리즘을 사용해 대사흐름을 새로 계산하는 것이고, 다른 하나는 GEM에 내재된 네트워크의 구조적, 위상학적 정보를 이용해 전사 수준의 변화가 큰 서브네트워크(subnetwork) 및 대사물(여기서는 reporter metabolite라고 부름)을 찾는 것이다. 현재까지 수십 가지의 GEM 기반 전사체 분석 방법들이 개발된 바 있으며, 최근에는 단백질 합성 과정이 포함된 GEM (ME-model)을 이용해 보다 직접적으로 전사체 데이터를 통합 분석하는 연구가 수행되고 있다.
한편, 전사조절 기작에 대한 이해는 (i)전사인자(tranion factor, TF)의 제거 전후 전사체 비교 또는 (ii)특정 유전자의 프로모터 대한 TF 결합 부위 결정을 통해 이뤄질 수 있다. 전자의 경우, 해당 TF가 세포의 표현형에 미치는 영향을 가장 직접적으로 확인할 수 있다. 하지만, 그러한 영향을 해석하는 데는 어려움이 따르는데, 이는 해당 TF가 다른 여러 TF와 상호작용을 하고 있을 가능성이 크기 때문이다. 반대로 후자의 경우, 해당 TF가 조절하는 유전자들을 직접적으로 확인할 수 있지만, 그러한 물리적인 상호작용이 전사조절의 경향성과 반드시 일치하는 것은 아니므로 전자의 방법과 함께 이용될 필요성이 있다. TF의 DNA 결합 부위 결정에는 크로마틴면역침강(chromatin immunoprecipitation, ChIP) 후 DNA array (ChIP-chip) 또는 sequencing (ChIP-seq)을 통한 결합 DNA 분석 기법이 이용된다. 최근에는 엑소뉴클레아제(exonuclease)를 이용해 해상도를 높인 ChIP-exo 기법도 개발되어, 대장균의 아미노산 대사 관련 전사조절 네트워크의 규명 등에 응용된 바 있다.
4.2 단백체
과거에는 단백체 분석에 고해상도 겔 전기영동(high-resolution gel electrophoresis) 기법이 이용되었으나, 최근에는 질량분석법(mass spectrometry)의 발달로 겔 사용 없이(gel-free) 수천 개의 단백질에 대한 정량분석이 가능해졌다. 더 나아가, 질량분석법을 이용하면 단백질의 아미노산 서열뿐만 아니라 단백질의 인산화와 아세틸화와 같은 단백질 변형까지도 측정이 가능하다. 또한 internal standard를 활용하면 단백질의 농도를 절대정량 하는 것도 가능하다. 이러한 기술적 발전으로 인해 단백체 라이브러리의 구축이 가능해졌으며, 최근 대장균을 22가지 생장조건에서 배양한 뒤 2,300여개 단백질의 농도를 정량한 단백체 라이브러리가 발표된 바 있다.
이와 같은 단백체 정량 데이터를 사용하여, 여러 대사경로에 대한 단백체 할당이 세포의 표현형을 결정하는데 있어 중요하다는 것이 여러 연구를 통해 최근 밝혀졌다. 하나의 세포가 가질 수 있는 단백체의 총량에는 한계가 있고, 이에 따라 세포는 주변 환경에 맞춰 각 대사경로마다 적절량의 단백체를 할당할 필요가 있다. 대표적인 예는 효모에서 관찰되는 Crabtree 효과로, 이 현상은 촉매적으로는 비효율적이나 에너지적으로는 효율적인 호흡과정(F1F0-ATP synthase 포함)에서부터 촉매적으로는 효율적이나 에너지적으로는 비효율적인 해당과정으로 단백체의 재할당이 일어나는 것을 통해 설명될 수 있다. 이와 같은 단백체 할당에 근거한 속도와 수율 사이의 트레이드오프는 여러 생명현상에서 관찰된다. 대장균에서 나타나는 오버플로우 대사(overflow metabolism; 대장균에게 높은 농도의 포도당이 주어졌을 때 아세트산을 생산하는 현상) 또한 이에 속하는데, 한 연구에서는 대장균의 단백체를 여러 조건에서 프로파일링함을 통해 아세트산 생산과정이 호흡과정보다 단위 단백체 당 에너지 생산이 더 크기 때문에 오버플로우 대사가 나타남을 밝힌 바 있다.
4.3 대사체
직관적으로는 세포 내 대사체를 정량하는 것이 세포의 대사과정을 연구하는데 있어 가장 핵심적인 방법으로 보일 수 있다. 하지만 실제로 대사체를 기반으로 대사과정을 연구하는 것은 매우 어려운데, 여기에는 크게 두 가지의 이유가 있다. 먼저, 세포 내 대사체에 대한 정량적 데이터를 얻는 데 있어 근본적인 어려움이 존재한다. 세포 내 대사물들은 보통 굉장히 낮은 농도로 존재하고, 매우 빠른 속도로 다른 대사물로 전환되며, 화학적 변화에 취약하고, 세포 내에서는 여러 단백질에 결합하고 있는 등 자유 상태로 존재하지 않는 경우가 많다. 효모의 해당과정에 속하는 대사물들의 경우, 그 전환속도가 3~10초 사이로 이들에 대한 정확한 정량을 위해서는 대사과정을 매우 빠른 시간 내에 급랭(quenching)시켜야만 한다. 그리고 세포 내 대사물들은 화학적으로 그 구조와 특성이 매우 다양하므로 한 번에 모든 대사물들을 추출할 수 있는 방법은 존재하지 않는다. 이에 따라 다양한 대사체 분석방법(급랭 및 추출 과정 포함)들이 개발되고 있으나, 같은 시료에 대해서도 사용한 분석방법에 따라 대사체의 정량값이 서로 매우 상이하다는 문제점이 있다. 이와 같은 문제점을 해결하기 위해 여러 연구가 진행되고 있는데, 최근에는 질량분석기에 직접 세포 현탁액을 주입하는 방법이 개발되어 대장균의 대사체에 대한 고해상도 분석이 이뤄지는 등 진전이 나타나고 있다.
대사체를 기반으로 대사과정을 연구하는데 있어 또 다른 어려움은, 대사체 데이터로부터 의미 있는 생물학적 결론을 도출하기 어렵다는데 있다. 대사물의 농도 또는 그 변화량으로부터 의미 있는 생물학적 결론을 도출하기 어려운 이유는, 대사물의 농도가 너무나 많은 요소들(효소의 농도, 효소의 번역후 변형에 따른 활성화, 효소의 반응속도 상수 등)에 의해 영향을 받고 결정되기 때문이다. 따라서 최근 대사체 데이터 분석은 다양한 종류의 오믹스 데이터(전사체, 단백체 등)를 대사체 데이터와 통합 분석하여 가설을 검증하는 방향으로 진행되는 추세이다. 앞서 기술한 GEM도 대사체 데이터 분석에 활용하고자 하는 연구들이 진행되고 있으나, 대사체 데이터가 GEM의 대사물 중 일부분만을 포함하고 있기 때문에 어려움이 있다.
4.4 대사흐름체
대사흐름체(fluxome)는 동위원소로 표지된 기질을 사용하여 세포를 키운 후, 세포 내 대사체에서 동위원소의 분포를 측정한 뒤, 그 데이터를 화학양론적 모델을 이용해 분석함으로써 얻을 수 있다. 가장 널리 사용되는 대사흐름체 측정 방법은 세포 내 단백질에 포함된 아미노산의 동위원소 표지 정도를 측정하는 것인데, 이를 위해서는 해당 세포가 정상상태(steady state)에 도달해야한다는 한계점이 있다. 하지만, 최근에는 전구물질(precursor metabolites)의 동위원소 표지 측정 및 진보된 모델링 기법을 활용하여 동적 상태의 세포에 대해서도 대사흐름체를 측정할 수 있게 되었고, 이는 쥐의 간세포가 스타틴(statin)에 노출되었을 때 콜레스테롤 생합성의 동적 반응을 연구하는데 이용된 바 있다.
대사흐름체 분석은 연료나 화합물 생산을 위한 미생물 세포 공장 개발에 널리 이용되고 있다. 하지만, 대사흐름체 분석만으로는 대사흐름의 병목 지점을 찾거나 추가적인 엔지니어링 타겟을 찾는데 어려움이 존재한다. 한편, 대사흐름체 분석은 인간 세포의 대사과정을 연구하는데도 매우 유용하다. 인간 세포는 다양한 탄소원 및 에너지원을 사용하며 세포 내 에너지 및 조효소 생산을 위해 다양한 대사경로들을 이용하는데, 각 탄소원, 에너지원 및 대사경로가 해당 세포의 대사과정에서 얼마나 큰 역할을 수행하는지 밝히는데 있어 대사흐름체 분석은 매우 유용하다. 예를 들어, 암세포의 글루타민(glutamine) 대사과정을 연구한 한 논문에서는 대사흐름체 분석을 통해 저산소 조건에서 암세포가 흡수한 글루타민이 이소시트르산탈수소효소(isocitrate dehydrogenase)의 환원작용을 통해 아세틸코에이(acetyl-CoA)로 전환된 후 지질합성에 사용됨을 확인하였으며, 이를 통해 암세포가 질소 필요량 이상의 글루타민을 흡수하는 이유를 설명할 수 있었다.
5. 응용
대사과정에 대한 시스템생물학은 다음과 같이 응용될 수 있다.
5.1 기초 생물학
모든 세포는 대사 항상성 유지를 위한 광범위한 조절 시스템을 가지고 있다. 그러한 조절 시스템은 조효소 짝의 상대적 비율, 즉 ATP/ADP, NADH/NAD+, NADPH/NADP+ 값을 통해 세포의 에너지 및 산화환원 상태를 감지한다. 앞서 기술한 바와 같이 이러한 조효소들은 수많은 대사반응에 이용되고 있으며, 이로 인해 이들 조효소 비율을 적정 수준으로 유지하기 위해서는 대사과정 전체에 걸친 광범위한 조절기작이 필요하다.
대사과정에 있어 NADH와 NADPH는 전자전달자로 널리 이용되는데, 이들은 각기 다른 역할을 수행한다. NAD+는 이화반응(catabolic reaction)에서 전자수용체(electron acceptor)로 작용하며, NADH는 호흡시스템이나 젖산과 같은 발효산물 생산에 전자를 전달하는데 이 과정들은 열역학적 구동력이 커서 세포 내에서는 NAD+가 NADH보다 높은 농도로 존재하게 된다. 한편, NADPH는 동화반응(anabolic reaction)에서 전자공여체(electron donor)로 이용되며, 세포의 구성 요소 합성에 있어 중요하다. NADPH는 몇 가지 산화반응에 의해 생성되는데, 가장 그 기여가 큰 대사반응들로는 산화 5탄당 인산경로(oxidative pentose phosphate pathway), NADP+ 의존적 이소시트르산탈수소효소 및 말산효소(malic enzyme) 반응이 있다. 이러한 반응들은 이산화탄소를 발생시키는 반응으로 열역학적 구동력이 매우 큰데, 이를 통해 세포 내의 NADPH의 농도가 NADP+에 비해 높게 유지될 수 있다. 세포는 NADH, NADPH의 농도를 각각 알맞게 유지해야 하기 때문에 NADH와 NADPH 사이의 전자교환은 자유롭게 일어날 수 없도록 제한되어 있다. NADH와 NADPH 사이의 전자교환은 세포막에 부착된 수소전달효소(transhydrogenase)를 통해 양성자기울기(proton gradient)로부터의 에너지를 사용해서만 진행될 수 있다. 세포질에 있는 수소전달효소를 이용해서도 NADH와 NADPH 사이의 전자교환이 일어날 수 있으나, 이 경우 전자는 NADPH에서부터 NAD+로만 전달될 수 있다.
NADPH와 NADH가 수행하는 대사과정에서의 많고 중요한 역할로 인해, 이들 조효소 관련 대사반응 혹은 이들 조효소간의 상호 전환과 관련되어 문제가 생기면 세포에 치명적일 수 있다. 산화 스트레스 또는 질병 조건에서 NADPH가 과다하게 사용되는 것을 통해 이들 조효소가 대사과정의 변화와 밀접한 관계가 있음을 알 수 있다. 생물공학적 측면에서도 역시 이들 조효소의 균형이 매우 중요한데, 조효소의 사용을 조작함을 통해 미생물을 통한 화합물 생산을 증대시킬 수도 있다. 예를 들어, 저자(Jens Nielsen 교수)의 연구팀에서는 효모에서 NADPH 사용의 절반을 차지하는 암모니아 동화 과정에서 NADPH 대신 NADH를 사용하도록 만듦으로써 NADH가 소모될 수 있는 경로를 추가하였고, 이를 통해 포도당으로부터 에탄올을 생산할 때 생성되던 부산물인 글리세롤의 생산을 50% 감소시킴으로써 최종적으로 에탄올 생산을 증대시킨 바 있다.
대사과정을 광범위하게, 또 적절하게 조절하기 위해 세포는 여러 가지 조절경로(regulatory pathway)를 가지고 있는데, 진핵생물에서 대사과정을 조절하는 가장 중요한 조절자로는 AMP-activated kinase (AMPK)와 target of rapamycin complex 1 (TORC1)이 있다. AMPK와 TORC1은 단백질 키나아제(protein kinase)로 다른 TF들의 활성을 조절하여 유전자 발현을 조절하거나 직접적으로 효소들을 인산화 시켜 활성을 조절하는 방식으로 대사과정을 조절한다. AMPK와 TORC1은 연결도가 매우 높은 조절 네트워크에 참여하고 있으며, 여러 가지 세포활동에 영향을 준다. 이로 인해 AMPK와 TORC1의 다양한 역할, 서로간의 상호작용, 다른 핵심 조절 요소와의 상호작용을 연구하기 위해서는 시스템생물학적인 방법들이 적용되어야 한다. 실제로 효모에서 AMPK와 TORC1의 조절 기능을 밝히기 위해 전사체, 단백체, 대사체 분석 등이 진행되었으며, 이를 통해 밝혀진 조절 기능은 진핵생물에서 보존적인 것으로 나타나고 있다. 효모는 유전자 조작이 매우 수월하기 때문에 이와 같은 조절 기능 연구에 적합한 모델 생물이다. 실제로 효모의 AMPK에 해당하는 Snf1과 관련된 여러 변이주에 대해, 환경 변화에 따른 동적 변화를 측정함으로써 Snf1 중심의 조절 네트워크에 대한 속도론 모델이 개발된 바 있다.
5.2 미생물 대사공학
미생물은 오랜 시간 동안 발효음식과 발효음료를 만드는데 사용되어 왔으며, 제2차 세계대전 이후에는 항생제의 산업적 생산에도 사용되기 시작했다. 오늘날에는 바이오에탄올, 사료첨가제로써의 라이신(lysine) 등 매우 다양한 종류의 화합물들이 미생물 발효를 통해 생산되고 있다. 유전공학 기술의 발달을 통해 미생물이 보다 다양한 종류의 화합물을 생산할 수 있도록 조작할 수 있게 되었으며, 이를 대사공학이라고 일컫는다. 대사공학을 통해 미생물 세포 공장을 개발하고 이를 이용해 신규 생물공정 구축에 성공한 여러 사례들이 있다. 그러한 미생물 세포 공장 개발 과정을 되짚어보면, 대사과정의 높은 연결도로 인해 대사공학을 수행하는데 있어 전체론적 접근법이 필수적이라는 것을 확인할 수 있다. 대사공학에 이용되는 전체론적 접근법 중 대표적인 것으로 design-build-test cycle (DBT cycle)이 있으며, 미생물이 충분한 효율을 보일 때까지 DBT cycle을 반복함을 통해 원하는 미생물 균주를 개발할 수 있다.
효모와 대장균은 세포 공장 개발에 있어 가장 선호되는 미생물로, 여러 유래의 외래유전자들을 도입함을 통해 이들이 원하는 화합물을 생산하도록 만들 수 있다. 이들 미생물이 목표 화합물을 생산할 수 있음을 확인한 proof-of-principle 균주(목표 화합물을 미량 생산하는 균주)에서부터 실제 생산공정에 활용할 수 있는 고생산 균주를 개발하는 데는 보통 3~5년의 시간과 5천만 달러 정도가 요구된다고 한다. 이러한 개발과정은 많은 라운드의 DBT cycle을 포함하는데, 최근 CRISPR (clustered regularly interspaced short palindromic repeats)-Cas9과 같은 유전체 엔지니어링(genome engineering) 기법이 발달함에 따라 DBT cycle 중 B(build)가 매우 수월해졌다. 따라서 현재 미생물 세포 공장 개발에 있어 주된 과제는 DBT cycle 중 D(design)와 T(test)로, 설계된 미생물의 표현형을 빠르게 확인하고(T) 이로부터 얻어진 정보를 다음 라운드의 설계를 향상시키는데 이용하는 것(D)에 있다. 이에 따라 시스템생물학이 대사공학에 기여할 수 있는 바가 매우 큰데, 시스템생물학에서 사용되는 대사 모델링 기법을 응용해 목표 화합물 생산에 최적화된 네트워크를 설계하는 것이 가능하기 때문이다.
GEM의 화학양론적 표현 방식은 대사공학에서 미생물 균주 설계에 매우 적합하며, bilevel optimization 기반 컴퓨터 알고리즘들을 이용해 미생물의 성장과 목표 화합물의 생산을 결합시킬 수 있는 대사공학 타겟을 찾는 것이 가능하다. 이와 같은 컴퓨터기반 설계는 대장균에서의 젖산 생산 및 효모에서의 에탄올과 숙신산 생산에 응용된 바 있다. 또한, 최근 Vassily Hatzimanikatis 교수 연구팀에 의해 개발된 BNICE.ch라는 컴퓨터 알고리즘을 이용하면, 목표 화합물 생산에 필요한 대사경로 및 그 속도록적, 열역학적 성질에 대한 분석이 가능하며 이에 근거한 미생물 균주 설계 역시 가능하다. 이와 같이 GEM을 미생물 균주를 설계하는데 이용하는 것에 더해, GEM은 위에서 이미 설명한대로 엔지니어링된 균주들에 대한 오믹스 데이터를 통합적으로 분석하는데도 이용될 수 있다.
대사공학에서 순공학(forward engineering)이 성공을 거둔 경우도 매우 많지만, 순공학적 방법(GEM을 이용한 균주 설계 등)의 경우 다루고자 하는 생명 시스템에 대한 많은 지식을 필요로 한다. 따라서 고온저항성이나 저pH (low pH) 저항성과 같이 매우 복잡한 형질을 조작하고자 하는 경우에는 순공학보다는 역공학(reverse engineering)이 효율적일 수 있다. 대사공학에서 널리 사용되는 역공학적 방법은 실험실진화로, 이를 통해 목적하는 새로운 표현형을 가진 변이주를 선별하고 유전체 서열 분석을 통해 해당 표현형의 근원이 되는 변이를 찾아낼 수 있다. 여기서 근원이 되는 변이를 찾는 과정에 있어 시스템생물학적 분석이 요구되는 경우가 많다. 예를 들어, 한 연구에서는 실험실진화를 통해 갈락토오스 대사가 향상된 효모 균주를 만든 뒤, 시스템생물학적 분석을 통해 Leloir 경로의 중간산물들의 항상성 유지가 갈락토오스 대사에 있어 매우 중요하다는 것을 밝혀낸 바 있다.
5.3 인간 대사과정
인간의 모든 질병은 적어도 한 가지 이상의 세포 유형에서 에너지 및 산화환원 대사과정에 영향을 미친다. 대사과정의 높은 연결도로 인해 질병들은 각각 여러 대사적 특징을 수반하며, 그 중 일부는 조직이나 혈장의 대사체를 측정함으로써 확인될 수 있다. 그러나 혈장 내에는 매우 다양한 화학물질들이 존재하기 때문에 대사체 분석만을 통해 질병의 대사적 특징을 발견하기는 매우 어렵다. 따라서 질병의 대사적 특징을 발견하기 위해, 먼저 질병 상태의 조직의 대사과정을 분석한 뒤, 이로부터 가설을 세우고 표적 대사체 분석(targeted metabolomics)을 수행하는 것이 효과적이다. 이와 같은 연구를 통해, 질병진단을 향상시키고 환자들을 세부집단으로 구별하여 정밀의학 또는 맞춤의학 치료를 받게 할 수 있을 것으로 기대되고 있다. 또한 질병의 발달 과정에 따른 대사과정의 변화를 연구함으로써 새로운 약물 표적을 발견할 수도 있다. 특히 암 치료 연구에 있어 이와 같은 방법론이 널리 이용되고 있는데, 암세포 대사과정에 대한 연구는 암세포 연구에서 큰 부분을 차지하고 있으며, 이를 통해 여러 대사 효소들이 신규 약물 표적으로 확인된 바 있다.
전체론적 방법론 중 하나로 GEM은 질병 발달에 따른 인간 대사과정의 변화를 분석하는데 있어 매우 유용한 도구이다. 인간에 대한 최초의 GEM (Recon 1)은 2007년 발표되었으며, 2013년 한 차례 대규모 업데이트(Recon 2)를 거친바 있다. 최근에는 Recon 2에 확장된 지질 대사과정을 반영함으로써 Human Metabolic Reaction 2.0 (HMR 2.0) GEM이 개발되었다. HMR 2.0은 현존하는 가장 포괄적인 인간에 대한 GEM으로 3,765개의 유전자, 8,181개의 대사반응 및 6,007개의 대사물을 포함하고 있다. HMR 2.0은 지방세포, 간세포 및 근세포에 대한 대사모델을 만드는데 뼈대로써 이용되기도 했다. 지방세포 모델은 비만에 따른 지방조직의 대사적 변화를 연구하는데 이용되었는데, 모델 시뮬레이션을 통해 마른 사람이 비만인 사람에 비해 지질체(lipid bodies)의 동적 변화가 더 큰 것으로 나타난 바 있다. 간세포 모델은 비알코올성 지방간(nonalcoholic fatty liver disease) 환자에게서 나타나는 대사적 변화를 연구하는데 이용되어, 비알코올성 지방간 환자가 세린(serine) 결핍을 겪고 있음을 예측하는데 사용되었다. 실제로 비알코올성 지방간 환자에게 세린 보조제를 처방한 임상 실험에서 환자들의 건강상태가 호전되는 것이 확인된 바 있다. 근세포 모델은 근세포에 대한 여러 전사체 데이터의 메타분석에 이용되었으며, 이를 통해 제2형 당뇨병에 대한 신규 바이오마커가 제시된 바 있다. 상기한 조직들 외에도 조직 특이적 전사체 분석 데이터를 기반으로 많은 인체 조직에 대한 GEM이 개발되었다. 특히, Human Protein Atlas (HPA)의 데이터에 근거하여 80여 가지 유형의 인간 세포 및 20여 가지의 암 세포주에 대한 GEM이 발표된 바 있다.
GEM은 암세포의 대사과정을 이해하는데 있어 매우 적합한데, 오믹스 데이터의 통합적 분석뿐만 아니라 모델 시뮬레이션 및 암세포의 synthetic lethality 등을 조사하는데도 이용될 수 있기 때문이다. 앞서 설명한 바와 같이 GEM은 적절한 목적함수, 즉 세포 생장의 최대화를 통해 세포의 성장을 시뮬레이션 하는데 이용될 수 있다. 정상 상태의 인간 세포의 경우 그 목적함수를 특정하는 것이 매우 어렵지만, 암세포에 대해서는 그 추구하는 바가 세포 생장의 최대화라고 특정하는 것이 타당하다. 이로부터 Eytan Ruppin 교수 연구팀은 암세포의 빠른 생장이 암세포에서 나타나는 Warburg 효과의 원인이며, 이는 세포 내 단백체의 총량이 제한되어 있기 때문임을 밝힌 바 있다. (앞서 기술한 효모에서의 Crabtree 효과의 경우와 비슷함) 또한 Ruppin 교수 연구팀은 GEM이 암세포 치료를 위한 신규 약물 표적 발굴에 이용될 수 있음을 보였으며, 후속 연구에서는 아르기니노숙신산생성효소(argininosuccinate synthase, ASS1)-결핍 종양들에 특이적인 신규 약물 표적을 발굴한 바 있다.
암세포는 같은 종류라도 서로 매우 이질적이며, 이는 치료의 효과에 큰 영향을 미친다. 저자의 연구팀에서는 이러한 문제를 해결하기 위해 6명의 간세포암종(hepatocellular carcinoma) 환자에게서 얻은 종양으로부터 단백체 데이터를 획득하고, 이를 이용해 6명의 환자에 대한 개인 맞춤형 GEM을 구축한 바 있다. 6개의 개인 맞춤형 GEM을 이용하여 저자의 연구팀은 6개의 간세포암종 모두에 효과적으로 작용하는 대사억제제(antimetabolites)를 찾을 수 있었으며, 이를 간세포암종에 대한 치료약물로 제시하였다. 또한 GEM은 암세포 종류에 특이적인 대사과정을 확인하는데 이용될 수 있으며, 저자의 연구팀은 The Cancer Genome Atlas의 데이터를 이용해 대표적인 신장암인 clear cell renal cell carcinoma (ccRCC)에서 나타나는 특이한 대사적 차이가 염색체 3번 단완에서의 이형접합성 상실(chromosome 3p loss of heterozygosity)과 관련되어 있음을 확인한 바 있다. 더 나아가 저자의 연구팀은 ccRCC에서 헤파란 및 콘드로이틴 황산(heparin and chondroitin sulfate) 대사과정이 제대로 조절되고 있지 않음을 발견하였으며, 이와 관련된 대사물들을 혈장과 소변에서 분석함으로써 전이성 ccRCC에 대한 매우 강력한 진단 바이오마커를 발굴할 수 있었다.
장내미생물(gut microbiome)은 매우 복잡한 생명 시스템으로 인간의 질병 발달 과정과도 깊이 연관되어 있다. 장내미생물은 수백 종의 미생물들로 구성되어 있으며, 이들은 숙주인 인간의 면역체계 및 대사과정과 복잡한 상호작용을 이룬다. 장내미생물은 메타지놈 분석(metagenome analysis)을 통해 분석될 수 있으며, 여러 연구를 통해 장내미생물의 구성이 제2형 당뇨병 등 여러 질병의 발달 과정과 연관되어 있음이 밝혀진 바 있다. 또한 장내미생물의 조성은 식단의 영향을 많이 받으며, 식이조절을 통해 장내미생물의 조성을 변경하는 것도 가능하다고 알려져 있다. 장내미생물에 대한 이해를 높이기 위해 컴퓨터 모델을 활용한 여러 연구들이 진행되고 있으며, 최근에는 GEM을 이용해 장내미생물의 대사과정 전체를 모델링하는 시도들도 이뤄지고 있다. 저자의 연구팀에서는 장내미생물 중 가장 지배적인 역할을 하는 3개의 미생물 종에 대한 GEM을 이용해, 쥐의 장내에서 3개 종 사이의 상호작용을 시뮬레이션 한 바 있다. 이와 비슷하게 GEM을 이용해 식이조절에 따른 인간 장내미생물과 그 대사적 변화 또한 연구된 바 있다. 해당 연구에서 저자의 연구팀은, 장내미생물의 유전적 다양성이 부족한 사람의 경우 과체중이 되었을 때, 제2형 당뇨병을 비롯한 여러 대사 질환에 걸릴 위험성이 높음을 보였다. 더 나아가 이는 섭취한 음식물이 장내에서 충분히 소화되지 않아 이로 인해 혈장 내 아미노산 농도가 증가하기 때문임을 밝힘으로써, 장내미생물과 혈장의 화학적 조성이 연관될 수 있음을 보인 바 있다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 대사과정에 대한 시스템생물학.pdf
대사과정에 대한 시스템생물학.pdf