기술동향
선천면역에서의 miR-125와 miR-146에 대한 연구
- 등록일2017-09-12
- 조회수6137
- 분류기술동향
-
자료발간일
2017-08-29
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#miRNA#선천면역#염증성 질환#miR-146#miR-125
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
선천면역에서의 miR-125와 miR-146에 대한 연구
이혜미 / 충남대학교
[목 차]
1. 서론
2. miRNA의 생합성(biogenesis)
2.1 miRNA의 역할 및 생성과정
2.2 miRNA 타깃 예측 연구방법
3. 선천면역에서의 miR-125와 miR-146의 기능
3.1 선천면역에서의 miR-125a/b
3.2 선천면역에서의 miR-146a/b
4. 염증성 질환에서의 miR-125와 miR-146에 대한 연구
5. 결론
6. 참고문헌
[요약문]
miRNA (microRNA)는 약 18~22개의 핵산으로 이루어진 non-coding RNA로써 다양한 생리 반응을 조절한다. 최근 연구에 의하면 miRNA의 타깃 유전자가 인간의 염증 반응 악화를 제어하고 면역 항상성 유지에 핵심 역할을 담당하고 있으며 miRNA 생합성 조절 장애는 염증 발병 기전과 관련이 있을 것으로 예상된다. 본 분석에서 다루고자 하는 miR-125와 miR-146은 다양한 질병에서 톨 유사 수용체(toll-like receptor)를 매개한 신호 전달로 유전자를 발현함으로써 선천면역을 조절한다고 알려져 있다. 본 분석에서는 miR-146와 miR-125의 선천 면역 조절 기전 및 염증성 질환에서의 연구 결과를 살펴보고자 한다.
1. 서론
인간 게놈 지도가 2000년도 초반에 완성되었으나 아직도 생명 현상에 대한 정보에 대한 연구가 이루어지고 있다[1]. 특히 miRNA는 non-coding RNA로써 유전체상 기능 및 역할에 대한 연구가 미흡한 실정이다. 이를 증명하고자 생명과학, 의학 및 생물정보학의 융합 연구를 통한 분석이 이루어지고 있다. miRNA는 일반적으로 인간의 유전체상 protein coding gene 영역에서 전사가 일어난다고 예상하였다. 하지만 Next generation system (NGS)의 발전으로 대부분의 유전체 영역에서 매우 소량이라도 전사가 일어나고 있음을 밝혀졌다[1,3,4]. 특히, 1990년대 초반 miRNA의 발견은 인간 질병 치료에 활용하고자 연구가 진행되고 있다[5,6]. 질병 치료 및 진단에 활용하기 위해서는 타깃 유전자와 결합하여 유전자 조절 기능을 갖는 miRNA 특성을 활용한 구체적인 연구가 필요하다. 따라서 본 고에서는 miRNA 역할 및 연구방법에 대해 알아보고 질병과 관련한 miR-146a/b와 miR-125a/b의 연구 결과를 기술하고자 한다.
2. miRNA의 생합성(biogenesis)
2.1 miRNA의 역할 및 생성과정
miRNA는 유전자 발현을 조절할 수 있는 non-coding RNA이다. 현재까지 사람의 다양한 면역 세포(Natural killer cells, mast cells, macrophages, dendritic cells 등)에서 약 2천여 종 이상이 밝혀졌으며 그 기능은 세포 분화와 죽음의 조절, 지방 대사 및 암 발생 등을 담당한다고 알려져 있다[1-4]. 최근 대체 면역치료제로서의 miRNA 활용을 위해 면역 조절에 대한 연구가 급격히 증가하고 있는 추세이다. miRNA의 생성은 두 단계의 프로세싱으로 이루어진다. miRNA는 RNA polymerase II에 의해 한 개 이상의 hairpin loop를 가진 long primary miRNA trans로 전사되어 double-stranded RNA-결합 단백질인 DGCR8에 결합한 후, Drosha(RNase III enzyme)에 의해 precursor miRNAs (pre-miRNAs)로 잘려진다. 잘려진 pre-miRNAs은 Exportin-5에 의해 세포질로 이동되어 Dicer와 TRBP에 의해 22개 뉴클레오티드의 miRNA/miRNA duplex를 형성한다[5]. 이 duplex 중 한 가닥만이 guided strand로써 Argonaute protein에 loading되어 RNA-induced silencing complex를 만들고 타깃 mRNA에 결합하는 mature miRNA가 되는 것이다[6]. 이때 한 가닥이 RISC에 함입되어 타깃 mRNA에 작용하여 translational repression 혹은 degradation이 일어난다[7](그림1).
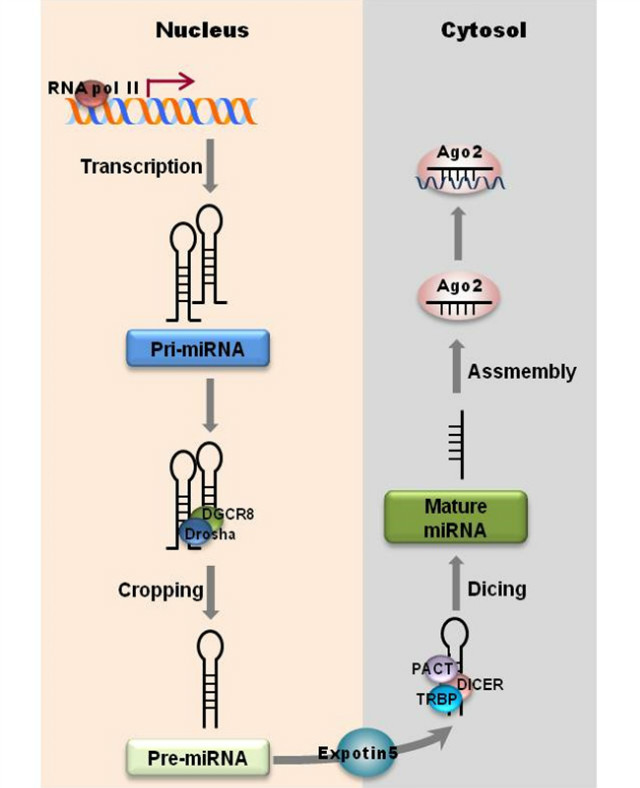
그림 1. miRNA 생성 과정
2.2 miRNA 타깃 예측 연구방법
miRNA가 조절하는 타깃 유전자를 검색함으로써 그 기능을 알 수 있다. 따라서 miRNA의 타깃 유전자를 예측하는 것이 연구의 첫 번째 단계이다. 인간의 mature miRNA는 약 2천여개가 데이터베이스화 되어 있다(miRBase database, version 20.0). 이를 수백~수천 개의 mRNA은 3'-untranslated region (3’-UTR)에 상보적으로 결합해 타깃 유전자의 발현을 억제한다. 생물학적 타깃 유전자의 3'UTR과 miRNA의 seed를 alignment하여 예측하고 구조적인 특징 혹은 진화적으로 보존된 결합자리를 추가함으로써 타깃 유전자 예측의 정확도를 높이기 위해 노력하고 있다[8]. 하지만 miRanda, MirTarget, TargetScan 등 프로그램들을 이용하여 miRNA의 여러 타깃 유전자를 예측함이 검색됨으로 실험을 추가적으로 진행하여 핵심 타깃 유전자를 발굴하는 과정이 필수적이다[8-11].
3. 선천면역에서의 miR-125와 miR-146의 기능
miRNA가 면역 세포 분화, 염증 매개체 방출, 숙주 방어 및 다양한 면역 질환의 조절에 중요한 역할을 한다[12-14]. 선천 면역 활성화에 의해 많은 miRNA가 신속하게 유도된다는 것은 여러 논문에서 밝혀졌다[15]. 본 장에서는 miR-125a/b 및 miR-146a/b의 선천 면역 및 염증 반응에 대한 연구 결과를 살펴보고자 한다.
3.1 선천면역에서의 miR-125a/b
miR-125a-5p는 LPS 자극에 의해 유도된 고전적인 M1 유형 활성화를 억제하는데 중요한 역할을 한다고 보고되었다. 또한, miR-125a-5p는 T 림프구 활성화 및 염증 유발 동안 KLF13 전사인자를 표적하여 M2 표현형의 IL-4 발현을 촉진 할 수 있다. 또한 miR-125a-5p는 식세포 및 살균 활성을 억제할 수 있다[16]. 최근 연구에 따르면 miR-125a-3p는 자외선 UV 저항성 단백질(autophagy UV radiation-resistance-associated protein)을 코딩하는 유전자를 표적하여 항균 반응을 억제하고 결핵균 감염에 대한 방어를 억제할 수 있다[17]. 또한, miR-125a가 대식세포 분화, 염증 및 자가포식을 조절함으로써 대식세포 반응을 억제할 수 있음을 제시하였다.
miR-125b-5p의 발현은 NF-kB 신호에 의해 조절된다. miR-125b-5p는 TNF-α 유전자의 3'-UTR 영역을 표적하여 염증 반응을 음성적으로 조절한다. miR-125b 및 miR-155의 발현 수준은 LPS로 유도된 Akt1 활성화에 의해 음성적으로 조절된다. 이는 마우스에서 내독소 내성을 조절할 수 있다[18]. 또한, 인간 대식세포의 LPS 자극은 miR-125b의 발현을 억제할 수 있다. 그러나, estradiol 전처리는 kB-Ras2는 NF-kB 신호 전달의 주요 억제제로 이를 코딩하는 mRNA의 안정성을 향상시킨다[19]. 최근의 연구 결과에 따르면 miR-125b-5p는 선천 면역 반응과 염증 과정에 필수적인 leukotrienes의 생합성에서 중요한 효소인 5-lipoxygenase를 코딩하는 유전자의 발현을 표적화하고 억제할 수 있다. 또 다른 연구는 miR-125b가 대식세포를 매개한 염증을 촉진시키고, co-stimulatory 인자의 발현을 증가시킴으로써, IRF4를 표적하여 항종양 활성을 증가시킴이 보고된 바 있다[20]. 이러한 연구결과는 miRNA가 다양한 생물학적 상황에서 각기 다른 역할을 담당함을 나타내는 것이다.
3.2 선천면역에서의 miR-146a/b
miRNA는 염증 반응을 조절하는 전염증성 사이토카인 생성의 음성 조절에 필수적인 역할을 한다[21]. miR-146a는 선천 면역 반응을 암 유전자 변형과 연결시키는데 관여한다.
miR-146a는 면역 세포의 증식을 조절하고 염증 반응을 억제하는데 중요한 역할을 한다[22,23]. 마우스를 대상으로 진행한 실험에서 miR-146a 결손은 골수 양성 종양의 표현형을 나타내며 NF-kB 신호의 만성 조절 장애와 관련이 있다고 보고되었다. 예로서 miR-146a를 코딩하는 유전자는 5q 증후군을 가진 골수 이형성 증후군(myelodysplastic syndrome) 환자의 조혈 모세포에서 결핍됨이 확인되었다. miR-146a 및 miR-146b는 모두 IRAK-1 및 TRAF6를 코딩하는 mRNA를 표적화함으로써 염증 반응을 조절할 수 있다[24-26]. miR-146a의 생체 내 결함은 대식세포 과다 활성화를 일으킬 수 있으며, 내독소(lipopolysaccharide, LPS)에 대한 전신 반응을 높이고 후에 자가 면역 표현형의 발달을 유발한다. 또한, miR-146a가 내독소 매개 사람 단핵세포에서 특이적으로 상향 조절되며 miR-146a가 내독소 내성(endotoxin tolerance)의 중요한 조절 인자가 될 수 있음을 확인하였다.
최근 miR-146a를 발현하는 렌티바이러스를 이용한 in vivo 연구에서는 miR-146a가 패혈증 유발 NF-kB 신호 전달 및 염증성 사이토카인의 생성뿐만 아니라 심근에서 IRAK 및 TRAF6 발현의 억제에 필수적이라는 것을 보여 주었다[27]. 인간 비강 상피 세포에 TLR3 자극은 phosphoinositide 3-kinase (PI3K), JNK 및 NF-kB 경로를 통해 miR-146a 합성을 유도할 수 있다. TLR2 자극은 miR-146a의 지속적인 발현을 유발할 수 있으며, 이는 사람의 상피세포에서 IL-8, CCL20 및 TNF-α의 합성을 억제한다고 보고되었다[28].
miR-146b는 TLR4, MyD88, IRAK-1 및 TRAF6를 매개한 신호 전달 경로를 표적한다[29]. TLR4 신호 전달의 활성화는 IL-10에 의해 매개되는 STAT3 의존성 경로를 통해 인간 단핵구에서 miR-146b 발현을 상향 조절한다[29]. 인간 제대 정맥 내피세포(HUVECs)에서 angiopoietin-1의 지속적인 발현은 miR-146b-5p 발현의 조절을 통해 LPS에 의해 유도된 IRAK1 및 TRAF6 수준을 감소시킬 수 있다. 하지만 angiopoietin-1는 HUVEC에서 miR-146a 또는 miR-146b의 발현에 영향을 줄 수 없다. 따라서 miR-146a와 miR-146b는 다양한 세포의 선천 면역 활동에 중요한 역할을 담당하며 염증 반응을 예방하고 세포 항상성 상태의 유지를 촉진함을 확인할 수 있었다.
4. 염증성 질환에서의 miR-125와 miR-146에 대한 연구
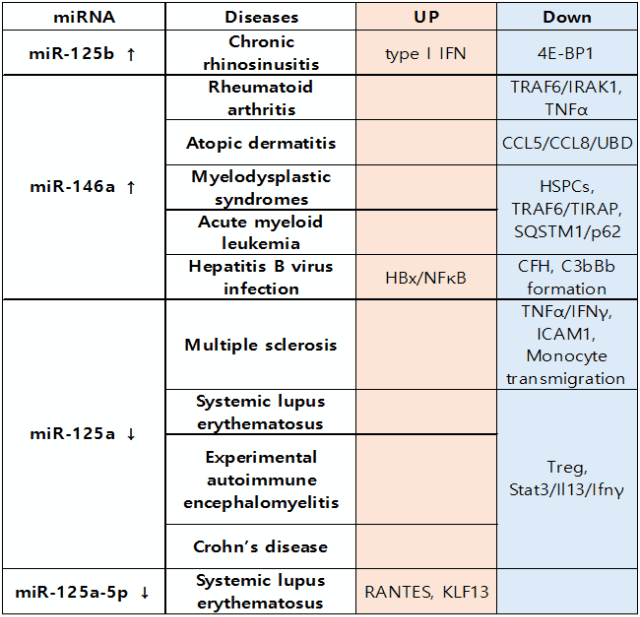
miRNA 발현의 조절 문제는 다양한 인간 질병의 발병 기전과 관련이 있으며 miRNA가 새로운 진단 또는 치료 표적으로 사용될 수 있다. 전신 홍반성 루푸스 환자에서 miR-125a 발현이 감소되어 있었다. miR-125a 과발현은 표적 유전자 KLF13의 발현을 조절함으로써 RANTES 염증성 케모카인을 억제할 수 있다[30]. 또한, 다발성 경화증 환자의 활동성 병변에서 miR-125a-5p 발현이 감소되었다[31]. 최근, miR-125a는 조절 T 세포 기능에서 필수적이며, 이 miRNA가 T 세포의 발현을 억제할 수 있음으로 필수적임을 밝혀졌다. miR-125a 수준은 자가 면역성 전신 홍반성 루푸스 및 크론병 환자의 말초 혈액 내 CD4+ T 세포에서 하향 조절된다[32]. miR-125b 상향 조절은 4E-BP1을 표적하여 기도 상피 세포에서 IFN-b mRNA를 상승시켜 점막 호산구 증가증을 악화시킬 수 있다[33].
miR-146는 miR-125에 비해 다양한 질환에서 연구가 보고되었다. 건강인과 류마티스 관절염 환자의 말초 혈액 단핵세포에서의 miR-146a 발현 수준을 비교한 결과 환자에서 유의하게 증가함을 확인할 수 있었다. miR-146a는 TRAF6와 IRAK1를 표적으로 한다[34]. 또한 아토피성 피부염 환자의 각질 형성 세포 및 피부 질환에서 miR-146a의 발현이 증가함을 확인하였다. 인간 각질 세포에서 miR-146a는 CCL5, CCL8 및 유비퀴틴 D를 포함한 다양한 전염증성 사이토카인 및 케모카인의 발현을 억제함을 관찰하였다. 또한, miR-146a 결손 마우스에서 피부 염증이 증가함에 따라 염증이 악화됨을 보고하였다[35]. 최근 연구에 따르면 miR-146a 합성과 B형 간염 바이러스(HBV) 감염 후 발생하는 간 손상의 병인의 상호 관계가 밝혀졌다[36]. 이러한 결과는 miR-146a가 만성 B형 간염 감염의 면역 병원 발생에 중요한 역할을 할 수 있다는 것을 시사하는 것이다. 따라서 miRNA는 다양한 세포 기능에 관여하는 유전자 발현 수준을 조절할 수 있다.
표 1. 염증성 질환에서의 miR-125와 miR-146 증가 혹은 감소에 따른 매개 기전
5. 결론
최근 선천 면역 신호 및 염증 반응에 있어서 miRNA의 역할에 대한 연구는 급속도로 발전하고 있다. 본 분석에서 다룬 miR-125와 miR-146는 선천 면역 반응에서 핵심 조절 인자임을 알 수 있었다. 해당 miRNA는 병원성 감염과 비병원성 염증에 대한 선천 면역 반응의 조절에서 많은 역할을 한다. miRNA는 잠재적인 진단 바이오마커로 급부상하고 있다. 이는 염증 및 감염병 등을 포함한 다양한 인간 질병 상태에서 중요한 번역 규제자이다. 따라서 miR-126 및 miR-146을 비롯한 miRNA에 대한 연구 결과 축척을 통해 새로운 역할과 관련된 분자적 메커니즘을 확인이 필수적이다. 이러한 연구는 면역 질환 및 염증에 대한 새로운 진단 및 치료 전략의 개발로 이어질 것이다.
6. 참고문헌
==> PDF 참조
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식


 pdf_0002806.pdf
pdf_0002806.pdf