기술동향
전분화능을 향한 ‘전사 인자를 통한 리프로그래밍’의 역사
- 등록일2017-09-21
- 조회수7174
- 분류기술동향
-
자료발간일
2017-09-07
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#전분화능#전사 인자#리프로그래밍
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
전분화능을 향한 ‘전사 인자를 통한 리프로그래밍’의 역사
성상현 / 서울대학교
[목 차]
1. 서론
2. 전분화능의 유도
2.1 리프로그래밍 인자 후보 발굴하기
2.2 쥐 유도만능줄기세포에 대한 첫 번째 보고
2.3 인간 유도만능줄기세포
3. 재조합 촉진자
3.1 전분화능 관련 유전자들
3.2 세포 주기 조절 유전자들
3.3 후생 유전학적 조절자
4. 유전체(genome) 편집제 및 에피지놈(epigenome) 편집제의 전달
4.1 엘리트 모델
4.2 확률론적 또는 결정론적 리프로그래밍
4.3 리프로그래밍은 두 단계 과정
4.4 발생의 역전(reversal of development)으로써의 리프로그래밍
4.5 인자들의 양과 화학양론
5. iPSC 기술의 비약적인 발전
6. 결론 및 제언
[요약문]
지난 십여 년간 세포의 운명을 조작할 수 있는 기술은 엄청나게 발전했으며, 대표적으로 유도만능줄기세포(induced pluripotent stem cells, iPSCs)를 시험관에서 제작함으로써 전분화능(pluripotency)을 유도할 수 있게 되었다. 이 과정은 기술적인 관점에서는 상당히 단순한데, 단지 숙주 세포와 잘 정립된 전사 인자들의 조합-OCT3/4, SOX2, KLF4, MYC(통틀어 OSKM)-만 있으면 된다. 전사 인자에 기반한 리프로그래밍 기전은 거의 밝혀지지 않았지만, 몇 가지의 이해는 얻어진 상황이다. 최근에는 기술의 효율을 증가시키는 면에서 큰 진보가 있었고, 그로 인해 재생 의학, 질병 모델링, 신약 발견 등의 분야에 대한 적용 가능성이 커졌다.
1. 서론
19세기 후반에, 어거스트 와이스만(August Weismann)은 ‘와이즈만 장벽’이라고 알려진 유전 이론을 주장했다. 그는 유전이 오로지 생식 세포를 통해서만 일어나기 때문에 체세포의 불필요한 유전 정보는 삭제되거나 불활성화되어야 한다고 주장했다. 20세기 중반 콘라드 와딩턴(Conrad Waddington)은 정상적인 배아의 발생을, 최종적인 분화 상태를 향해 언덕을 내려가는 공으로 표현하는 모델을 발전시켰다(그림 1). 와딩턴의 모델도 계열이 결정된 체세포의 운명은 영구적이라고 제안했다. 그러나 1962년에 존 고든(John Gordon) 경은 체세포 핵 치환(somatic cell nuclear transfer, SCNT)을 통해 처음으로 세포 리프로그래밍 사례를 보고했다(그림 1, 표 1). 체세포 핵 치환에서는 핵을 제공한 체세포의 정보를 가지면서 정상적으로 분열 가능한 배아를 발생시킬 수 있다. 이는 체세포의 핵이 모든 유전 정보를 가지고 있으며 또한 배아의 전분화능을 가지도록 리프로그래밍 될 수 있음을 의미한다. 고든의 발견 이후 마틴 에반스(Martin Evans) 경, 매튜 커프만(Matthew Kaufman), 게일 마틴(Gail Martin)은 착상 전의 배아로부터 자가 증식이 가능하며 전분화능을 가지는 배아 줄기 세포(embryonic stemm cells, ES cells)를 확립했다. 20세기 말에는 체세포 핵 치환을 이용한 복제 동물들이 탄생했다.
1983년에는 체세포를 다른 세포와 결합시켜 유전자 발현을 변화시킴으로써 리프로그래밍할 수 있다는 것이 보고되었다(그림 1). 대표적으로 배아줄기세포와 체세포를 결합시켰을 때 후생유전학적인 리프로그래밍을 통해 전분화능을 가지는 세포의 유전자 발현을 따른다는 것이 관찰되었다. 이러한 연구들은 체세포의 회춘 가능성을 보고할 뿐만 아니라, 체세포의 기억을 지울 수 있는 리프로그래밍 인자가 존재할 가능성을 시사한다.
추가적인 증거는 단일 전사 인자를 포유 세포에 도입해서 직접적으로 세포의 운명을 바꾸는 연구로부터 나왔다. 활발히 분열하는 근원세포(myoblast)에서 주로 발현하는 전사 인자 하나를 쥐의 섬유아세포에 도입했더니 근원세포로 전환되었다. 다른 연구들로는 골수아세포를 거핵세포로 전환한 실험, B 림프구를 대식세포로 전환한 실험 등이 있다. 체세포를 다른 종류의 체세포로 전환시키는 과정을 전환분화(transdifferentiation)라고 한다.
초파리의 전환분화 연구가 잘 알려져 있는데, 호메오 유전자인 Antennapedia에 돌연변이가 생기면 더듬이를 다리로 바꿀 수 있다. 또한 PAX6라는 포유동물 유전자의 상동 유전자를 발현시키면 눈이 없는 초파리 돌연변이체를 눈 구조체를 가지도록 만들 수 있다. 이러한 연구들은 세포 정체성을 결정할 수 있는 마스터 조절자에 해당하는 전사 인자가 세포의 운명을 바꿀 수 있다는 것을 시사한다.
이러한 연구들이 종합되어 유도만능줄기세포(induced pluripotent stem cells, iPSCs)의 발견에 이르렀다(표 1). 유도만능줄기세포는 체세포로부터 유래했으며 기능적으로 배아 줄기 세포와 거의 동일한 세포이다. 유도만능줄기세포의 발견은 직접적으로 세포의 운명을 전환시킬 수 있는 길을 열었다. 특정한 조합의 전사 인자를 발현시킴으로써 배엽(germ layer)의 한계를 넘거나 전분화능 단계를 뛰어넘어 세포를 리프로그래밍할 수 있는 것이다. 유도 만능 줄기세포는 신약 개발, 질병 모델링, 재생 의학 등의 분야에서 다양하게 적용 가능하다.

그림 1. 세포 운명 가소성에 대한 초기 연구들
예전에는 세포 운명의 획득이 미성숙한(전분화능) 상태에서 성숙한(분화) 상태를 향해 한 방향으로만 일어난다고 생각했다. 그러나 기념비적인 실험들에 의해 세포 운명은 유연하며 되돌릴 수 있음이 밝혀졌다. 세포는 회춘(rejuvenation)이나 리프로그래밍을 통해 분화된 상태에서 전분화능의 상태로 변화할 수 있다. 세포 가소성에 대한 첫번째 증거는 체세포의 핵 치환 실험이나 체세포와 전분화능 줄기세포의 융합 실험에서 드러났다. 또한 조직 특이적인 전사 인자를 과발현 시켜주면 분화된 세포를 다른 종류의 세포로 바꿀 수 있다는 것도 알려졌다(전환 분화).
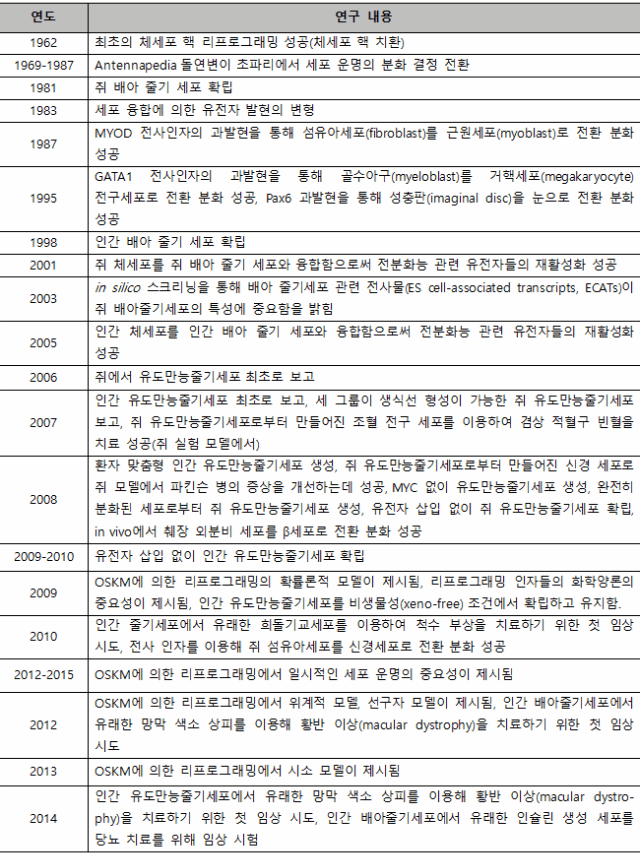
< 표 1. 리프로그래밍과 유도 전분화능 연구의 타임라인 >
2. 전분화능의 유도
2.1 리프로그래밍 인자 후보 발굴하기
이전의 실험들을 고려할 때, 수정된 난자나 배아 줄기 세포의 정체성을 결정하는 유전자가 리프로그래밍동안 전사 네트워크를 재형성할 것이라고 보는 것이 타당하다. 따라서 우리(Sinya Ya-manaka 그룹)는 2000년에 쥐 배아 줄기세포를 분석하여 전분화능이나 무한한 분열 능력과 관련 있는 유전자를 찾기 시작했다. 그 결과 줄기 세포와 연관된 전사물(ES cell-associated trans, ECATs)을 확립할 수 있었다. 다음으로 knockout 배아 줄기 세포나 knockout 쥐를 만듦으로써 ECAT의 기능을 확인하기 시작했다.
그 결과 NANOG 유전자가 배아 줄기 세포와 초기 배아에서 전분화능을 유지하는데 중요하다는 것을 밝혔다. 또한, NANOG를 과발현시키면 쥐 배아 줄기세포가 전분화능을 유지하는데 필요한 LIF(leukemia inhibitory factor) 없이 배양하더라도 자가 복제할 수 있다는 것을 발견했다. LIF는 STAT3(signal transducer and activator of tranion3) 경로를 활성화시켜 배아 줄기세포의 분화를 막는데 필요하다는 것이 알려져 있었다. NANOG 과발현은 LIF의 유무에 따른 배아 줄기세포의 유전자 발현 패턴을 비교하는 것이 가능하도록 했으며, 그 결과 KLF4가 LIF-STAT3 신호 전달의 하위에 있음이 밝혀졌다. KLF4의 과발현은 NANOG의 과발현과 유사한 방식으로 작동한다. 다른 그룹에서는 MYC, β-catenin, TCL1 등의 인자들이 쥐 배아 줄기세포의 유지에 중요함을 밝혔다. OCT3/4, SOX2가 전분화능과 연관된 유전자들을 조절한다는 것도 알려졌고, 이러한 인자들을 총 정리해서 리프로그래밍 인자 후보군으로 정리했다.
2.2 쥐 유도만능줄기세포에 대한 첫 번째 보고
다음 과정은 리프로그래밍 가능성이 있는 후보 유전자들을 쥐의 배아 섬유아세포(mouse embryonic fibroblast, MEF)에 주입하여 기능을 확인하는 것이다. 여기에는 유전자 전달에 높은 효율을 보이는 레트로바이러스를 이용한 형질도입 기법이 사용되었다.
우선 Fbxo15 프로모터에 의해 조절되는 β-galactosidase 유전자를 가진 MEF를 배양하여 24개의 후보를 테스트했다. 각 후보를 개별적으로 전달하기도 하고, 24개 전체를 한 번에 전달하기도 했다. 한 인자만 넣은 세포는 항생제 저항성을 가지지 못하고 죽었지만, 모든 24개 후보를 넣은 세포는 살아남았다. 이때 형성된 세포 콜로니는 배아 줄기 세포와 유사했으며 결과적으로 24개 후보 중에 리프로그래밍 인자가 포함되어 있음을 의미했다.
다음으로, 우리는 24개의 후보들을 최소의 조합으로 좁혀나가기 시작했다. 처음으로는 24개 중 1개씩을 제거한 후 23개씩을 한 번에 테스트했다. 결과는 매우 놀랍게도 10개의 후보로 좁힐 수 있게 해주었다. 다음으로는 OCT3/4, SOX2, KLF4, MYC(이후로는 OSKM 인자로 칭함) 4개의 유전자가 제거되면 콜로니 형성이 되지 않음을 관찰했다. 마지막으로 이 4개 유전자의 조합만으로 전분화능을 유도할 수 있으며, 이들이 정말로 최소한의 리프로그래밍 인자 조합임을 확인했다. 초기의 이 iPSC는 불완전한 전분화능을 보이기도 했는데, 어쨌거나 체세포를 리프로그래밍하여 전분화능을 갖게 한 최초의 사례임은 틀림없다.
2.3 인간 유도만능줄기세포
다음 단계는 인간 iPSC를 만드는 것이다. 우리는 OSKM 인자 이외에 인간 세포를 불멸화할 수 있는 SV40LT (simian virus 40 large T antigen)와 hTERT (human telomerase reverse tranase)를 테스트했다. 형질도입 효율이 매우 낮았기 때문에 인간 세포로 실험하는 것이 어려웠으나 우리는 OSKM 인자들이 인간에서도 역시 iPSC을 만들어낼 수 있음을 확인했다. 위스콘신 대학(Wisconsin University)의 제임스 톰슨(James Thompson) 그룹은 동시에 약간 다른 인자의 조합으로 iPSC을 만들었다. OCT3/4와 SOX2는 동일했으나 다른 둘이 달랐다. 흥미롭게도 우리와 제임스의 리프로그래밍 인자는 iPSC를 만드는데 서로 시너지를 보였으며 현재는 두 조합 모두 널리 사용되고 있다.
3. 재조합 촉진자
비록 OSKM 인자의 효용이 알려졌지만 리프로그래밍의 효율 자체는 상당히 낮았다. 따라서 많은 연구자들은 리프로그래밍의 효율을 높여줄 ‘재조합 촉진자’를 찾기 시작했다.
3.1 전분화능 관련 유전자들
리프로그래밍 인자들에 관한 추가적인 연구로 OCT3/4를 제외한 3가지 인자들의 기능이 중복되어 있음을 알았다. SOX2는 SOX1과 SOX3로 대체될 수 있으며 KLF4는 KLF2와 KLF5로 대체될 수 있다. 게다가 모든 MYC 군의 유전자는 리프로그래밍 효율을 증가시킬 수 있다. 중요한 점은, MYC 군의 다른 유전자들에 비해서 L-MYC 유전자의 종양 형성 능력이 훨씬 낮았기 때문에 임상 적용의 측면에서 안전한 인간 iPSC를 만들 것으로 기대를 모았다는 점이다.
최소한의 전분화능 인자들을 발현시키는 것 이외에 배아 줄기세포에서 많이 발현하는 유전자들을 발현시키는 것이 리프로그래밍 효율을 올려주거나 심지어 일부 리프로그래밍 인자를 대체할 수 있다는 것이 알려졌다. 쥐에서 TBX3를, 인간에서 UTF1, SALL4를 발현시켜 리프로그래밍 효율을 높인 사례가 있다. ESRRβ, NANOG의 발현은 KLF4를 대체할 수 있으며 NR5A2와 TCL1A는 OCT3/4를 대체할 수 있다. 이밖에도 특정한 마이크로 RNA나 RNA 결합 단백질, E3 유비퀴틴 결합 단백질 등이 리프로그래밍을 촉진한다는 것이 알려졌다. 이런 사례들을 볼 때, 몇 가지의 리프로그래밍 인자들은 비록 낮은 효율을 보일지라도 그것들의 하위의 타겟에 의해 대체될 수 있다. 대체자 역할을 하는 유전자들은 OSKM에 의해 변화된 리프로그래밍 네트워크의 일부분이다. 따라서 OSKM의 하위 타겟들을 연구하는 것이 리프로그래밍의 분자적 기전 이해와 효율 증가에 큰 도움이 될 수 있다.
3.2 세포 주기 조절 유전자들
체세포들은 iPSC가 되는 과정에서 전분화능을 획득해야 할 뿐만 아니라 무한히 분열할 수 있는 능력도 획득해야 한다. 리프로그래밍 인자 중 하나인 MYC은 세포 분열을 촉진하는 암유전자(oncogene)로 잘 알려져 있다. 따라서 다른 세포 주기 조절자들이 전분화능 상태로 세포를 바꿀 수 있을 가능성을 탐구해야 한다. 종양 억제 유전자인 p53이 iPSC 생성을 저해한다는 것은 중요한 발견이었다. iPSC를 만들 때 p53을 불활성화시키면 효율이 비약적으로 증가하는 것을 볼 때, p53은 리프로그래밍 과정에서 발생하는 DNA 손상과 세포 노화에 관련되어 있었다. 또한 cdk (cell cycle-dependent kinase)의 억제자인 CIP1, INK4A, ARF 등도 iPSC 생성을 방해한다는 것이 알려졌다. 반대로 세포 주기 촉진자인 REM2나 cyclin D1을 OSKM과 함께 발현시키면 iPSC의 생성이 촉진되었다. 따라서 리프로그래밍 촉진자들은 전분화능을 얻는 데 방해가 되는 것들을 제거하는 능력이 있다.
3.3 후생 유전학적 조절자
세포의 리프로그래밍은 후생 유전학적 변화과 관계가 깊으며 따라서 후생유전학적 조절자들의 역할을 연구해야만 한다. 히스톤 단백질의 번역 후 변형(post-translational modification)을 조절하는 효소들은 전분화능 관련 또는 체세포 관련 유전자들의 발현을 조절할 수 있기 때문에 세포의 운명을 특정한 방향으로 이끌 수 있다. 예를 들면, 전분화능 관련 유전자들의 발현이 증가하고 체세포 관련 유전자들의 발현이 억제되면 전분화능이 촉진될 수 있다. 다양한 사례들이 보고되어 있는데 각 인자들이 만들거나 제거하는 특정한 후생 유전학적 히스톤 변형이 어떤 것인지에 따라 리프로그래밍을 촉진하거나 저해한다. 한 가지 특이한 것은 후생유전학적 조절자 그 자체가 아니라도 비슷한 변화를 일으켜 전분화능을 조절할 수 있다는 것이다. 대표적으로 비타민C는 히스톤 메틸 제거 효소인 JHDM1A와 JHD1B를 촉진함으로써 전분화능 형성에 도움을 줄 수 있다.
히스톤의 변형을 조절하는 효소들 이외에 히스톤 구성 자체도 iPSC 생성 효율에 영향을 준다. 염색질로부터 히스톤 H1을 제거하면 염색질의 응축 상태를 조절할 수 있고 리프로그래밍 효율이 증가한다. 마지막으로 DNA의 메틸화 상태 또한 리프로그래밍 효율에 영향을 준다. DNA 메틸화 상태는 리프로그래밍에 반드시 필수적인 것은 아니지만, 정확한 DNA 메틸화가 존재하면 리프로그래밍의 초기 단계에서 중요한 역할을 하는 것으로 보인다.
4. 리프로그래밍의 기전
첫 발견 이후 10여년이 흘렀지만 OSKM에 의한 리프로그래밍의 기전은 완전히 이해되고 있지 않다. 하지만 몇 가지의 통찰이 제시되어 있다.
4.1 엘리트 모델
전사 인자를 통한 리프로그래밍이 매우 낮은 효율을 보인다는 것을 설명하기 위해 엘리트 모델이 제시되었다(그림 2a). 이 모델은 체세포의 전구 세포나 줄기세포의 매우 적은 일부분(엘리트)만이 iPSC로 리프로그래밍될 수 있고, 분화된 세포들은 리프로그래밍될 수 없다고 설명한다. 실제로 체세포군은 대개 매우 이질성이 크고 줄기세포를 포함한다. 그러나 이 모델은 계통 추적 연구와 복제 연구(clonal analysis)에 의해 반박되었는데, iPSC는 완전히 분화된 T백혈구나 B백혈구, 췌장 β세포, 간세포 등으로부터도 만들어 질 수 있다는 것이 보여졌다.
4.2 확률론적 또는 결정론적 리프로그래밍
성공적인 리프로그래밍은 다양한 사건들이 순차적으로 또는 평행하게 일어나야만 한다. 초기에는 체세포 관련 유전자를 억제하고 간엽성에서 상피성으로 전환(mesenchymal to epithelial transition)이 일어나야 하고 대사가 산화성 인산화에서 해당 과정 기반으로 바뀌어야 한다. 동시에 DNA 손상, 암유전자에 의한 세포 노화, 세포 자살 등이 리프로그래밍을 저해할 수 있다. 후기에는 전분화능 관련 유전자들이 활성화되고 조직 특이적인 전사 인자와 발생 유전자들이 활성화되며 그 유전자들의 프로모터가 H3K4와 H3K27에 메틸화 상태를 얻어야 한다.
원론적으로 OSKM이 형질도입된 체세포가 모두 리프로그래밍 될 수 있다고 가정한다면, 리프로그래밍 자체는 결정론적이거나 확률론적인 방식으로 이루어져야 한다(그림 2b). 만약 리프로그래밍이 결정론적 방식으로 이루어진다면, 형질도입된 모든 세포들의 리프로그래밍이 동기화되어 있을 것이므로 iPSC는 고정적이고 예측 가능한 시점에 등장해야 한다. 확률론적 모델은 리프로그래밍이 일어날 수도 있고 아닐 수도 있기 때문에 iPSC가 완전히 무작위적인 시간대에 등장하며 등장 자체를 예견할 수도 없다고 설명한다.
리프로그래밍 과정을 모두 완료할 가능성이 낮다는 점, 여러 가지 장애 요소를 극복해야 한다는 점을 고려하면 OSKM 인자에 의한 리프로그래밍이 확률론적이며 매우 낮은 효율을 가지는 것이라고 추측할 수 있다.
4.3 리프로그래밍은 두 단계 과정
몇 가지 연구들은 OSKM이 ‘개척자 인자’로 기능하여 다른 인자는 결합할 수 없는 염색질 부위에 결합하여 염색질 상태를 리모델링한다고 주장한다. 리프로그래밍 초기에 OSKM은 배아줄기세포에서는 결합하지 않는 영역을 포함하여 많은 유전자 부위에 결합해야 한다. 특히 MYC은 메틸화된 H3K4를 가지는 영역에 결합한다. 이 영역은 체세포 정체성을 결정하는 유전자의 인핸서와 프로모터를 포함한다(그림 2c). 동시에 OSKM은 초기 전분화능 관련 유전자의 인핸서와 프로모터에 결합하여 발현을 조절한다. 많은 유전자들에는 염색질을 응축되게 하는 억제성 메틸화 패턴이 존재하기 때문에 리프로그래밍 과정이 확률론적이고 비효율적으로 보일 수 있다. 이러한 장애는 염색질을 풀어주는 역할을 하는, 히스톤 아세틸기 제거 효소 억제자(histone deacetlyase inhibitor)를 사용해 줄일 수 있다. 그런데 후기 전분화능 유전자들의 발현은 ‘제2의 물결’로써 일어나며 위계적으로 일어나는, 예상 가능한 사건들로 보인다. OSKM은 리프로그래밍 후기가 되어서야 이러한 후기 전분화능 유전자에 접근할 수 있다. 따라서 초기의 확률론적인 리프로그래밍 과정이 부분적으로 리프로그램된 세포를 만들고, 그 세포들이 더욱 결정론적이고 위계적인 후기 단계로 들어가게 된다. 이러한 두 단계 모델과 일관되게, OKSM은 하위의 타겟들인 LIN28, SALL4, ESRRβ, NANOG 등으로 대체될 수 있다. OSKM에 의한 리프로그래밍의 복잡하고 단계적인 특징이 아마도 매우 낮은 효율에 기여할 것이다.
4.4 발생의 역전(reversal of development)으로써의 리프로그래밍
OSKM이 형질도입된 세포 중 극히 일부만이 리프로그래밍되지만, 요즘에는 특정한 표면 마커를 이용해서 해당 세포들을 분리할 수 있다(쥐에서는 SSEA1, 인간에서는 TRA-1-60). 이 세포들을 분석해보면, 일시적으로 중내배엽성 유전자(mesendodermal gene)를 발현하며, 이 유전자들은 초기 배아에서 배반엽상층(epiblast)이 분화를 시작하는 부위에서 발현한다. 따라서 이러한 일시적인 유전자 발현은 전분화능 세포가 분화된 세포로 발생할 때와 분화된 세포가 전분화능 세포로 리프로그래밍 될 때에 공통적으로 나타나는 사건이다. 또한 인간 세포 리프로그래밍의 후기에, 착상 전의 배아에서 발현하는 유전자들의 활성화가 관찰되었다. 이 때 레트로바이러스들이 과활성화되기도 하는데, 이 역시 인간 전분화능 세포와 착상 전 세포의 특징이다. 이러한 결과들은 전분화능을 향한 세포의 리프로그래밍이 부분적으로나마 초기 배아 발생의 역전 과정임을 보여준다.
4.5 인자들의 양과 화학양론
리프로그래밍은 느린 과정이다. iPSC를 만들기 위해서는 지속적으로 OSKM을 발현시켜서 불안정한 운명을 가지는 중간 상태를 뛰어넘어야 한다. 만약 이러한 결정(commitment)이 일어나기 전에 OSKM의 발현이 방해 받게 되면, 전분화능의 마커인 SSEA1을 이미 발현한 세포라 하더라도 iPSC가 되는 것에 실패하게 된다(쥐의 경우).
리프로그래밍의 성공을 결정짓는 다른 요소는 OSKM 발현의 적절한 화학양론이다. 예를 들어, 독시사이클린에 의해 일정하게 OSKM의 발현이 유도되는 쥐 섬유아세포의 경우에는 높은 리프로그래밍 효율을 보인다. KLF4 발현을 증가시키는 것도 효과적이다. OSKM 발현이 적절하지 않으면 중간 상태에 있는 세포가 리프로그래밍을 중단하고 iPSC가 될 수 없다. 또한 높은 OCT3/4 발현과 낮은 SOX2 발현이 높은 효율을 만들어낸다는 것도 알려져 있다.
초기 리프로그래밍 과정에서, OCT3/4는 중내배엽성 유전자의 발현을 활성화하고 외배엽성 유전자의 발현을 억제하며, SOX2는 반대로 작동한다. OCT3/4와 SOX2의 양적 균형은 리프로그래밍 초기뿐만 아니라 각 유전자가 실제로 발현하는 시기인 후기에도 중요하다. 결론적으로 유전자 발현의 시기와 강도, 그리고 전분화능 인자들의 화학양론이 리프로그래밍의 방향을 결정한다(그림 2d).
또한 반대 작용을 하는 인자들의 발현도 완전한 전분화능을 위해 중요하게 작용한다. 이는 ‘시소 모델’로 설명되는데, 세포의 운명을 결정하는 인자들의 불균형은 결국 원하지 않는 쪽으로 운명을 흘러가게 만들고 리프로그래밍을 실패하게 한다.
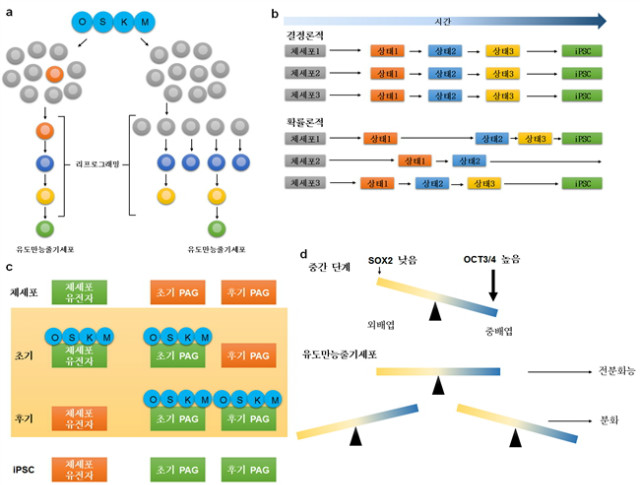
그림 2. 전사인자를 통한 리프로그래밍 기전에 대한 이해
a. 리프로그래밍의 엘리트 모델은 군집 내의 소수의 세포만이 iPSC가 될 수 있는 잠재력이 있다고 설명한다(왼쪽). 현재는 완전히 분화된 세포 또한 리프로그래밍될 수 있다는 것을 알고 있다. 그러나 실제로는 군집 내의 많은 세포들이 리프로그래밍을 시작하긴 하지만, 복잡하고 다양한 사건을 겪는 도중 대부분의 세포는 리프로그래밍을 완료하지 못하고 일부의 세포만이 iPSC가 된다(오른쪽).
b. 리프로그래밍은 결정론적(위)이거나 확률론적(아래)로 진행될 수 있다. 결정론적 과정에서는 모든 세포들이 완전히 동일한 과정을 따라 전분화능을 획득하고 고정된 지연기(latency)를 가진다. 확률론적 과정에서는 세포 군집 내에서 상태 간의 전이가 매우 다양한 형태로 나타나며 iPSC가 될 때 서로 다른 지연기를 가진다.
c. 리프로그래밍은 초기와 후기 두 단계로 나뉘어 일어난다. 체세포에서는 체세포 유전자들이 활성화되고 전분화능 관련 유전자들(PAG)은 억제된다. 리프로그래밍 초기에 OSKM 인자들이 체세포 유전자와 초기 PAG의 프로모터와 인핸서에 결합한다. 후기가 되어서야 OSKM은 후기 PAG에 접근할 수 있고 발현을 조절한다. iPSC에서는 외부에서온 OSKM 인자들은 발현하지 않고 초기와 후기 PAG가 완전히 발현하며, 체세포 유전자는 억제된다.
d. 리프로그래밍에서 인자들의 화학양론은 중요하다. 초기 단계에 OCT3/4는 높고 SOX2는 낮은데, 이것은 중간 단계에서 일시적인 중배엽적 특성을 유도한다. 안정적인 전분화능을 위해서는 세포 운명을 결정짓는 인자들의 균형이 맞아야 한다.
5. iPSC 기술의 비약적인 발전
iPSC가 임상적인 적용에 엄청난 잠재력을 가질 것이라는 기대가 존재한다. 그러나 첫 세대의 쥐 iPSC는 사용을 제한해야 할 단점들이 있었다. 무엇보다도 불완전한 전분화능을 보였는데, 이는 최근의 발전으로 iPSC의 질과 생성 효율이 증가하면서 상당히 해결되었다.
또 다른 중요한 문제는 초기에는 리프로그래밍 인자들을 전달하기 위해 레트로바이러스 벡터를 사용했다는 점이다. 이 벡터는 숙주 세포의 유전체로 삽입되어 들어가고, 그 결과 주변 유전자들의 망가짐이나 비정상적인 활성화를 유발할 수 있다. 또한 리프로그래밍 인자 자체가 나중에 재활성화될 위험이 존재한다. 실제로, iPSC에 의해 만들어진 키메라 쥐가 MYC을 재활성화하여 종양을 형성한 것이 보고되었다. 이 문제는 효율적이고 유전체에 삽입되지 않는 기술을 도입하면서 해결되었다. 아데노바이러스, 플라스미드, 트랜스포존, 센다이 바이러스(Sendai virus), 합성 mRNA와 단백질 등이 실제로 사용되었다. 요즘에는 에피좀 벡터와 센다이 바이러스, 합성 mRNA가 iPSC를 만들 때 주로 사용되고 있다. 최근에는 특정한 조합의 화합물로 iPSC를 만든 사례가 보고되었다. 또한, 비생물성(xeno-free) 조건들이 계속 개발되어 전통적 세포 배양법의 문제를 해결하려 하고 있다.
이러한 진보들은 iPSC를 실제 치료 목적으로 사용 가능하도록 했다. 겸상 적혈구 빈혈증을 보이는 쥐 모델에 iPSC로부터 만들어진 혈액 줄기 세포(hematopoietic progenitor)를 처리하여 효과를 보았다. 또, 쥐 iPSC로부터 만들어진 신경 세포를 파킨슨 병과 척수 손상을 가진 쥐 모델에 처리하여 안전하게 치료한 사례가 있다. 인간 iPSC로부터 만들어진 신경 줄기 세포를 척수 손상이 생긴 유인원에 처리하여 안정성과 효율성을 검증했다.
6. 결론 및 제언
처음 생겨나고 10여 년이 흐르는 동안 iPSC 기술은 임상 적용과 질병 모델링에서 이미 그 잠재력을 증명했다. 이러한 잠재력은 환자에서 유래한 iPSC 내의 돌연변이를 교정하기 위한 유전체 조작 기술과, iPSC를 특정한 세포로 분화시킬 수 있는 리포터 라인의 개발로 더욱 강화될 것이다. 전분화능 상태로 되돌리지 않고 세포의 운명을 원하는 것으로 바꿀 수 있는 직접적 리프로그래밍의 가능성도 존재한다.
그럼에도 iPSC를 만드는데 있어 해결되지 않은 문제들이 있다. 착상 전 배아에서는 전분화능의 세포들이 ‘순수한’(naive) 상태로 있다가 착상 후에 ‘준비된’(primed) 상태가 된다. 쥐의 배아줄기세포와 iPSC는 동일한 특징을 보이는데, 착상 전 세포들처럼 ‘순수한’ 상태이다. 그러나 현재의 인간 배아줄기세포와 iPSC는 착상 후 세포들과 비슷하게 ‘준비된’ 상태이다. 준비된 전분화능 세포는 세포 군집 내에서 이질성을 보이고, 분화 가능성을 가진다. 이러한 다양성이 인간 전분화능 세포를 표준화하는 것을 어렵게 만든다. 또한 완전히 리프로그래밍된 쥐 iPSC의 전분화능은 배아줄기세포와 구별할 수 없는데, 인간의 경우에는 논쟁의 여지가 남아 있다. iPSC의 유전적 배경이 다양하고, 인간 배아줄기세포의 클론들 사이에도 차이가 존재하기 때문에 분석이 어렵지만, 최근의 기술 발전들이 이를 해결해나가고 있다. 또 다른 중요한 한계는 리프로그래밍 자체가 매우 드물고 확률적인 사건이며, 때때로 부분적으로만 리프로그래밍된 iPSC를 만든다는 것이다. 따라서 iPSC를 임상적으로 사용하기 전에 반드시 전분화능을 신중하게 평가해야 한다.
단점들에도 불구하고 세포 리프로그래밍은 한 기부자로부터 수백의 iPSC를 만들어낼 수 있는 강력한 기술이다. 안전하고 완전하게 리프로그래밍된 iPSC를 동정해낼 수 있는 품질 관리법을 개발한다면 임상 적용에서 큰 진보를 이룰 것이다. 인간 배아줄기세포로부터 유래한 세포를 이용한 임상 치료 시도가 이미 미국 식품의약품국에 의해 승인되었으며, 일본에서도 iPSC를 이용한 치료를 시작하고 있다. iPSC를 이용한 치료 시도와 함께 더욱 정확한 분자적인 이해를 위한 기초 연구가 계속 이루어지면서 iPSC의 완전한 잠재력이 드러나기를 기대한다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0002812.pdf
pdf_0002812.pdf