기술동향
개인유전체 분석시장의 현황 및 전망
- 등록일2017-11-14
- 조회수20066
- 분류기술동향
-
자료발간일
2017-11-02
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#유전체#유전자 분석
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
개인유전체 분석시장의 현황 및 전망
김정민 / 제노플랜코리아㈜
[목 차]
1. 서론
2. 본론
2.1 개인유전체 분석시장의 현황
2.2 개인유전체 분석시장의 제한
2.3 개인유전체 분석시장의 전망
2.4 관련 산업으로의 확대 및 전망
3. 결론
4. 맺는 말
5. 참고문헌
[요약문]
지난 2016년 6월 30일부터 제한적이긴 하지만 DTC (Direct-to-consumer) 유전자검사가 허용되었으며, 국내에서도 개인유전자 혹은 개인유전체 분석(PGS, Personal Genetic/Genome Service) 시장이 열렸다 할 수 있다. 앞서 2011년 애플 창업자 스티브 잡스는 본인의 췌장암 원인 유전자를 확인하기 위해 개인유전체를 분석하였으며, 2013년 할리우드 배우 안젤리나 졸리는 BRCA 유전자를 검사하고 유방암을 예방하고자 유방 절제술을 받은 바 있다. 이들은 개인유전체 분석의 대중화에 한 몫을 하였다. 1990년에 시작되어 13년간 진행된 인간게놈프로젝트(HGP)에 소요된 유전체분석 비용은 30억 달러였으나, 2011년 스티브 잡스는 10만 달러, 2014년 1,000달러 시대를 거처, 2017년 기준 향후 수 년 이내에는 100달러 시대로 진입할 것이라 전망했다. 분석에 소요되는 시간 역시 수 일에서 수 시간으로 단축될 것으로 예상된다. 이로써, 개인유전체 분석을 통해 자신과 가족의 질병 위험과 건강 이상 여부를 파악해 미리 대처하는 것은 물론 개인맞춤 치료를 가능하게 할 정밀의학(Precision Medicine)의 현실화가 앞당겨질 것으로 기대된다. 복잡한 형질(Complex Traits)과 질병(Diseases)과의 유전적 상관성(Genetic Correlations)을 규명하기 위하여 전장유전체 시퀀싱(Whole Genome-seq), 전사체 시퀀싱(Tranome-seq), 후성유전체 시퀀싱(Epigenome-seq) 등이 대단위로 여러 연구 그룹에서 진행되고 있지만, 여전히 표본편중 현상(Nonrandom Sampling), 질병의 복잡성(Disease Complexity), 바이오 빅데이터(Bio Big Data)의 부재, 획기적인 생물정보학(Bioinformatics)적 분석방법의 발전 등의 제한점이 산재되어 있다. 그러나 임상유전체학(Clinical Genomics)적 연구성과에 힘입어 개인유전체 분석의 필요성 및 활용성은 계속 증대될 전망이다.
1. 서론
개인유전체 분석 분야는 유전학 및 의학에 근거한 바이오 헬스케어 산업의 한 영역이며, 핵심 목표는 유전적 변이(Genetic Variant)와 질병 혹은 형질과의 연관성을 이해하는 것이다[1]. 최근에는 정밀의학(Precision Medicine: 질병을 치료하는 것이 아니라 개개인 환자를 치료) 시대를 위한 접근적 수단이자 도구로 여겨지고 있다[2]. 미국의 ‘정밀의학 이니셔티브(100만 명 개인유전체 분석 포함)’, 중국의 ‘100만 명 오믹스 데이터베이스 프로젝트’, 영국의 ‘10만 게놈 프로젝트’, 일본의 ‘질병극복을 위한 게놈의료 실현화 프로젝트’, 그리고 한국의 ‘포스트게놈 다부처 연구사업’(2014년~2021년, 5,788억원 연구비 규모) 등 정부주도 대규모 연구사업의 성과는 미래 의료 혁명을 주도할 것이다[3].
개인유전체 분석이란 무엇인지, 개인유전자 분석과 비교하여 기술하면 다음과 같다. 유전학(Genetics)은 생명의 기본 요소인 유전자의 기능을 이해하고 세대를 통해 유전되는 현상을 밝히는 학문이다. 유전체학(Genomics)은 모든 유전자 전체를 게놈(Genome)이라 하는데 이 게놈 내의 유전자가 어떻게 상호작용하고 또한 개인이 처한 환경과 어떻게 상호작용하는지 연구하는 것이다[4]. 개인유전자 분석은 기능이 알려진 특정 유전자들을 분석하는 것이지만, 개인유전체 분석은 질병 혹은 형질과의 관련성을 게놈 수준에서 분석하는 것이다. 즉, 개인유전자 분석은 낭포성 섬유증, 혈우병, 헌팅턴병, 페닐케톤뇨증, BRCA1/2 유전자(유방암, 난소암 등에서의 영향) 등의 유전적 결함(inherited disorder)을 분석하는 것이라면, 개인유전체 분석은 암, 심장병, 당뇨병, 천식 등의 복합 질병(complex disease)에 대한 유전적 결함 및 환경적 요인을 함께 결합하여 분석하는 것이다[5]. 이처럼 개인유전체 분석은 예를 들면 미래에는 모든 종류의 암을 평가하는 표준이 될 수 있지만, 현재에는 대부분의 경우 임상의학 및 유전학적 관점에서 연구되고 증명되지 않은 상태이다. 궁극적으로 환자의 임상 병력과 종양 생물학에 대한 올바른 이해를 위해서는 앞서 언급한 현존하는 제한점을 넘어서야만 한다. 현재는 대부분 개인유전자 분석에 머물러 있지만, 분석장비의 급격한 기술적 발전에 힘입어 개인유전체 분석을 위한 환경적 조성이 마련되었다고 볼 수 있다. 특히 연구 환경(대규모 프로젝트의 시작) 및 관련 기업들의 움직임(대규모 투자유치로 인프라 구축)을 미루어 보건대, 해외에서는 개인유전체 분석시대를 대비하고 있음에 틀림 없다. 향후 가시적인 성과가 발표되고 활용될 수 있을지 주목할 만하다. 예측하건대, 미래에는 양질의 개인유전체 정보의 축적에 힘입어 표현형적 형질(traits)과의 관련성을 보다 자세히 제시할 수 있을 것이라 기대한다.
DTC 유전자검사의 시장규모는 2015년 800억 원 정도에서 매년 25.1% 정도 증가하여 2022년에는 4,000억 원 이상으로 성장할 것으로 전망하고 있다[6]. 국내에서 허용된 DTC 유전자검사가 가능한 항목은 체질량지수, 중성지방, 피부노화, 비타민C 농도 등 12항목이다. 국내에서는 특히 개인유전자 검사에 대하여 긍정적인 기대효과보다 우려의 목소리와 함께 관련 당국의 정책적 규제에 의해 접근성과 활용성 면에서 제한적이다. 분석 결과에 대한 임상적 검증 여부 및 과잉진단이나 과잉치료로 인한 부작용 등 관련 산업의 비과학적이고 무분별한 파생을 배제할 수 없기 때문이다. 그러나, 개인유전체 검사의 참여 동기를 묻는 설문조사에서(전체 305명 중) 81.2%의 응답자가 ‘내 유전자에 대한 호기심’ 때문이라 응답했다. 또 78.4%는 ‘내재된 위험질병을 발견’하기 위해 개인유전자 검사에 참여했다고 응답했다[7]. 또 다른 설문결과에서는 (전체 1,051명 중) 42%가 유전체 검사 후 건강 관리에 긍정적인 영향을 끼쳤으며, 이중 72%는 식사패턴에, 61%는 운동습관에 영향을 끼쳤다고 응답했다. 한편 의사와 상의 없이 처방약을 바꾼 경우는 1%도 안된 것으로 조사되었다. 즉, 상당수 사람들은 위험도가 높게 나온 질병에 대해 관심을 갖고 식습관을 개선하거나 운동을 시작했다는 조사결과이다[8]. 특히 질병은 사후 대처보다 발병을 미리 막는 예방이 최선이다. 개인유전체 분석은 특정 질병이나 건강 위험을 사전에 파악해 대처토록 한다는 점에서 정밀의료, 예방의료 등 미래의료 구현의 핵심 요소임은 틀림이 없다[9].
임상적 신뢰성을 지나치게 강조하면 연구 및 산업환경의 기회를 놓칠 수 밖에 없다. 정밀의학 시대의 글로벌 트렌드와 바이오 산업의 순항을 위해서라도 균형 있고 조화로운 이해의 수준을 조율할 때이다. 본고에서는 개인유전체 분석(본고에서는 개인유전자 분석과 구분 없이 혼용하여 표현함) 시장의 현황과 제한점 그리고 미래의 전망에 대하여 논한다.
2. 본론
2.1 개인유전체 분석시장의 현황
정밀의학이란 환자마다 다른 유전적, 환경적 요인과 질병 경력, 생활 습관 등을 사전에 인지해 적정한 환자에게 적정한 약을 적정한 용량으로 적정한 시간에 사용하여 환자별로 최적화된 치료법을 제공하는 것을 포함한다[10]. 이를 위한 개인유전체 분석은 인간게놈프로젝트가 완성된 2003년 이후부터 시작되었다고 볼 수 있다. 23앤미(23andMe), 파운데이션 메디신(Foundation Medicine), 패쓰웨이 지노믹스(Pathway Genomics)는 이 분야의 대표적인 회사들이다. 국내에서는 테라젠이텍스, DNA링크, 제노플랜 등이 비슷한 서비스를 제공 중이다[9]. 개인유전체 데이터 생산 및 분석기술의 발전 그리고 관련 주요회사들의 일부 사례를 중심으로 개인유전체 분석시장의 현황을 살펴보고자 한다.
유전체 연구기법 중 마이크로어레이(microarray) 기술을 주도해 온 미국 어피메트릭스 (Affymetrix)사-현재는 Thermo Fisher Scientific 사에 합병-를 제친 NGS (Next Generation Sequencing) 기술의 독보적 전문기업인 일루미나(Illumina)사의 개인유전체 분석을 위한 행보는 가히 눈부시다. 지난 2017년 초 JP모건 증권사가 주최한 헬스케어 콘퍼런스에서 2일 이내에 약 60명의 전장 유전체를 분석할 수 있는 ‘노바식 6000’을 소개하고, 수년 이내 ‘100달러 유전체 분석 시대’를 열 것을 선언했다[11]. 지난 2014년에는 독보적인 NGS 기술을 이용하여 주요 암연구소(Dana-Farber Cancer Institute, Fred Hutchinson Cancer Research Center, MD Anderson Cancer Center, Memorial Sloan Kettering Cancer Center)와 함께 Actionable Genome Consortium을 설립하고 암의 진단, 분류 및 치료를 위한 ‘암 게놈 분석표준법’을 정립한다고 선언했다[12]. 이의 성과물로 2016년 미국 암 학회에서 암 환자의 혈장 cfDNA (Cell-free DNA)를 이용하여 비침습적 방법으로 비소세포성폐암 (NSCLC) NGS 패널을 개발하고 있다고 발표하였다[13]. 한편 일루미나사는 자기자본과 외부자본 1억 달러를 투자해 ‘앱스토어’를 표방한 자회사 Helix를 설립(2015년)한 바 있다[14]. ‘100달러 유전체 분석 시대’의 맞물려 저렴하게 분석한 개인유전체 데이터를 고객이 각 구매한 앱(6개 분야 24개 서비스: 가계, 엔터테인먼트, 가족, 피트니스, 건강, 영양 등의 분야에서 유전적 분석결과의 해석 및 개인맞춤 가이드 제공)을 활용하여 ‘What will your DNA tell you?’이란 슬로건처럼 고객이 얼마만큼 만족할 것인지, 그리고 얼마만큼 성장할 수 있는지 귀추가 주목된다.
단일 유전자 이상으로 발생하는 유전질환인 멘델성 질환(Mendelian Disorder)은 대부분 유전자 분석을 통해 질병을 진단(Diagnostics)할 수 있다. 즉, 유전자와 질병 사이의 상관관계가 직접적이고 강한 이러한 유전질환의 개인유전자 분석은 진단의 영역에서 정확도가 높다. 이와는 달리, 유전적 소인이 제각각인 만성질환을 포함한 대부분의 질병은 진단 보다 정확도는 떨어지지만 개인유전자 혹은 개인유전체 분석을 통해 질병의 발병 위험도를 예측할 수 있다. DTC 개인유전자 분석시장을 선도하는 기업인 23앤드미(2006년 창립)는 ‘질병위험도 예측성 검사’를 가장 먼저 사업화 했으며 현재까지 이 분야의 대표 기업이기도 하다. 고객의 타액을 이용하여 약 65만개의 유전체(SNPs: single nucleotide polymorphism)를 분석하고, 120여개의 주요 질병에 대한 발병 확률, 50여개의 유전 질병에 대한 유전성 위험인자 보유 현황, 20여개의 약물에 대한 민감도, 60여개의 유전적 특징을 분석하여 제공한다[15]. 질병의 진단과 위험도 예측성 검사의 엇갈린 이해관계에서, 진단으로 오인될 소지가 있다고 판단한 미 FDA로부터 안전성 및 유효성의 입증을 권고 받은 바도 있었으나(2013년), 2015년 희귀유전 질환인 블룸증후군(Bloom Syndrome)의 보인자(carrier) 여부 테스트에 대한 DTC 승인을 획득하기도 했다[16]. 개인유전자 분석의 효용이 있는 질병부터 FDA 허가를 얻어 적용 영역을 확대하겠다는 전략이 결실을 맺은 것이다. 이후 제넨텍, 화이자 등을 포함 14개의 제약사 및 연구기관과 파트너십을 체결했으며 제넨텍과는 6천만 달러(업프론트 천만 불과 마일스톤 5천만 불)의 공동개발 연구계약을 맺었다[17]. 또한 2017년 4월에는 FDA로부터 파킨슨병, 알츠하이머, 셀리악병, XI 혈액응고 결핍증 등 10가지 질병에 대한 DTC 승인을 추가로 획득했다[18]. 이는 앞서 언급한바 있는, 로슈 그룹에 속해 있는 제넨텍과 파킨슨병에 걸린 환자 3천명에 대한 개인유전체 분석계약 체결(2015년 1월)의 연구성과라 할 수 있다. 200만 명 이상의 개인유전체 분석결과를 보유한 23앤드미의 기업가치는 2017년 현재 11억 달러(약 1조 2400억원)로 평가하고 있다[19]. 개인유전체 분석의 중요성을 대변하고 산업적 활용성이 높다는 것을 대변하는 대표적인 사례이다. 즉, 개인유전체 정보는 제약회사와 신약 공동개발에 활용 가능하고 정밀의학 시대에 개인맞춤 치료까지 이어질 수 있다. 단순 일회성 테스트로 구성되는 시장이 아니라 다양한 형태의 사업모델로 확장이 가능할 것이다. 그러므로 유전자 정보와 더불어 개인의 생활습관 등을 포함한 양질의 데이터를 확보하는 업체가 유전체 분석 시장을 주도할 것이다[17].
미리어드제네틱스(Myriad Genetics, 1992년 설립)사는 유방암과 난소암 발병에 영향을 미치는 유전자 BRCA1/2의 개인유전자 분석 전문기업이다. 미리어드제네틱스 사는 2015년 기준 100만 명 이상의 BRCA1/2 개인유전자를 분석했으며, 이로써 BRCA1/2 유전자 변이와 유방암 및 난소암과의 발병위험도 상관관계를 가장 정확하게 예측할 수 있다. 미리어드제네틱스사에서 발표한 논문에 의하면, 실제 고객시료 24,650명에서 발견된 2,017개 BRCA1/2 변이를 주요 데이터베이스(five publicly accessible BRCA1 and BRCA2 variant databases: BIC, ClinVar, HGMD, LOVD, UMD)를 활용해 분석한 결과, 65.79%만이 한 개 이상이 데이터베이스에서 찾을 수 있었다. 이는 public DB를 활용할 경우 BRCA1/2 변이에 대하여 35%는 해석할 수 없다(VUS; Genetic Variants of Uncertain Clinical Significance)는 의미이다[20]. 미리어드제네틱스사의 VUS는 2.1% 수준에 불과하다고 발표하고 있다[21]. 2009년 미국시민자유연맹 등 시민단체는 미리어드제네틱스사가 가지고 있는 유방암과 난소암 발병 유전자 BRCA1/2의 특허권 취소 소송을 냈다. 연방대법원까지 올라간 긴 논쟁 끝에 2013년 6월 미국시민자유연맹은 승소했다. 즉, 미 연방대법원은 자연적으로 타고난 DNA, 유전자는 특허 대상이 될 수 없다는 것이다. 그러나 연방대법원의 판결에도 불구하고, 미리어드제네틱스사의 매출은 꾸준히 상승했으며, BRCA1/2 개인유전자 분석을 통한 유방암 및 난소암의 발병위험도 예측성 검사는 여전히 미리어드제네틱스사가 선점하고 있다. 개인유전자 분석시장의 진입장벽은 특허가 아니라 데이터임을 증명한 대표적인 사례이다[15, 22].
유전자 검사 및 유전상담 전문기업인 카운실(Counsyl, 2007년 설립)사는 임신 전 미래 자녀의 다운증후군 가능성, 유방암, 난소암 등 암 발병 위험성을 포함 100여 개의 유전질환에 대한 유전적 위험도 예측 및 예방 목적의 개인유전자 분석결과를 제공하고 있다. 카운실에 따르면, 약 2.1%의 부부는 같은 유전질환 보인자이며, 이 경우 4분의 1의 확률로 유전질환 자녀가 태어날 수 있다. 유전자 검사 서비스를 통해 위험 가능성을 인지하게 되면 ‘인공 수정’ 혹은 대안을 간구할 수 있다[23].
2017년 8월부터 퍼킨엘머(PerkinElmer, 광학용 렌즈회사로 1937년 설립, 의학 및 화학 분야 등 분석장비 전문기업) 사는 신생아의 유전질환 진단을 위한 전장엑솜 시퀀싱(Whole-exome Sequencing) 및 전장유전체 시퀀싱(Whole-genome Sequencing)을 제공하기 시작했으며, 신생아의 유전질환의 조기발견을 목적으로 하고 있다. PerkinElmer Genetics는 1994년부터 600만명 이상의 신생아 유전체를 분석했으며, 일루미나사가 출시한 노바식 플랫폼에서 유전체분석을 수행한다고 공개했다[24].
앞서, 정밀의학 시대에 발맞추어 중국의 ‘100만 명 오믹스 데이터베이스 프로젝트’에 대하여 언급한 바 있다. 이를 수행하고 있는 베이징게놈연구소(BGI)를 중심으로 중국의 개인유전체 분석의 발전 행보에 대하여 기술한다. BGI는 1999년 인간게놈프로젝트 컨소시엄에 참여하기 위해 중국 정부에 의해 신발공장을 개조해 만들어진 비영리 연구조직이었다. 당시 유전체 해독의 1%를 맡았다. 인간게놈프로젝트가 종료된 이후 2007년 BGI-Shenzhen을 설립하고 유전체 사업을 시작하게 된다. 2010년에는 중국개발은행으로부터 15억 달러를 투자 받아 4,000명의 직원을 고용, 156대의 염기서열분석장비를 도입, 이후 전세계 유전체 분석시장의 20%를 장악했다. 2012년에는 미국의 유전체분석 장비업체인 컴플리트제노믹스(Complete Genomics)사를 인수, 일루미나 사와 경쟁구도를 기도하고자 했다[25]. 장비개발에 대한 성과는 지지부진했다는 소식도 있으나, 아직 속단하기는 이르다. 2015년 1월 제33회 J.P. Morgan Healthcare 회의에서 임상 시험(비침습적 태아 기형아 검사; Non-invasive Prenatal Testing), 암 패널(TumorCare), ‘100만명 오믹스 데이터베이스 프로젝트’ 등의 사업을 발표한 바 있다[26]. 2016년 6월 국제학술지 '네이처'에서는 중국 과학을 특집으로 다뤘다. 중국 정부의 ‘15년 정밀의학 계획(15-year precision-medicine initiative)’은 미국의 ‘정밀의학 이니셔티브’와 유사하다 할 수 있으며, 개인 맞춤형 진단과 치료를 목적으로 하고 있다. 기술되어 있는 것처럼, BGI(China National Genebank) 이외 Novogene, WuXi PharmaTech, Cloud Health, iCarbonX사의 행보에 주목할 만하다[27].
국내 개인유전체 분석시장 및 관련기업의 현황은 이전보고서에서 잘 정리되어 있다[3, 6]. 특히 국내 개인유전체 분석시장은 도입기 내지 초기 성장기에 접어들었다고 볼 수 있고 또한 앞서 언급한 것처럼 12개 항목에 대한 제한된 DTC 허용으로 법률적 규제에 의한 제한된 성장이 예고되고 있다.
2.2 개인유전체 분석시장의 제한
시간과 비용 면에서 개인유전체 분석 기술은 매우 빠른 속도로 발전해 왔다. 그러나 질병의 진단 및 예측의 관점에서의 임상적 활용성 면은 분석기술의 발전속도에 비해 답보 상태에 있다고 할 수 있다.
DTC는 개인의뢰 유전자검사 즉, 의료기관이 아닌 유전자검사기관이 직접 유전자검사를 실시하는 것을 말한다. 개인유전체 분석이 반드시 DTC일 필요는 없다. 그러나, 개인유전체 분석시장이 성장하기 위해서는 DTC 유전자검사의 확대가 요구된다. 앞서 기술한 바 있지만, 23앤드미는 250여개의 DTC 개인유전체 분석결과를 고객에게 제공했었다. 미 FDA는 의학적 검증자료를 요청하지만 이에 대응하지 않았으며, 2013년 11월 결국 질병위험도 및 약물 민감도 분석의 정확도와 오남용 가능성에 대해 의문을 제기하며 판매중지 명령을 내린다[28]. 23앤드미는 약 65만개의 SNPs(일루미나 사의 OmniExpress Plus Genotyping BeadChip 이용)를 분석한다. SNPs 분석결과로부터 질병위험도를 예측하려면 많은 임상적 연구결과가 뒷받침되어야 한다.
최근 들어 대규모 인구집단에서의 전장유전체 연관성 연구(GWAS, Genome-wide Association Study)가 확대되고 있으며 많은 결과가 발표되고 있다(그림 1)[29]. 환자-대조군 (Case-control) GWAS 결과로부터 유전적 변이를 찾아내면 손쉽게 질병이나 형질을 진단하거나 예측할 수 있을 것이라 믿고 있다. 이러한 연구의 핵심 목표는 유전적 변이와 질병 혹은 형질과의 연관성을 이해하는 것이다. 복잡한 형질의 경우, 이러한 연관성은 특정 유전적 변이에 의해 설명될 수 없으며, 게놈 전반에 퍼져 있는 많은 유전자들의 상호작용을 함께 분석해야 한다. GWAS의 규모가 클수록, 질병이나 형질에 미미한 영향을 미치는 유전적 변이가 발견될 수 있다[29].
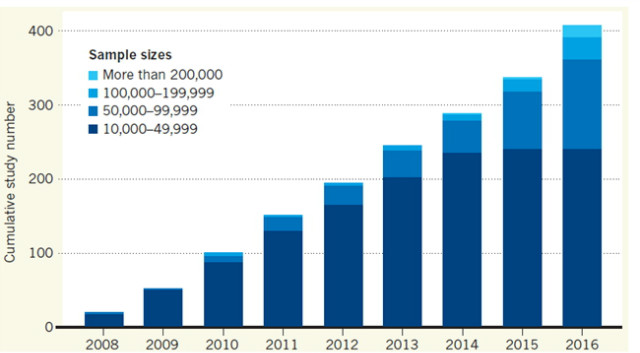
그림 1. 연도별 GWAS 연구 현황 (Nature. 2017;546:360-361 [29])
또 다른 견해도 있다. 환자-대조군 GWAS를 통한 인구집단 단위의 유전지표(SNP marker)는 저투과 감수성 유전자(Low-penetrance Susceptibility Genes)로써 질병 발생 위험은 강력하지 않지만, 인구집단 내에서의 빈도를 고려할 때 인구집단 기여위험도(Population Attributable Risk)는 높은 편이다. 즉, SNP marker와 환경적 요인 간의 상호작용으로 인해 질병 발생 빈도가 증가됨이 명확하기 때문에, 인구집단 단위의 임상적 중재 방안으로 질병 예방에 대해서는 훨씬 중요한 위치를 차지한다[30].
따라서 SNP marker가 질병 위험성에 대한 과학적 근거로 수립되기 위해서는 타당성 연구가 선행되어야 할 것이며, 임상유전체학적 연구결과가 대량으로 축적되고 분석접근법이 개선된다면 미래에는 더 유익한 예방의학(Preventive Medicine)적 예측도구로 발전될 수 있다[31]. 즉, 개인유전체 분석결과가 고도화될 수 있다.
다시 23앤드미의 사례에서 논하면, 2015년 1월 미 FDA는 검사결과의 정확도 및 사용자 편의성을 증명하는 연구 데이터를 검토한 후 블룸증후군(Bloom Syndrome) DTC 개인유전자 검사를 허가했다. 같은 해 10월에는 보인자 상태(carrier status) 검사를 통해 낭성섬유증, 겸상적혈구빈혈, 유전적 난청, 지중해성빈혈 등 자녀에게 유전될 수 있는 36개 유전질환에 대한 DTC 개인유전자 검사도 허가했다[28]. 또한 2017년 4월에는 파킨슨병, 알츠하이머, 셀리악병, XI 혈액응고 결핍증 등 10가지 질병에 대하여도 DTC 개인유전자 검사를 허가했다. 당시 미 FDA에 제출한 자료에는 영국에서 2만 5,000명의 이용자에게 치매 등 질병위험 가능성이 있다는 결과를 알려주었으나 자해 등 불미스런 일로 이어진 경우가 한 건도 없었으며, 사용자들이 검사 결과서 내용을 90% 이상 이해할 수 있었다는 내용이 포함되어 있었다[32]. 이는 개인유전자 분석의 효용이 있는 질병부터 FDA 허가를 얻어 적용 영역을 확대하겠다는 전략의 결실이다.
일루미나사는 현재 전 세계 유전자 분석 장비 시장 70% 이상을 점유하고 있다. 또한 수년 이내 개인유전체 분석비용이 100 달러 시대가 될 것이라 예고했다. [33]. 이러한 기술적 뒷받침은 유전체학(Genomics) 분야를 넘어 시스템스바이올로지(Systems Biology)로의 접근을 가속화시킬 것이다. 개인유전체 분석 분야는 정밀의학 시대를 위한 접근적 수단이자 도구로 여겨지고 있다[2]. 전장유전체 시퀀싱(Whole Genome-seq), 전사체 시퀀싱(Tranome-seq), 후성유전체 시퀀싱(Epigenome-seq) 등의 대단위 연구를 통하여 정밀의학이 현실화될 전망이다. 그러나 표본편중 현상(nonrandom sampling), 질병의 복잡성(disease complexity), 바이오 빅데이터(Bio Big Data)의 부재, 획기적인 생물정보학(Bioinformatics)적 분석방법의 발전 등의 제한점은 극복되어야 한다.
국내 개인유전체 분석시장은 2016년 6월 30일자로 허가된 12개 항목 46개의 유전자를 제외하면, 2004년에 제정되고 2005년부터 시행된 ‘생명윤리 및 안전에 관한 법률’에 근거하여 관리되고 있다. 즉, 국내에서는 23앤미와 같이 DTC 개인유전자 검사가 불가능한 실정이다. 상기 46개 유전자를 제외하면, 의료기관을 통해야만 유전자검사가 가능하며, 따라서 도입기 내지 초기 성장기에 접어들었다고 논하였다. 이 역시 법률적 규제가 지속된다면, 정부 주도의 특정 사업 정도만이 연구성과로 남을 것이다. 임상적 신뢰성을 지나치게 강조하면 연구 및 산업환경의 기회를 놓칠 수 밖에 없다. 이러한 규제를 극복하고 개인유전자 분석시장에 힘겹게 뛰어든 제노플랜, 쓰리빌리언 같은 신생 개인유전체 분석회사도 있지만[19, 34], 국내의 개인유전체 분석시장은 제한적인 행보가 당분간 지속될 전망이다. 1999년 중국 정부는 인간게놈프로젝트 컨소시엄에 참여하기 위하여 BGI를 설립하였기에 개인유전체 분석 분야에서 당시에는 후발 주자였으나, 지금은 선진그룹과 어깨를 겨루고 있다. 마이크로어레이(DNA chip), 차세대 염기서열분석(NGS) 장비의 원천기술 부재로 수입에 의존할 수 밖에 없는 것이 우리의 현실이지만, 정밀의학을 준비할 수 있는 개인유전체 분석 빅데이터 확보는 뒤처질 수 없다.
2.3 개인유전체 분석시장의 전망
개인유전체 분석시장의 미래전망은 관련 사례를 중심으로 기술한다.
올해 초 흥미로운 연구결과가 발표되었다. 전 세계의 400명 연구진이 참여, 유럽계 부부 2만 4,622쌍의 키, 체질량지수(BMI)에 대한 유전자를 분석하고, 이를 바탕으로 상대 배우자의 키와 BMI를 예측한 뒤 실제 수치와 비교했다[35]. 비교 결과 연구진이 유전자 데이터를 바탕으로 예측한 키는 배우자의 실제 키와 높은 상관관계를 보였다. BMI는 그보다 약한 상관관계를 보였지만 여전히 통계학적으로 유의미한 수치를 나타냈다고 연구진은 밝혔다. 우리 몸 속의 유전자를 분석하는 것만으로도 미래 배우자가 될 사람의 키와 몸무게를 어느 정도 예상할 수 있다는 의미다. 연구 결과에 대해 연구진은 “사람들은 자신과 비슷한 유전자를 지닌 배우자를 선택한다”며 “이는 인간들이 선택혼(assortative mating)을 한다는 유전적 증거”라고 설명했다. 이 연구는 올해 초 과학전문지 네이처 온라인판에 게재됐다. 인지능력 등 학업성취도 역시 유사한 연구결과가 발표되었다. 한쪽 배우자의 유전자 데이터만으로도 상대 배우자를 예측할 수 있다는 것이다[36].
부정적이거나 우려의 목소리도 있다. 개인유전체 분석을 통하여 사람의 얼굴을 예측할 수 있다는 결과가 학술지 PNAS에 발표된 바 있다[37]. 교신저자인 유전체분석 기업가이자 인간게놈프로젝트의 주역인 크레이그 벤터(J. Craig Venter)는 다인종 1,061명의 개인유전체 분석결과(SNPs)로부터 안면특징 간의 상관관계를 분석했다. 이후 임의로 선정한 열 명의 사람들 중에서 74%의 정확도로 개인을 식별할 수 있었다. ‘인간의 신체형질(physical trait)을 DNA로부터 예측할 수 있다’고 주장했다. 그러나 과장된 연구결과라는 의견과 함께 ‘인간의 유전자를 이용하여 개인을 식별하는 능력이 과장되는 바람에, 유전자 프라이버시에 대한 불필요한 공포감을 조성하고 있다’는 우려의 목소리 또한 크다. 즉, ‘유전체 데이터에 대한 공공접근의 위험성’을 부풀렸다는 것이다[38].
이러한 일련의 연구결과에 대한 과학적 신뢰성을 논하고자 하는 것은 아니다. 단지 최근의 개인유전체 분석의 동향과 흐름을 파악할 수 있는 사례들이라 할 수 있다.
2013년 설립된 인도의 메드게놈(MedGenome)사는 현지에서는 주로 산전, 소아 유전질환 및 종양 유전자 검사사업을 진행하고 있으며, 실리콘 밸리의 연구소에서는 시퀀싱 플랫폼, 생물정보학, 컴퓨팅 및 빅데이터 분석을 통한 사업을 진행하고 있다. 최근(2017년 8월)에는 인도인의 대규모 개인 유전체분석을 진행하기 위하여 기금을 모으기 시작했다. 유전적으로 균질화(Genetic Homogeneity)되어 있는 인도인의 유전체분석 결과를 정밀의학 연구에 활용할 목적이며, 바이오마커를 발굴하여 신약개발에도 사용될 전망이다[39].
인공지능 기반 유전체분석 전문회사인 스위스 소피아제네틱스(Sophia Genetics)는 3,000만 달러 규모의 시리즈 D 투자를 유치했다. 소피아제네틱스 사는 인공지능(AI) 기반 유전체분석 서비스 발전을 위해 R&D 연구, 인재채용 등에 투입할 예정이다. 소피아제네틱스사가 제공하는 ‘SOPHiA AI’는 모든 유형의 게놈 변형을 정확하게 분석하고 탐지해 임상의가 환자의 진단과 치료를 하는데 돕고 있다. 이러한 기술을 인정받아 소피아는 최근 MIT Technology Review 50대 기업에 선정된 바 있다. 이 회사는 유전체분석 서비스를 위해 3가지 AI 기반 알고리즘을 제공하고 있다. 단일염기다형성(SNP)과 인델(Indel)을 검출하고 분석하는 ‘패퍼(Pepper)’, 유전자복제수변이(CNV)를 검출하는 ‘무스캇(Muskat)’, 유전자 변이에 대한 추가적인 주석(advanced variant annotation)을 제공하는 ’모카(Moka)‘ 등이다[40].
핀란드 정부는 1954년부터 환자 정보를 수집해 관리하기 시작했으며, 국민 개개인의 건강 정보 등의 디지털 의료정보를 모아 둔 칸타 시스템(Kanta System)을 활용하여 축적한 빅데이터를 분석해 신약 개발 등에 활용하고 있다. 2018년부터는 국립유전자센터를 설립하여 유전자 정보를 축적할 계획이며, 기업들은 방대한 규모의 빅데이터를 연구나 임상 목적으로 활용할 수 있다. 따라서 GE, 필립스, 바이엘, 서모피셔 사이언티픽 등 글로벌 헬스케어 기업들이 핀란드에 연구개발 센터를 유치하고 있다. 이는 개인유전체 정보에 대한 미래의 활용성을 대변하고 있을 뿐 아니라 직접적인 적용사례이다[41].
개인유전체 분석은 질병과의 관련성을 규명하려는 연구분야 이외에도 인류의 진화를 밝히는 데에도 활용되고 있다. ‘인류의 유전체가 어떻게 진화하고 있는지’를 알아보기 위한 대규모 개인유전체 연구에서, 자연선택은 사람의 수명을 단축하는 유해한 유전자변이를 제거하고 있는 것으로 밝혀졌다. 215,000명의 유전체를 분석한 결과, 수명을 단축시키는 변이들이 도태되고 있을 가능성을 제시하고 있다. 물론 더 많은 후속 연구가 수행되어야 하지만, 개인유전체 연구는 진화의 기구를 밝히는데도 일조하고 있다[42].
2007년 구글(Google)과 항체 신약분야 세계적 제약사인 제넨텍(Genentech)은 개인유전체 분석 기업인 23앤드미에 390만달러를 투자했다. 이 기업은 각종 규제 이슈에도 불구하고 2012년 5,000만 달러, 2015년 1억 1500만 달러, 그리고 최근(2017년 9월)에도 200만 달러를 추가 투자 받아, 개인유전체 빅데이터 기업 중 하나로 자리잡았다. 2017년 4월 글로벌 제약사인 아스트라제네카(AstraZeneca)는 크레이그 벤터가 만든 휴먼롱제비티(Human Longevity Inc.)사에서 200만명 개인유전체 분석 프로젝트를 시작할 수 있도록 수억 달러를 투자한다고 발표했다. 아스트라제네카사는 200만 유전체 정보와 건강기록을 연계해 질병과 관련된 희귀 돌연변이를 찾아내어 치료제 개발에 활용하고, 개인유전체 데이터와 건강정보 등의 빅데이터를 분석하여 새로운 바이오 산업을 창출한다는 계획이다. 상장도 하지 않았고 크게 매출도 없는 휴먼롱제비티사의 기업 가치는 2조 2천억원에 이르는데 유전체 빅데이터 분석 플렛폼의 미래 가치를 보여주는 예다[43, 44]. 써모피셔 사이언티픽(ThermoFisher Scientific)사는 90만개 SNPs를 분석할 수 있는 DNA chip 기반의 PMRA (Precision Medicine Research Array)를 판매한 이래, 최근에는 65만개 SNPs가 집적된 Asian PMRA를 출시했다. 일루미나사의 유전체분석 장비 ‘노바식 6000’과 개인유전체 분석의 도구로 활용될 전망이다.
2.4 관련 산업으로의 확대 및 전망
유전체학 연구는 전세계적으로 향후 의료문제를 해결할 수 있는 실마리를 제공할 것이라 전망하고 있다. 지난 몇 년 동안 NGS 분석기술의 발전으로 개인유전체 염기서열 분석비용이 급감했다. 약물유전체학(Pharmacogenomics), DTC 유전체학(Direct-to-consumer Genomics) 그리고 웨어러블 데이터 수집 장치(Wearable Data-collection Devices)의 발전은 정밀의학의 발전을 가속화 시킬 것이다[45]. 대규모 정밀의학 프로젝트가 현재 여럿 진행 중이다. 2017년 이후, 유전체학 분야 관련 의료서비스 및 생명과학 시장을 주도할 7가지 주요 경향(seven major trends)이 소개(Genetic Engineering & Biotechnology News)된 바 있으며, 다음과 같다[45].
첫째, 임상의학과 유전체 데이터의 통합(Integration of Genomic Data into Clinical Workflows): 스탠포드 헬스케어(Stanford Health Care) 및 일부 암 연구센터(임상센터)에서는 유전체 데이터를 사용하여 치료에 활용하고 있다. 향후 모든 클리닉에서 유전체 데이터를 사용할 시대를 준비해야 한다. 유전체학과 질병위험 사이의 연관성을 더 많이 발견함(원하지 않는 부작용을 일으킬 수 있는 특정 유전자 돌연변이를 가지고 있다면 그 약을 사용하지 않도록 조심하거나 경고)에 따라 유전체 데이터는 임상의학과 통합될 것이다.
둘째, 약물유전체학의 적용확대(On the Rise: Pharmacogenomics): 약물유전체학은 유전변이가 약물에 대한 개인의 반응이 어떻게 기여하는지 연구하는 학문이다. 이미 약물 대사와 관련된 수백 개의 유전자를 확인했으며 더 많은 유전자를 계속 밝혀지고 있다. 미래에는 임상적 결정에 유전체학이 더욱 활용될 것이다. ‘임상약리학적 결정 컨소시엄(Clinical Pharmacogenetics Implementation Consortium)’은 특정 유전변이의 보유에 대해 약물 처방 가이드 라인을 제시해 준다. 예를 들면 HLA-B*5701 유전변이가 있는 경우 알레르기 반응의 위험이 훨씬 더 높음을 알려준다. 의사는 더 이상 약물치료에 일률적인 방법을 사용할 필요가 없다. 환자의 연령, 성별, 인종 및 유전체 요인에 따라 약물을 더 최적으로 처방할 수 있다.
셋째, 유전체 편집기술의 발전(Emergence of Advanced Genome Editing Techniques): 정확하고 저렴한 기술인 CRISPR-Cas9 유전자 편집기술의 발전 잠재력을 직시해야 한다. 예를 들면, 표적 돌연변이가 있는 원숭이를 만들수 있으며, 인간 세포에서 HIV 감염을 예방할 수도 있다.
넷째, 비침습성 암 검진(Noninvasive Cancer Screening): ‘액체 생검 검사(liquid biopsy testing)’는 혈액 등 소량의 액체 생검으로부터 조기의 암을 검진할 수 있다. 미래에는 어떤 종류의 암을 앓고 있는지 여부와 진행 정도까지도 초기 단서를 의사에게 제공할 것이다.
다섯째, DTC 유전자 검사의 발전(More Direct-to-Consumer Genetics): 23앤드미의 사례를 들어, 본고에서도 자세히 설명한 바 있다.
여섯째, 신생아 유전자 검사기술의 성장(Growth of Newborn Genetic Screening Programs): 향후 10년 내 모든 신생아는 자신의 유전체 정보를 ‘전자의무기록(Electronic Medical Record)’에 함께 저장하고 이를 활용할 가능성이 클 것이라 예상하고 있다. 또한 산전 유전 스크린 프로그램도 계속 성장할 것으로 전망하고 있다. 관련기술로는 임산부의 NIPT(invasive prenatal test)가 있으며, 관련 회사로는 Counsyl (www.counsyl.com), Natera (www.natera.com) 등이 있다.
일곱째, 새로운 데이터 정보의 통합(Integration of New Data Streams): 미래에는 개인의 건강관리를 위하여 웨어러블 데이터, 유전체학/대사체학(proteomics and metabolic) 데이터 및 임상 데이터가 통합 관리되어 개개인의 건강을 보다 잘 파악할 수 있을 것이다. 이로부터 만성질환(Chronic Diseases)의 관리가 보다 수월해 질 것이다.
이상의 경향으로 미루어 보아, 미래의 유전체학 관련 산업은 보다 명확하고 개인화된 의료 서비스(More Targeted and Personalized Healthcare)를 지향할 것으로 전망된다.
3. 결론
개인 맞춤형 치료를 가능하게 하는 동반진단(Companion Diagnostics; CDx)은 이제 일반화되었다. 동반진단이란 특정치료제에 대해 안정성과 효율성이 입증된 환자군을 선별하는 공인된 진단기술이다. 이는 특정 질병의 진단과 치료제 선택을 묶음으로 진단한다는 것이다. 특정 약물의 처방 전에 특정 유전자의 분석을 통해 맞춤치료제를 선정할 수 있다[46]. 첫 사례로는, 1998년 유방암 환자 중 HER2 유전자가 과발현된 그룹에게만 투약할 수 있는 유방암 치료제 Herceptin이 개발되었는데, 이는 환자들을 유전적 특성에 따라 치료하는 맞춤의료의 시작이었다[47]. 곤도 마코토가 그의 저서 ‘암과 싸우지 마라’는 책에 언급한 바에 의하면, 암의 90%는 항암제 효과가 나타나지 않는다는 것이다. 연구마다 천차만별이지만 항암제가 환자에게 전혀 듣지 않는 무반응률이 높다는 것은 의학계의 오랜 이슈이자 숙제였다. 항암제의 치료 효과는 커녕 치명적인 부작용이 발생한다면 누구의 책임인가. 치료효과가 없는 고가의 신약을 사용하는데 따른 의료비 증가 역시 간과할 수 없는 문제다. 이러한 관점에서, 동반진단은 신약개발의 성공률은 높이고 의약품 무반응률은 낮추기 위한 오랜 고민의 산물이다[46]. 맞춤형 치료를 가능하게 하는 동반진단의 콘텐츠를 확보하는 것은 개인유전체 분석의 최종 목적이기도 하다.
미국의 경우, 23앤드미는 FDA로부터 파킨슨병, 알츠하이머, 셀리악병, XI 혈액응고 결핍증 등 10가지 질병에 대한 DTC 유전자검사를 허가 받고 시판했다. 이후 개인유전체 분석시장의 확대에 따라, 보험청약자의 개인유전자 검사로 생명보험업계에 발생하는 ‘정보의 불균형’은 역선택(자신의 질병 위험을 미리 알 수 있게 되면서 병에 걸릴 확률이 높은 사람들은 보험에 더 많이 가입)과 해지율(반대의 경우) 상승을 초래할 수 있다고 전망하고 있다. 대부분의 국가에서는 보험계약과 관련한 유전자 검사 결과 사용을 일률적으로 금지하고 있거나, 관련 규정이 명확하지 않은 상황이다[48]. 우리나라 역시 ‘생명윤리 및 안전에 관한 법률’에서 유전자에 기초한 차별금지 및 보험계약상 유전정보 요구를 금지하고 있다. IAA (Institute of Actuaries of Australia) 보고서에 따르면 현재 호주 인구의 약 0.5%가 유전자 검사를 받고 있으나, 앞으로 인구의 2%가 유전자 검사를 받을 경우 역선택으로 인한 보험금 청구건수는 7~17% 증가할 것으로 예상했다[49]. 또한 하버드 대학의 연구보고서에 따르면, DNA 분석결과 APOE-e4 변이를 가진 사람의 보험 가입률이 그렇지 않은 사람보다 6배가 높다고 보고했다[32, 50]. 즉, 유전자 검사 상용화에 따른 역선택과 해지율의 증가 문제는 향후 생명보험 산업에 위협요인으로 작용할 수 있으며, 생명보험과 관련된 유전자 정보 규제체계 정비가 필요할 것이다[51].
이상으로 유전체학 관점에서 여러 사례를 중심으로, 개인유전체 분석시장의 현황과 주요 이슈 및 산업동향에 대하여 기술했다. 앞서 언급한 유전체 시장의 발전을 저해하고 극복해야 할 제한점 중, 질병의 복잡성은 어쩔 수 없지만, 표본편중 현상이나 바이오 빅데이터의 부재 문제는 해결될 수 있다. 게다가 개인유전체 분석기법 및 생물정보학적 해석기법의 발전은 분자생물학 및 임상의학적 발전에 힘입어 해결될 여지는 충분하다. 즉, 유전형과 표현형 사이의 복잡한 관계를 보다 명확히 밝히기 위한 임상연구는 GWAS뿐 아니라, ‘전자의료기록 및 유전체학(eMERGE, Electronic Medical Records and Genomics) 네트워크’를 포함한 ‘표현체 기반 연관 분석(PheWAS, phenome-wide association study)’으로도 접근할 수 있다[52]. 또한 기존 ‘단일 SNP 분석(single-SNP analysis)’에서 발전하여 ‘다중 SNP 조합(multiple-SNP analysis)’과 형질(혹은 질병)과의 관계를 분석하여, 특정 질병에 관여하는 유전자를 규명하고 이들의 조절 메커니즘을 밝힘으로써 개인 간 나타나는 차이를 고려한 질병 예측, 진단 및 치료에 활용하기 위해 많은 연구들이 수행되고 있다[53, 54]. 즉, 접근 및 해석 방법적인 발전은 계속 가속화될 것이다.
4. 맺는 말
삼성경제연구소 ‘CEO 인포메이션’에서 발표한 ‘기업의 新경쟁력, 빅데이터 큐레이션’에 따르면, ‘빅데이터를 활용한 기존방식과는 차별화된 성과를 창출할 수 있는 5대 활용분야’는 미래예측, 숨은 니즈 발견, 리스크 경감, 맞춤형 서비스, 실시간 대응 등이다[55]. 개인유전체 분석 시장이 발전하면 상기 활용분야의 상당부분을 만족시킬 것이다. 개인유전체 분석결과의 해석이 고도화되면 타고난 유전적 경향을 제시해 줌으로써, 보다 건강한 환경적 생활패턴 및 주의해야 할 생활습관에 대해 가이드해 줄 수 있고, 또한 그 정확도는 향상될 것이다. 특히 개인맞춤 정밀의학의 진전으로 약물의 효능은 극대화되고 부작용은 최소화 시킬 것이다. 이를 위해서 무엇을 준비해야 할지를, 어떠한 규제를 걷어내야 하는지를 주의 깊게 고찰해야 할 것이다. 지난 1999년 중국 정부가 인간게놈프로젝트 컨소시엄에 참여하기 위하여 BGI를 설립한 것처럼, 민간기업의 역할 못지않게 정부주도의 내실 있고 지속 가능한 대규모 연구사업의 진행 및 완성도 중요하다. 글로벌 시장의 주역이 되면 더욱 좋겠지만, 더 이상 지배당할 수는 없다. DNA chip, NGS 장비 시장은 내 주었지만, 바이오마커 발굴 등 콘텐츠 분야까지 내어줄 수는 없다.
5. 참고문헌
==> PDF 참조
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
- BioINwatch 최대 규모의 오픈소스 Evo2를 활용한 유전체 모델링 및 설계 2025-03-21
- BioINwatch 후성 유전체 비트(Epi-bits)를 활용한 DNA 기반의 데이터 저장 기술 2025-03-18
- BioINwatch 작물 중개 유전체학에 거는 기대와 도전 과제 2025-01-24
- BioINregulation 유전체 데이터 2차 활용 관련 국가별 제도 비교 2025-01-24
- BioINwatch 시행 가능성이 높아진 미국의 생물보안법(US Biosecure Act), 바이오산업 공급망 재편 압박 2024-12-04
동향


 pdf_0002853.pdf
pdf_0002853.pdf