기술동향
DNA 손상과 생존과 죽음 사이의 균형
- 등록일2017-12-11
- 조회수8089
- 분류기술동향
-
자료발간일
2017-11-28
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#DNA 손상
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
DNA 손상과 생존과 죽음 사이의 균형
[요약문]
DNA는 생체 내의 대사물질, 환경에서 발생한 발암물질, 일부 항염증제, 유전 독성 항암 치료제 등으로 인해 손상되기 쉽다. DNA가 손상되면 세포는 DNA 복구, 생존, 또는 죽음을 촉진하는 복잡한 신호전달 네트워크를 활성화시켜 세포의 운명을 결정하게 된다. 세포의 생존 또는 죽음은 DNA 손상 인식, DNA 복구 능력 및 손상 저항력, 세포 사멸, 괴사, 세포 노화 등과 관련된 다양한 요소에 의해 결정된다. 세포의 운명을 결정하는 신호전달경로는 서로 복잡하게 얽혀있으며 암의 발생과 진행에 중요한 역할을 한다. 게다가 유전 독성 약물을 사용하는 암 치료의 결과에도 영향을 미친다. 이러한 신호전달경로의 분자적 토대를 이해한다면 발암 과정에 대한 통찰을 얻을 수 있고, 이후 효과적인 암 치료법 개발이 가능할 것이다. 본 총설 논문에서는 DNA 손상 이후 세포가 생존과 죽음 사이에서 복잡한 결정을 내리는 과정에 대해 기술한다.
[목차]
1. 서론
2. DNA 손상 반응과 세포의 생존 및 죽음
3. 생존과 죽음의 전략
4. 생존과 죽음의 상호작용
5. 결론
1. 서론
환경에 존재하거나 우리 몸의 세포와 내장에 존재하는 미생물군(microbiota)의 대사작용으로 생성된 화학 발암 물질, 단핵구(monocyte)와 대식세포(macrophage)와 같은 활성화 된 면역 세포에 의해 생성 된 활성산소(radical), 자외선(UV), 전리(ionizing) 방사선, 유전 독성 항암제를 비롯한 약물들은 DNA를 공격하여 다양한 손상을 준다. 이러한 손상은 유전자 돌연변이 및 염색체에도 손상을 유발하여 결국 종양 발생 및 진행되게 된다. 세포는 유전적 불안정(genomic instability)을 막기 위해 DDR (DNA 손상 반응; DNA damage response) 신호전달경로와 DNA 손상을 막고 복구하기 위한 DNA 수리 단백질들을 갖추고 있다. 복구되지 않은 DNA 손상은 독성이 있으며, 세포 사멸(apoptosis) 혹은 괴사(necrosis)를 유발하는 신호전달경로를 촉진한다. DNA 손상에 따른 세포 사멸은 세포가 죽느냐 사느냐의 운명을 결정하는 분자적 수준의 과정에 의해 조절된다. 이는 생존 관련 인자와 사멸 관련 인자의 역치(threshold)에 의해 결정된다. 세포가 어떻게 DNA 복구 대신 세포 사멸을 선택하는지 이해하게 되면 유전 독성 화학항암치료의 개발에 큰 도움이 될 것이다.
2. DNA 손상 반응과 세포 생존 및 사멸
DNA 부가물(adduct)에 의한 독성은 일반적으로 DNA 복제 또는 전사 과정에서 복제효소를 방해하며 발생한다. 그러한 DNA 손상은 자외선(UV), 생화학 가스, 시스플라틴(cisplatin)과 같은 유전 독성 항암제, 토포이소머라아제(topoisomerase) 억제제 등에 의해서 생성될 수 있다. DNA 손상이 발생하면 세포 내에서는 DDR 신호전달경로를 통해 복제가 중단된 분기점(replication fork) 부위를 안정화시키고, 세포 주기를 중단시키고, DNA 수선 과정을 마친 다음 다시 복제 과정을 재개하게 된다. 만약 복제가 성공적으로 재개되지 못한다면, 중단되었던 분기점 부위는 DNA의 한쪽 끝이 절단되어 있는 DSB(이중 구조 파괴; double-strand break)를 형성하게 된다. DSB가 발생하게 되면 세포의 운명은 DDR 신호전달경로의 활동에 따라 결정된다.
DNA 부가물 자체가 세포 사멸 경로를 활성화할 수 있는지, 아니면 DSB가 주요 유발 요인인지는 아직 의문으로 남아있다. DSB가 세포 사멸을 촉진한다는 증거는 많이 있으며, ROS (활성 산소, reactive oxygen species) 등에 의해 생성된 소규모 DNA 부가물은 괴사를 유발한다고 한다. 세포 사멸은 세포가 복구할 수 있는 범위를 넘어선 손상이 존재할 때 암화 과정에 빠지지 않도록 하는 방어 기작으로 생각된다. 암에서도 DSB가 DNA 손상에 의한 주요 현상이지만, 세포 사멸 경로가 비활성화 역시 많이 발견된다. 괴사에는 PARP1 (poly(ADP-ribose) polymerase 1)과 같은 신호전달물질의 활동이 수반된다.
세포가 허용 범위 이상의 DNA손상에 반응하기 위해서는, 우선 DSB또는 복제분기점 작동 중지를 감지해야 한다. DNA 손상 발생 후 수 분 내에 이를 감지하여 반응하는 3개의 시스템이 알려져 있다: PIKK (PI3K-related kinase), ATM (ataxia telangiectasia mutated)과 ATR (ataxia telangiectasia and Rad3-related,) DNA-PK (DNA-dependent protein kinase). 이러한 감지 신호전달물질로부터 다양한 키나아제들의 반응이 연속하여 이어지며, 생존 또는 죽음을 촉진할 수 있는 다양한 이작용기(dual-function) 단백질들을 활성화시킨다. 이러한 단백질들은 세포 주기 확인점(checkpoint)을 활성화시켜 세포 주기 진행을 막는다. ATM과 ATR은 DNA 수리를 촉진하고 세포 주기를 막기 때문에, 분명히 생존에 치우진 인자들이다. ATM과 ATR을 KD (knockdown) 시킨 세포주에서는 DSB에 의한 DNA 손상에 잘 반응하지 못한다. DSB가 많을 경우에 ATM과 ATR은 세포의 죽음을 촉진하는데, 이는 p53과 caspase2를 거치는 세포 사멸 경로나, 혹은 E2F1, p73, CHK1을 통하게 된다. ATM의 돌연변이는 암에서 자주 발견되며, 위와 같은 경로의 활성이 차단되기에 항암 치료에 대한 내성을 가지게 된다.
ATM의 기능을 잃어버리는 돌연변이에 의한 모세혈관확장 운동실조증(Ataxia telangiectasia) 환자들은 높은 빈도로 유방암이 발병하며, 대장암에 걸릴 확률도 높다. ATR의 기능이 망가진 환자들도 암 발병률이 높다. ATM과 ATR 모두 DNA의 손상을 복구하거나 세포 사멸을 유도하여 유전 정보를 보존하는데 필요하며, 암 환자들은 ATM 또는 ATR 하나의 유전자만 돌연변이를 가지는 것으로 보인다. DSB를 수리할 수 있는 다른 신호전달경로들도 존재하기에 ATM이나 ATR에 돌연변이가 있는 실제 암에서도 DSB가 수리되지 않은 채로 존재하는 경우는 드물다. 하지만 정상적으로 복구되지 않을 가능성은 존재하며, 이는 유전적 불안정성(genomic instability)을 야기한다. ATM과 ATR은 p53의 Ser36 인산화 등을 통하여 세포의 균형추를 생존에서 죽음으로 옮겨갈 수 있다. 따라서 세포의 생존과 죽음은 독립적으로 기능하는 것이 아니라, 조절 피드백과 피드포워드 회로가 얽혀있는 복잡한 네트워크 속에서 결정된다.
3. 생존과 죽음의 전략
세포의 생존 전략에는 DNA 손상 복구 회로 지속적인 활동 유도, 세포 노화(senescence)를 통한 독성 회피, 생존을 촉진하는 신호전달경로를 담당하는 AKT (PKB) 혹은 NF-κB (nuclear factor-κB)과 같은 전사 인자(tranion factor)의 활성화, 그리고 IAPs(inhibitors of apoptosis), XIAP (X-linked inhibitor of apoptosis protein), survivin과 같은 항세포 사멸 인자의 발현의 발현이 포함된다. 세포의 죽음 전략에는 DNA 손상에 따른 세포 사멸 신호전달경로가 포함된다. 두 전략이 어떻게 상호작용 하는지 살펴보자.
? p53, 그리고 생존과 죽음 사이의 균형
DNA손상의 수준에 따라서 다른 반응이 유발될 수 있다. 낮은 수준의 손상은 복구와 생존 반응으로 이어지지만, 높은 수준의 손상은 세포의 죽음을 일으킨다. p53은 생존과 죽음에 관련된 다양한 유전자의 발현을 조절하기에, 이러한 상황에서 중심적인 역할을 한다. 그렇다면 세포는 DNA 손상을 어떻게 정량화하여 결정을 내리는가? 이론적인 모델 연구는 DNA 손상 수준에 따라 p53의 서로 다른 활성화 패턴이 결정된다고 예측하고 있다. 이러한 반응은 ATM/ATR ? CHK1/CHK2 ? p53으로 이어지는 양성 피드백과 MDM2에 의한 음성 피드백 경로에 의해 조절된다. 간단히 말해 낮은 수준의 손상은 p53을 일시적으로 활성화시키고, 높은 수준의 손상은 지속적인 p53 활성화를 일으킨다. p53은 p21과 같은 세포 주기의 정지와 관련된 유전자들의 프로모터(promoter)와는 친화도가 높은 반면, PIG3와 같은 세포 사멸과 관련된 유전자의 프로모터와는 친화도가 낮다. 따라서 서로 다른 수준의 p53 활성도에 의해 생존과 사멸 관련 유전자들이 상이하게 발현하게 된다. 선택적인 p53의 유전자 발현 능력은 상호작용하는 RNA에 의해서도 영향을 받는다. 예를 들어 DDX5에 의해 p21의 발현이 조절된다. 그리고 p53과 ASSP (apoptosis-stimulating of p53 protein) 1, 2의 상호작용은 세포 사멸을 일으키는데, 이 단백질의 억제제는 사멸을 막게 된다. NF-κB와 같은 생존과 관련된 신호전달경로와의 상호작용도 p53가 결정하는 세포 운명에 영향을 미친다. 분명한 것은 p53과 그 하부의 신호전달물질들은 복잡하게 얽혀있으며, 세포의 종류와 암종에 따라 다르다는 점이다.
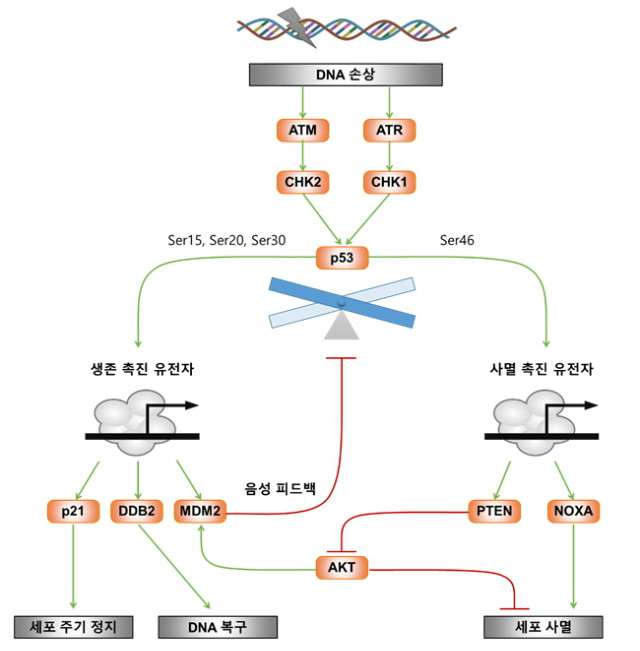
위의 메커니즘에 더하여 다양한 인산화 또는 아세틸화를 통해 p53의 기능을 복구 담당, 세포 주기 정지 담당에서 세포 사멸 담당으로 변할 수 있다. ATM, ATR, CHK1, CHK2, DNA-PK에 의한 Ser15, Ser37, Thr18, Ser20 위치의 인산화, 그리고 MDM2와의 결합에서 풀려나 핵으로 이동하는 것을 돕는 요소들은 세포 주기 정지 담당에 꼭 필요하다. 반면에 Ser46 위치는 p53의 기능을 세포 사멸 담당으로 변화시키며, 프로모터의 친화력이 변하여 PTEN, NOXA, TP53AIP1과 같은 세포 사멸과 관련된 유전자들의 발현을 촉진하게 된다. p53과 상호작용하여 Ser46 위치에 인산화시키는 키나아제들은 HIPK2 (homeodomain-interacting protein kinase 2), p53DINP1 (p53-dependent damage-inducible nuclear protein 1), p38 등이 알려져 있다. ATM과 ATR 역시 Ser46을 인산화시키는 경로에도 속해있다고 생각된다. 재미있게도 Ser46 위치를 포함해 p53의 인산화를 제거하는 역할을 하는 WIP1은 p53에 의해 발현되는 포스파타아제(phosphatase)이다. 이러한 음성 피드백이 존재함에도 불구하고 높은 수준의 DNA 손상에 의해 활성화된 ATM과 ATR의 신호는 p53의 활성도를 높게 유지하여 세포가 복구 모드에서 사멸 모드로 진행할 수 있게 한다. 그밖에 p53과 상호작용하는 다양한 피드백 회로에 의해 p53의 기능이 복잡하게 조절되어 생존과 죽음 사이의 세포 운명을 결정한다.
? 전사체 손상과 세포의 죽음
DNA 손상 이후 전사체(tranome)의 안정성을 조절하는 것은 중요하다. RNA 중합효소II의 억제는 세포 사멸을 유도한다는 것이 잘 알려져 있다. 그리고 암 발생과정에서 생존과 사멸에 영향을 주는 요소들에 일어나는 후성적(epigenetic) 조절 역시 세포의 운명에 영향을 준다. 우선 RNA중합 효소 II의 억제의 효과를 고려해보자. 일반적으로 생존과 관련된 유전자들은 수십 킬로베이스(kilobase)에 달하는 큰 크기를 가지고, 사멸과 관련된 유전자들은 수 킬로베이스이기에 상대적으로 작다. 이러한 크기 차이 때문에 결과적으로 전사를 방해하는 DNA 부가물은 생존과 관련된 유전자의 전사를 방해할 확률이 높다. 따라서 복구되지 않은 DNA 부가물은 세포의 균형추를 죽음으로 옮겨간다. 이러한 메커니즘으로 인하여 ATM 또는 ATR을 통한 신호전달경로의 활성화, 혹은 MDM2 전사의 방해를 통해 결과적으로 p53의 인산화와 축적이 일어난다. 예를 들어 TC-NER (tranion-coupled NER)이 거대한 DNA 부가물을 효과적으로 제거하지 못한다면 Ser15 위치의 p53 인산화가 관찰된다. 아직까지 Ser46 위치의 인산화도 마찬가지의 메커니즘으로 발생할 수 있는지는 확인되지 않았다.
전사체와 DNA 손상 사이의 관계에 대한 또 다른 사례는 전사 인자 FOS가 제거된 세포의 연구를 통해 밝혀졌다. UV나 화합물 처리를 통해 거대한 DNA 부가물 생성을 유발하면, FOS의 발현이 초기에 유도되며 계속 지속된다. FOS 결여 세포의 특징은 이렇게 큰 DNA 손상을 유발할 수 있는 유전독성 물질에 취약하다는 점이다. FOS가 제거되면 FOS에 의해 발현되는 AP-1 (FOS-activating protein 1)의 기능을 상실하여 DNA 부가물의 복구가 느려지게 된다. DNA 손상에 따른 FOS의 발현은 AP-1의 활성도를 증가시킨다고 알려진 JNK (JUN N-terminal kinase)와 p38과 같은 키나아제의 활동에 의해 일어난다. 이는 세포의 일반적인 스트레스 반응 경로로 알려져 있으며, DNA 손상 역시 세포가 반응해야 하는 스트레스의 일종으로 여겨짐을 유추할 수 있다. AP-1의 지속적인 활성은 세포 외부에서 사멸 신호를 주는 FASL (Fas ligand)의 발현을 증가시키게 된다. 종합하자면 복구되지 않은 DNA 손상은 JNK와 p38의 지속적인 활성을 유발하고, 이는 MKP1 (MAPK phosphatase 1; DUSP1)과 같은 JNK와 p38의 활성도를 억제하는 신호전달물질의 발현을 막고, JUN-ATF2를 거쳐서 결과적으로 FASL의 증가를 일으킨다.
? DNA 손상에 의한 세포노화
DNA 손상은 세포 노화(cellular senescence)를 일으킬 수 있다. 이러한 운명의 결정은 세포의 수명을 결정한다고 알려진 텔로미어(telomere)에서 발생한 DSB에서 유발되는 지속적인 DDR에 의해서 일어난다는 것이 관찰되었다. 이는 p53을 통해 세포 주기 정지에 관련된 신호전달경로의 활성화에 의한 것이며, p16INK4A도 관련되어 있다. 일반적인 DNA의 DSB는 일시적으로 DDR을 유발하는 것에 반하여 텔로미어의 DSB는 어떻게 지속적인 DDR을 유발하는가? 이는 텔로미어와 그 주변에서 생긴 DSB는 복구되지 않는 다는 관찰 덕분에 설명될 수 있었다. TRF2 (Telomeric re-peat-binding factor 2)는 텔로미어에서 반복되는 TTAGGG 서열에 결합하고 있으며, NHEJ (non-homologous end joining)에 의한 DSB 복구를 방해한다. 따라서 텔로미어에는 DSB가 계속 남아있게 되고, 이를 인식한 DDR은 지속적으로 활성화되어 세포를 정지 상태(quiescent state)로 만들게 된다. DSB가 복구되어 DDR이 일시적이던 일반적인 경우와는 다른 운명을 가게 된 것이다.
유전 독성을 가지 화합물도 처치 농도에 따라 세포 노화를 일으킬 수 있다. 예를 들어 신경교종(glioma) 치료에 사용되는 메틸화 물질인 테모졸로미드(temozolomide)는 ATM과 ATR의 활성을 일으키고 세포의 노화를 유발한다는 것이 임상 결과로 확인되었다. 그러모르 텔로미어에 존재하는 복구되지 못한 DSB가 세포 노화를 일으키는 유일한 메커니즘은 아닌 것으로 보인다. 따라서 어떤 농도의 유전 독성 물질이 텔로미어와는 독립적인 방식으로 세포 노화를 유발하는지, 그리고 노화 상태에 도달한 세포가 다시 성장 상태로 변할 수 있는지는 앞으로 해결해야 할 문제로 남아있다. 또한 암세포가 이러한 방식으로 유전 독성 치료를 회피할 수 있는지도 확인해야 할 과제이다.
4. 생존과 죽음의 상호작용
유전 독성 물질이 일으키는 세포 사멸과 괴사 사이의 상호작용은 복잡하며 아직 완전히 밝혀지지 않았다. 일부 연구들은 이미 위에서 논한 바와 같이, 이러한 복잡성을 파헤치는 데에 초점을 맞추고 있다. 기본적으로 DNA손상은 세포 주기 확인점을 통해 세포 주기의 진행을 막고, ATM/ATR ? CHK1/CHK2 ? p53 경로를 통해 DNA 복구를 활성화한다. 손상 정도에 따라 이러한 경로의 활동이 중단되고 세포 사멸이나 괴사로 이어지지 않을 수 있다. 그렇기에 세포가 복구할 수 있는 DNA 손상의 역치값은 세포의 운명에 중요한 역할을 한다.
세포가 죽음의 결정을 내리기에 필요한 역치값은 세포 사멸을 촉진하는 신호전달경로를 억제하고 있는 여러 가지 생존과 관련된 신호전달경로의 활성도에 의해 정해진다. 중요한 조절자는 IAPs, XIAP, survivin 이다. 이들은 함께 작용하여 caspas를 억제하고 세포가 사멸로 가는 것을 막는다. Survivin은 배아줄기세포 단계에서 높게 발현되어 있으며, 암에서도 높다는 것이 관찰되었다. Sur-vivin을 제거한 세포는 역치값이 낮아져서 DNA 손상에 의해 쉽게 세포 사멸을 일으키게 된다. 배아줄기세포는 끊임없이 세포 분열 과정을 거치기 때문에 내부적으로 DNA 손상이 발생할 가능성이 높다. 따라서 높은 수준의 survivin이 세포 사멸 경로를 억제하게 된다. 암에서도 마찬가지의 메커니즘 때문에 세포 사멸을 유도하는 항암제에 대해서 내성을 가지게 된다. 세포 사멸을 유도하기 위해서는 이러한 역치값을 넘을 수 있는 충분한 자극이 주어져서 caspase의 활성을 유도해야 한다.
세포 사멸은 미토콘드리아 막의 이상기능, 세포의 수축, 세포막의 변화, caspase의 활성화를 포함해 다양한 특징을 가지고 있다. 만약 DNA 손상에 의한 신호가 교란이 된다면 세포 사멸을 일으키는 과정이 다시 되돌려질 수 있을까? 이러한 세포 사멸 방해 전략은 미토콘드리아의 손상을 유도하는 자스플라키노라이드(jasplakinolide) 약물의 처치로 그 효과가 확인되었다. 하지만 핵의 구획화가 일어난 이후에는 더 이상 세포 사멸 과정을 되돌릴 수 없다. 아직까지 DNA 손상에 의한 세포 사멸이 DDR 반응의 억제를 통해 어떻게 제어될 수 있는지는 더 아직 연구되어야 할 영역이다.
5. 결론
DNA 손상은 다양한 세포 반응을 유발한다. DNA 손상은 세포 주기 정지를 일으켜 세포가 손상을 복구할 수 있는 시간을 제공해준다. 만약 복구에 실패하거나 복구될 수 있는 범위를 넘어선 손상이 남아있게 되는 경우, DDR은 세포 사멸과 관련된 신호전달경로를 활성화시킨다. 따라서 세포가 살아남을 수 있는 DNA의 손상은 그 손상의 정도와 더불어 복구 시스템의 능력, p53의 상태와 ATM, ATR, DNA-PK를 포함하는 DDR 분자들의 효율성, 세포 성장 수준, 세포 사멸 경로의 명령 실행력에 따라 결정된다. 세포의 종류에 따라 DNA 복구 능력은 굉장히 다르다. 예를 들어 배아줄기세포는 분화한 세포에 비해 거의 모든 종류의 DNA 손상에 대하여 더 효과적으로 복구할 수 있다. 암종에 따라서도 그 능력이 달라지는데, 전이성 흑색종(melanoma)에서 높은 수준의 복구 능력이 관찰되었다.
세포의 운명 결정에 대해 지금의 패러다임은, 낮은 수준의 DNA 손상은 DNA 복구 시스템을 가동시키지만 높은 수준의 DNA 손상은 복구 시스템의 능력을 넘어서기에 지속적으로 남은 손상이 세포 사멸을 일으킨다는 것이다. 세포가 서로 다른 두 신호전달경로의 스위치를 조절하는 메커니즘이 완벽히 밝혀지지는 않았지만, p53의 인산화 상태와 세포 사멸에 관련된 신호전달물질 활성도의 역치가 세포가 죽느냐 사느냐를 결정하는 주요 요소라는 것이 드러났다. ATM과 ATR은 DNA 손상에 따라 두 가지 결과를 모두 가져올 수 있다. 따라서 ATM과 ATR은 p53이 어떻게 기능해야 하는지를 알려주는 중요한 결정자로 추정된다. ATM에 돌연변이가 있는 암이 높은 내성 수준을 보인다는 보고는 ATM이 세포 사멸을 시작하는 중요한 분자라는 것을 말해준다.
p53의 기능을 상실시키는 돌연변이가 있는 암의 경우에는 사용하는 유전 독성 물질에 따라 내성을 보일 수도 있고 오히려 민감할 수도 있다. 지금까지 많은 연구는 p53이 어떻게 생존과 사멸에 관련된 유전자를 서로 다르게 발현시킬 수 있는지에 초점을 맞춰왔기에, p53이 손실된 세포에서 DNA 손상에 따라 어떻게 세포 사멸이 유도될 수 있는지는 그다지 알려지지 않았다. 따라서 p53과 독립적으로 DNA 손상에 반응할 수 있는 MKP1, JNK, caspase2에 대한 연구가 더 필요하다.
특정한 DNA 손상에 대하여 선택적으로 동작하는 세포 내 신호전달경로를 이해하는 것은 암 치료에 있어서 굉장히 중요하다. 최종적인 목표는 정상 세포는 보존하면서 동시에 암 세포만을 효과적으로 제거할 수 있는 치료 방법을 찾는 것이다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
이전글
- NIST, 3차원 세포배양 약물 시험
-
다음글
- MicroTAS (Miniaturized Systems for Chemistry and Life Sciences) 2017 참석 후기


 DNA 손상과 생존과 죽음 사이의 균형.pdf
DNA 손상과 생존과 죽음 사이의 균형.pdf