기술동향
대사체학: 바이오마커를 너머 기전을 향하여
- 등록일2018-01-08
- 조회수13101
- 분류기술동향
-
자료발간일
2017-12-21
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#대사체학#바이오마커
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
대사체학: 바이오마커를 너머 기전을 향하여
저자 / 김재환(관동대학교)
[목 차]
1. 서론
2. 대사체학의 현황
2.1 대사체 동정 및 검증
2.2 대사체의 기능적 분석
3. 최신 분석 기술
3.1 정보학
3.2 안정동위원소표지 추적자
3.3 Orthogonal 접근법을 이용한 기전연구
4. 대사체 연구를 이용한 생물학적 현상의 해석
4.1 암과 세균성 바이오필름
4.2 대사조절에 의한 세포 전분화능 조절
4.3 심혈관 질환에 대한 새로운 치료 접근법 제시
4.4 대사체에 의한 β-cell의 기능조절
4.5 허혈-재관류 손상 기전
4.6 종양세포의 대사조절
5. 대사체학의 미래
[요약문]
다양한 종류의 생체 시료로부터 대사체에 대한 정보를 분석하는 대사체학(metabolomics)은 바이오 마커를 발굴하는데 있어 중요한 연구 분야로 자리잡았다. 이제 정보학(informatics) 및 분석 기술의 발달 그리고 orthogonal biological 연구 방법이 전통적인 대사체학과 결합되면서 그 동안 설명하기 어려웠던 생명 현상을 밝힐 수 있는 계기가 마련되었다. 이러한 대사체학 연구기법은 아주 미묘한 차이로 구분되는 생물학적 현상도 탐지할 수 있기 때문에, 생리학적 상태나 질병이 유발되는 기전은 이제 더 명확하게 설명될 수 있다.
1. 서론
대사체(metabolites)는 대사과정에서 생성되는 다양한 생성물을 지칭하는 것으로 숙주 생물(host organisms)뿐만 아니라 외인성 요소(예를 들어, 감염 미생물)로부터 생산되기도 하며 광범위한 생리/생화학적 작용에 영향을 미친다. 대사체는 후성 기전 조절, 배아 줄기 세포 (embryonic stem cells)의 만능성(pluripotency) 유지, 단백질의 번역 후 변형(protein post-modification), 단백질과의 상호 작용을 통한 세포 신호전달(cell signal transduction)과 같은 직접적인 조절에 관여하고 또한 박테리아의 영향 대사를 조절함으로써 항상성 유지에 기여하기도 한다. 따라서 대사체의 작용 기전에 대한 정보를 기존의 생물학적 정보와 통합/해석하여 새로운 분석적 접근법을 제시한다는 것은 기초 생물학적 작용 및 질병을 이해하는데 매우 중요하다.
지난 몇 년 동안 시료 제작법, 실험 설계 방법 그리고 분석장비 성능 측면에서 많은 진보가 있어왔으며 이는 대사체에 대한 분석 기술의 발전으로 이어졌다. 또한 대사체학 연구 기술은 화학정보학(chemoinformatics), 생물정보학(bioinformatics) 분석 도구와의 결합으로 인해 더욱 정밀해지면서 기존에 이해되지 못한 현상들을 설명할 수 있는 중요한 연구분야로 자리잡게 되었다. 이는 대사체와 특정 표현형(phenotype) 사이의 연관성을 분석이 가능해 졌음을 의미하며, 따라서 대사체 연구는 생리학적 상태나 질병을 특정하는 바이오 마커(biomarkers)의 발굴에 활용될 수 있다. 현 시점에서 우리에게 주어진 숙제는 수 많은 대사체를 간단하게 식별하여 이를 바이오 마커로 직접 활용하는 방법, 각 대사체의 생리학적 역할이 전체 대사 네트워크를 어떻게 구성하는지, 그리고 이러한 대사체의 변화가 다양한 생물학적 표현형에 미치는 영향을 알아내는 것이다. 이번 리뷰에서는 대사체를 동정하고 실험을 설계하여 대사 네트워크 지도(pathway mapping)를 만드는 방법에 대해 알아보고 이러한 대사체 정보가 분자적 작용기전을 이해하고 생물학적 인과관계를 추론하는데 있어 어떻게 활용될 수 있는지 논의해 보고자 한다.
2. 대사체학의 현황(Current challenges in metabolomics)
대사체를 찾아내고 이를 정확하게 검증(validation)하는 것은 여전히 중요한 과제이나, 더욱 중요한 것은 각 대사체가 갖는 생물학적 의미를 부여하고 이를 질병 발현기전 규명에 적용하는 것이다.
2.1 대사체 동정 및 검증(Metabolite identification and validation)
대사체와 표현형 사이의 상관관계를 찾기 위해서는 관련 대사체를 동정하고 바이오 마커를 검증하는 것이 필수적이다. 일반적으로 이 과정은 비 표적 대사체 분석(untargeted metabolic analysis)을 수행하여 시료 내 대사체 구성에 대한 정보를 확보하고, in silico 기반의 분석이나 대사체 데이터베이스의 개발 또는 대사체의 특성을 확인하는데 사용되는 ‘표준물질(standard compounds)’을 사용함으로써 일부 대사체의 특성을 확인하는 것으로 이루어진다(Box 2).
이 후 바이오 마커의 검증단계로 진행되는데 이는 상당히 어렵고 복잡한 과정이다. 가장 큰 이유 중 하나는 대조군과 비정상 조건(실험군) 사이의 대사체 농도 차이가 매우 적어 정확한 측정이 어렵거나 표적 대사체 분석(targeted metabolic analysis) 대상이 존재하지 않아 후속 검증이 불가능한 경우가 존재할 수 있기 때문이다. 따라서 이러한 경우 표현형과 대사체의 변화를 검증할 수 있는 별도의 코호트 연구가 필수적으로 요구된다. 또 다른 이유는 연구집단 구성요소들의 다양한 유전적/환경적 차이로 인해 대사체의 특성에 편차가 커질 가능성이 높다는 점이다. 이는 특정 조건에 대해 상관관계를 나타내면서 유의미한 바이오 마커의 단서로서 기능하는 대사체를 확인하는데 간섭요인으로 작용하기 때문이다. 특히 암과 같이 다양한 내재적/외재적 간섭요인을 갖는 질병을 연구할 때 이러한 문제는 더욱 커지게 된다. 이러한 간섭 문제를 극복하기 위해서는 연구 대상의 범위를 한정하거나 계층화하는 방법을 사용하거나, 회귀 모델링과 함께 환자 설문을 수행하여 중요도가 높은 대사체들을 추출할 수 있는 방법을 찾아야 한다. 기술적으로 대사체의 비율을 분석하거나 소변 내 크레아티닌 수치를 사용하여 대사체량을 표준화(normalization)하는 방법을 분석에 활용할 수도 있다. 식습관, 나이, 성별, 운동과 같은 조건도 간섭요인으로 작용할 수 있으며, 이러한 경우 각 요인에 따른 대사체량 정상범주를 분석한 데이터베이스를 사용하는 것이 도움이 된다(Human Metabolome Database [http://www.hmdb.ca]; FooDB [http://foodb.ca]).
2.2 대사체의 기능적 분석(Functional analysis of metabolites)
대사체의 생물학적 기능을 규명하고 바이오 마커를 찾아내는 것은 궁극적으로 생명 현상이나 질병의 기전을 밝히는 것에 목표를 둔다. 대사성 표지(metabolic signature)의 생물학적 기능을 규명하기 위해서는 대사 경로(metabolic pathway) 내에서 각 대사체들의 기능이 밝혀져야 하며, 같은 맥락으로 질병과 같은 비정상 조건에서 어떤 대사 경로가 관여되는지 또 어떻게 변화되는지 알아야 한다. 그 동안 여러 연구를 통해 다양한 대사 경로 지도(metabolic pathway map)가 만들어졌으며(대략 2,000여 개의 대사체를 포함) 연구자들은 이를 활용할 수 있다. 그러나 일부 대사체에 대한 특성은 아직 알려져 있지 않기 때문에 대사 경로 지도를 활용하여 결과물을 도출하는 것은 아직 불완전하다. 이러한 한계는 동일한 시료에서 추출된 ‘오믹스(omics)’ 데이터와 대사체 정보를 통합하여 분석하는 ‘다층접근법(multi-leveled approach)’을 통해 극복될 수 있다.
3. 최신 분석 기술(Recent technical advancements)
대사체와 유전체 그리고 단백체는 생체 내에서 유기적으로 영향을 미치며, 이러한 상호 관계를 이해하지 않는다면 기전을 설명할 수 없을 것이다. 광범위한 대사체 중 중요한 대사체를 선별해 내고 생물학적인 의미를 부여하여 기전을 규명하기 위해서는 다양한 실험기법과 분석기술이 절대적으로 요구된다(그림 1).
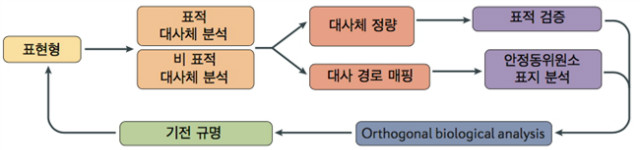
그림 1. 표현형을 설명하기 위한 대사체 연구 방법론
3.1 정보학(informatics)
질량분석기(Box 1)에 의해 얻어진 대사체 정보는 각 시료로부터 생성되는 수 많은 이온정보로 표현되며, 여기서 이온들은 대사 전구체나 대사체의 일부, 부가적 생성물이나 동이원소를 나타낸다. 따라서 중복되거나 불필요한 정보를 제거하고 필요한 요소만 추출하기 위해 computational tool을 사용하여 특정 대사체를 찾아내야 한다. 이러한 과정은 상당한 시간과 노력을 요구하기 때문에 데이터 추출, 대사체 선별 및 생물학적 의미 부여에 이르는 전 과정을 자동으로 수행할 수 있는 ‘work-flow’ 시스템이 구축되어야 한다.
따라서 일반 연구자들도 일련의 분석 시스템을 활용할 수 있도록 US National Institutes of Health (NIH)는 여러 교육 프로그램을 운용하고 있는데, 데이터 처리 및 해석을 포함하여 다양한 실습자료를 제공함과 동시에 온라인 교육도 실시하고 있다(https://commonfund.nih. gov/metabolomics). European Commission COSMOS Grant에 의해 지원되는 Coordination of Standards in Metabolomics (COSMOS) 역시 NIH의 프로그램과 유사한 기능을 하며, 여러 연구자들이 도출한 실험 데이터를 공유하면서 대사체 연구 표준화를 목표로 협력하고 있다. 또한 ‘work-flow’ 구축을 위한 다양한 분석 프로그램도 사용이 가능하다. 분석장비 공급업체가 제공하는 소프트웨어나 데이터 업로드부터 대사체 경로 분석까지 가능한 개방형 소프트웨어도(open-access software)도 사용이 가능하다(XCMS Online). 제공되는 다양한 데이터베이스 및 분석도구를 사용함으로써 대사체가 어떤 대사 경로를 구성하는지, 대사체와 유전자 혹은 단백질 사이의 상호작용이 어떻게 이루어 지는지 예측할 수 있다.
3.2 안정동위원소표지 추적자(Stable isotope-assisted metabolomics)
대사 경로에서 대사체의 역할을 확인하는 가장 좋은 방법 중 하나는 안정동위원소표지 추적자(isotope tracer)를 사용하는 것이다. 비표적 대사체 분석을 통해 얻어진 정보를 기반으로 대사체를 특정하게 되면, 탄소(13C), 질소(15N) 또는 중수소(2H)로 표지된 대사체(stable isotpe-labelled metabolite)를 사용하여 해당 대사체가 어떤 특성을 갖는지 그리고 어떤 대사 경로에 관여하는지 알 수 있다. 표적/비 표적 대사체 분석을 통해 얻어진 결과는 대사율이나 대사 경로 활성에 대한 정보는 제공하지 않으나, 표지 대사체를 사용하면 특정 표현형과 관련된 화합물(영양소 또는 기질)의 대사 경로를 추적할 수 있다. 예를 들면, 대사적으로 안정한 상태에서는 전체 대사체 변화가 시간이 지남에 따라 평형을 이루게 되어 대체적으로 일정한 흐름(flux or conversion rate)를 나타내는데, 만약 표지된 영양소를 사용하게 되면 영양소의 종류에 따라 어떤 대사체가 축적되는지 정량화할 수 있을 것이다. 또한 표지된 대사체를 사용하여 대사체 생성에 관여하는 기질 정보를 밝혀낼 수도 있다. 표지 대사체를 이용한 연구에서, 비소세포폐암(non-small-cell lung cancer) 초기 단계에서는 glutaminase 1보다 pyruvate carboxylase가 선택적으로 더 활성화된다는 것이 확인되었다.
3.3 Orthogonal 접근법을 이용한 기전연구(Orthogonal approaches for mechanistic stud-ies)
전사체와 단백질 발현 사이에는 어느 정도 상관관계가 존재한다. 그러나 대사체는 효소 작용이나 다양한 자극에 의해 상태가 변화될 수 있기 때문에 대사체와 유전자/단백질 간 상관 관계에 대해 명확히 이해하기 어렵다. 이를 위해서는 오믹스 데이터(genomics, epigenomics, proteomics and tranomics)를 활용해야 한다. 그림 2에는 전사체, 단백체, 대사체 사이의 생물학적 연관성을 분석하는데 이용할 수 있는 다양한 orthogonal 접근법이 도식화되어 있다. 특정 효소가 대사체 생산에 영향을 미치는지 알아보기 위해 해당 효소의 유전자의 발현을 RNA interference (RNAi)이나 CRISPR 시스템(CRISPR-Cas-mediated knock out)을 통해 억제한 후 관련 대사체 생산량을 비교 분석할 수 있다. 이와 마찬가지로, 특정 대사체에 대한 구조적 유사체(structural analogues, an-ti-metabolites)를 사용하여 관련 효소의 기능을 저해함으로써 해당 대사체의 생산 변화를 관찰할 수도 있다. 또 다른 예를 들면, 항생제나 면역 조절제를 사용하여 상주 미생물의 기능을 조작하면 박테리아 대사체 환경을 변화시킬 수 있고 이러한 변화가 숙주의 대사 과정에 어떻게 영향을 미치는지 알 수 있을 것이다. 체내에 존재하는 상주 미생물은 항암면역 치료의 효과에 영향을 미치기도 하는데, 특정 박테리아가 암세포를 공격할 수 있는 T 림프구의 활성화를 유도한다는 것이 밝혀지기도 하였다.
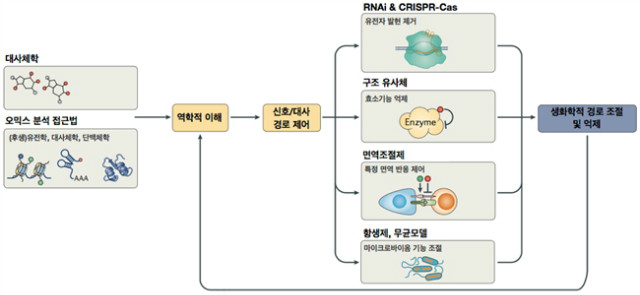
그림 2. 대사체학 시점에서 바라본 대사 기능조절을 통한 연구방법
4. 대사체 연구를 이용한 생물학적 현상의 해석(Novel biological insights)
4.1 암과 세균성 바이오필름(Role of bacterial biofilms in cancer)
N1,N12-diacetylspermine (DAS)는 대장암 환자에서 증가하는 대사체로 이미 여러 연구를 통해 대장암 바이오 마커로 검증되었다. 대장암과 DAS 사이의 상관관계를 밝힌 연구에서는 생화학 실험 기법과 대사체학 연구에서 사용되는 네 가지 기법을 결합하여 새로운 사실을 알아낼 수 있었다. 대사체 확인은 비표적 대사체 프로파일링을 통해 정상 조직과 대장암조직을 비교하여 수행되었고 이어서 대사체의 변화를 수치화 함과 동시에 DAS의 대사 경로에 포함된 다른 대사체들을 분석하고자 표적 대사 프로파일링을 수행하였다. 밝혀진 내용으로는, 전구물질이 아닌 DAS 자체가 대장암뿐만 아니라 세균의 침착으로 인해 형성되는 biofilm 형성에 중요하며, DAS는 polyamine의 최종 대사 산물이라는 것이다. Nanostructure-imaging mass spectrometry (NIMS)을 사용하여 분석한 결과 biofilm이 위치하는 결장 점막층에 DAS가 존재한다는 것이 확인되었다. 또한 대장암 세포주에 동위원소로 표지된 DAS를 처리하여 관찰하였을 때 DAS가 최종 대사 산물이며 다른 대사 경로는 관여하지 않는다는 것이 밝혀졌다. DAS의 증가 원인을 분석하고자 항생제를 사용하여 대장암 환자의 biofilm을 제거한 후 in situ hybridization (FISH) 분석을 시행하였다. 그 결과, DAS 농도는 biofilm 음성 또는 양성인 대장암 환자에서 비슷한 수치를 보였고 이는 biofilm 양성인 대장암 환자에서 증가하는 DAS는 biofilm으로부터 기인한다는 것을 의미한다. DAS는 polyamine의 대사체로 세포 증식과 같은 다양한 세포 반응에 연관되어 있다. 따라서 면역조직화학(immunohistochemistry) 및 면역형광염색(immunofluorescence stain)을 사용하여 확인한 결과 biofilm이 존재하는 경우 결장 세포가 과다증식하는 경향이 있고 조직 주위에 염증성 사이토카인(pro-inflammatory cytokines)이 증가한다는 사실도 확인되었다. 흥미로운 것은 biofilm 양성인 정상 조직에서도 유사한 염증성 사이토카인 프로파일이 관찰된다는 점이다. 즉, biofilm의 존재는 정상 조직으로부터 대장암을 유도할 수 있다는 것을 암시한다(그림 3).
기술된 연구 내용은 다양한 분석 기술을 결합한 대사체 분석이 초기 대사체의 특성 확인에서 대장암의 발병에 이르는 기전을 어떻게 설명할 수 있는지 보여주는 좋은 사례이다.
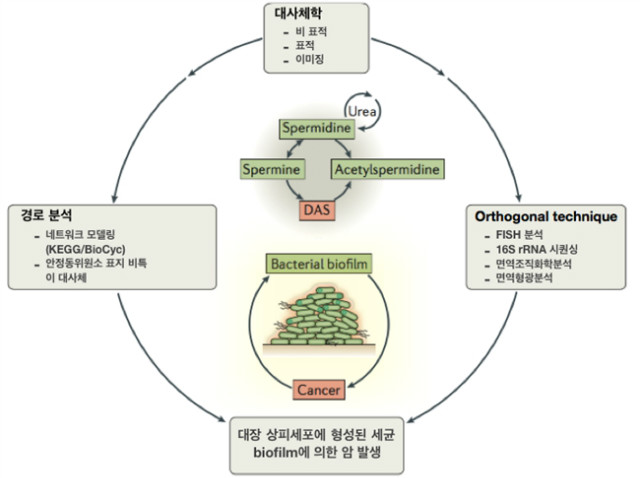
그림 3. 세균성 biofilm에 의한 대장암 유도와 diacetylspermine (DAS)의 역할 규명
4.2 대사조절에 의한 세포 전분화능 조절(Metabolic regulation of cell pluripotency)
후성유전학 관점에서 대사체는 인간 배아 줄기세포(embryonic stem cell, ES cell)의 전분화능(pluripotency)을 조절하는데 관여하는 것으로 알려져 있다. 이번에 소개할 연구에서는 naive 줄기세포를 primed 줄기세포로 변화시키는 대사 스위치(metabolic switch)에 대해 설명한다.
이 대사 스위치는 히스톤의 메틸화(histone methylation)에 필요한 S-Adenosyl methionine (SAM) 발현을 조절하는 nicotinamide N-methyltransferase (NNMT)에 의해 조절된다는 것이 확인되었다. 산소 소비율을 분석해 보면 primed 줄기세포는 naive 줄기세포에 비해 산소소비량이 낮았고, 이는 미토콘드리아의 전자 수송 관련 유전자의 발현 감소로 재확인 되었다(tranomic analysis). 또한 primed 줄기세포로의 전환 과정에서 WNT 신호전달이 감소하였고 저산소증 유도인자 1 알파(hypoxia-inducible factor 1α, HIF1α) 안정화 정도는 증가하였다(proteomics analysis). 가스 크로마토그래피 및 액체 크로마토그래피 질량 분석기(GC-MS 및 LC-MS)를 사용하여 비표적화/표적화 대사체 분석을 수행하였을 때 glycolysis, fatty acid beta-oxidation 및 지질 생합성의 대사 경로의 변화가 확인되었고, 관련 유전자의 발현 역시 변화되었다(tranomic/genomic analysis). 그리고 일련의 결과들을 바탕으로 HIF1α 및 WNT 신호 전달 관련 유전자의 기능을 CRISPR-Cas 시스템을 사용하여 제거한 실험을 통해 naive 줄기세포에서는 WNT 신호전달이 활성화 되어있고 primed 상태로 전환되는 경우에는 HIF1α가 필요하다는 것이 확인되었다. 만약 naive 줄기세포에서 NNMT 유전자가 소실될 경우 대사 스위치 관련 유전자의 ‘히스톤 억제 표지(repressive histone marks, histone3 Lys27 trimethylation; H3K27mc3)’가 증가하게 되고 결과적으로 primed 줄기세포로의 전환은 억제된다.
4.3 심혈관 질환에 대한 새로운 치료 접근법 제시(Novel therapy for cardiovascular dis-ease)
다음으로 소개할 내용은 대사체 분석을 통해 도출된 결과를 사용하여 심혈관 질환(cardiovascular disease, CVD) 발생 위험성을 감소시킬 수 있는 새로운 치료 접근법을 제시한다.
비표적/표적 대사체 분석을 통해 CVD의 발생 위험성 증가는 혈중 choline, betaine, trimethylamine N-oxide (TMAO) 농도와 관련성이 높다는 것이 이미 알려져 있었다. 이러한 결과는 동물실험을 통해 재확인 되었는데, high-choline 그리고 high-TMAO를 섭취한 Apoe-/- 마우스(apolipoprotein E knock-out mice)의 경우 동맥경화반(atherosclerotic plaques)의 형성이 더 많았다. 이는 choline과 TMAO가 CVD 발생을 증가시킬 수 있다는 것을 의미한다. 또 다른 실험을 통해 trimethylamine (TMA)를 포함하는 물질, 가령 예를 들면 choline 이나 phosphatidylcholine, carnitine과 같은 물질들은 TMAO의 전구물질로 작용하며, 간에 포함되어 있는 flavin monooxygenases (FMOs 또는 FMO3)가 TMA를 TMAO로 전환시키는 역할을 한다는 것이 확인되었다. 또한 미생물 전염에 의해 CVD 위험성이 동반된다는 이전 연구결과에 따라 마우스에 항생제를 처리하였을 때 TMA가 미생물에 의해 생성된다는 것도 확인되었다.
앞서 설명한 바와 같이 FMO3가 TMAO 생성에 중요한 역할을 하기 때문에 CVD 발생 가능성을 낮추는 목적으로 FMO3 억제제를 사용할 수 있을 것으로 생각되지만 FMO3 억제제는 상당한 부작용을 초래하며 인체에 장기간 사용할 수 없다는 문제를 내포하고 있다. 따라서 미생물의 TMA 생성을 억제할 수 있는 물질을 사용하여 CVD 치료제로서의 가능성을 조사하게 되었다. Extra-virgin 올리브 기름에는 choline 구조적 유사체(analogue to choline, 3,3-dimethyl-1-butanol (DMB))가 포함되어 있는데, 이를 처리하면 미생물의 TMA lyase 기능 억제가 가능했다. 이에 마우스 실험을 통해 DMB의 효과를 증명하였는데, DMB가 처리된 마우스에서 TMAO 수치가 낮아지는 것이 확인되었고, Apoe-/- 마우스에서 역시 동맥경화반 형성이 감소하였다. 비록 이러한 치료 접근법은 CVD 환자에게 적용하기에는 무리가 있는 방법이지만, CVD 발생 위험성을 증가시키는 내장 미생물을 ‘약물화(drugging)’함으로써 유해한 대사체의 초기 생산을 억제시킨다는 전략을 제시한다.
4.4 대사체에 의한 β-cell의 기능조절(Metabolite-driven regulation of β-cells)
중요한 대사체의 하나인 3-carboxy-4-methyl-5-propyl-2-furanpropanoic acid (CMPF)는 2형 당뇨나 전당뇨 및 임신성 당뇨 환자의 혈장에서 확인되며, 이는 비 표적/표적 대사체 분석 및 ELISA (enzyme-linked immunosorbent assay) 검사를 통해 추가적으로 검증되었다. 당뇨환자 수준의 CMPF를 마우스에 처리하게 되면 포도당 불내성과 인슐린 분비 장애가 유도되었다. 미토콘드리아 막전위 검사와 유전자 발현 검사를 통해 CMPF는 glucose-induced ATP의 합성을 감소시키고 산화적 스트레스(oxidative stress)를 증가시켜 미토콘드리아의 기능을 손상시키는 것으로 확인되었다. 또한 organic anion transporters (OAT) 억제제는 CMPF가 췌장의 β-cell로 이동하는 것을 차단함으로써 췌장 기능장애를 예방한다는 것이 확인되었다. 이에 따라 OAT3 KO 마우스에서 분리한 췌장세포에 CMPF를 처리하고 대사 분석을 시행한 결과 인슐린의 양은 변함이 없었다. 즉, CMPF는 미토콘드리아의 기능을 손상시킴으로써 인슐린 생합성을 억제한다는 것이다.
4.5 허혈-재관류 손상 기전(Mechanism of ischaemia?reperfusion injury)
세포와 조직에 혈액공급이 중단되면, 이는 곧 조직손상으로 이어지기 때문에 이를 막기 위해서 혈류를 개선해야 한다. 이처럼 허혈이 발생한 후 혈류가 재개되는 과정을 ‘재관류(reperfusion)’라고 하는데, 모순적으로 이 과정에서 세포와 조직에 손상이 일어난다. 이러한 손상을 ‘허혈성-재관류 손상(ischaemia-reperfusion injury)’이라고 한다. Tricarboxylic acid cycle (TCA) 과정에서 생성되는 대사체인 succinate는 활성산소의 생성에 중요한 것으로 알려져 있다. 따라서 silico 모델링, 미토콘드리아 막전위 측정 등을 사용하여 분석한 결과, 허혈성-재관류 손상의 경우 succinate dehydrogenase (SDH)에 의해 succinate가 축적되는 것으로 확인되었다. 일단 재관류가 일어나게 되면, succinate는 산화되어 미토콘드리아 복합체 I (mitochondrial complex I)을 통해 전자가 유도되는데, 이 과정에서 활성산소가 생성되는 것이다. 종합하면 SDH는 허혈성-재관류 상태에서 생성되는 활성산소의 축적을 예방하기 위한 표적이 될 수 있음을 의미한다.
4.6 종양세포의 대사조절(Regulation of cancer cell metabolism)
다음은 인간 교모종세포(glioblastoma)에서 미토콘드리아의 serine hydroxymethyltransferase (SHMT2)의 기능을 조사하기 위해 대사체 변화를 분석한 연구를 소개한다. 특히, 탄소중심대사 및 pyruvate kinase M2 (PKM2) 활성 조절에 있어 SHMT2의 역할을 분석하였는데 이는 교모세포 성장과 관련이 높은 것으로 확인되었다. 또한 SHMT2 KO 세포를 탄소 동위원소(13C)로 표지된 glucose로 처리하였을 때 pyruvate로 부터 lactate, citrate, alanine 생성이 증가하였으며 동시에 산소 소비율과 PKM2 활성이 증가하였다. 안정동위원소표지 추적자 분석 결과 SHMT2 발현은 종양 세포 내 대사를 변화시켰으며 PKM2 작용을 억제함으로써 TCA cycle 탄소흐름(carbon flux)을 억제하였다. 즉 종양세포가 생존할 수 있는 환경으로 변화한 것이다. 그리고 SHMT2를 높은 수준으로 발현하는 종양 세포는 glycine decarboxylase의 활성이 억제되는 경우 생존율이 감소하는데 이는 glycine의 세포 내 축적을 야기하여 독성 대사체의 생성이 증가하기 때문이다. 이상의 결과는 종양 세포에서의 대사 변화가 어떻게 세포의 특성변화에 영향을 미치는지 보여주는 좋은 예이다.
5. 대사체학의 미래(Future perspectives)
대사체학은 연구 범위가 점차 넓어지고 있으며, 바이오 마커 발굴부터 표현형을 나타내는 기전을 설명하는데까지 그 역할이 다양하다. 이는 분석 기술과 정보학의 발달에 의해 가능해졌으며, 생물학, 생리학, 화학 분야의 다양한 분석 도구의 사용으로 지금까지 설명할 수 없었던 많은 생물학적 현상을 이해하는데 도움을 주고 있다. 향후 대사체학은 다른 연구분야와 통합되어 시스템 생물학의 한 부분으로 자리매김할 것이다.
Box 1. 대사체 분석과 질량분석법의 활용(Mass spectrometry in metabolomics)
? 질량분석기(Mass spectrometry)
질량분석기는 분자나 분자를 이루고 있는 단편의 질량을 질량 대 전하 비율(mass-to-charge ratio (m/z)) 및 기체상 이온의 존재 비율로 측정하여, 시료에 존재하는 화합물의 양과 유형을 확인하는데 사용하는 분석화학기법이다. 질량분석기는 높은 감도, 재현성 및 다양성을 제공하기 때문에 대사체 분석에 있어 탁월한 분석 플랫폼을 제공한다. 질량분석을 위해서는 모든 시료는 기체화되어야 하는데, 시료의 상태나 특징에 따라 기체화하는 방법이 달라질 수 있으며, ‘직접주입법(direct injection)’을 통해 높은 처리량으로 대사체 정보를 얻을 수 있다.
? 비표적/표적 대사체학(untargeted/targeted metabolomics)
핵자기공명장치(Nuclear magnetic resonance spectros, NMR)와 질량분석장치(Mass spectros, MS)를 사용하여 대사체를 프로파일하기 위해 사용되는 방법은 비표적화(Non-targeted) 방법과 표적화(Targeted) 방법으로 나눌 수 있다. 비표적화 방법(untargeted metabolomics)은 고해상도 장치를 사용해야 효과적이며, 다양한 대사 경로에서 대사체들의 상호 연관성을 분석할 수 있다는 장점이 있다. 다만 비표적화 방법은 여러 간섭현상으로 인해 모든 대사산물의 정보를 확보할 수는 없고 데이터베이스에 정보가 없는 대사체들의 경우 분석에 제한이 있으나, 광범위한 대사체 정보를 확보할 수 있다. 표적화 방법은 비표적화 방법에 비해 한정된 특정 대사체만을 분석 가능하다는 단점이 있으나, 대사체의 정성 및 정량이 가능하다는 장점이 있다. 최근에는 한 번의 분석으로 수백 개 이상의 대사체를 동시에 정량분석 가능한 multiple reaction monitoring(MRM) 방법이 활용되고 있다.
? 대사체 이미징(Imaging metabolomics)
매트릭스보조 레이저탈착이온화(Matrix Assisted Laser Desorption Ionization, MALDI), 나노구조 개시제 질량 분석법(nanostructured initiator MS, NIMS), 탈착 전자 분무 이온화 질량분석법(microspray ionization mass) 등의 이미징 질량 분광법 기술을 사용하여 조직 샘플 내에서 특정 대사체의 위치정보를 알아내는 것이 가능하다. 분광법 (Desorption electrospray ionization, DESI) 및 2차 이온 질량 분광법(Secondary Ion Mass Spectrometry, SIMS) 등이있다. NIMS와 DESI는 특히 작은 분자의 분석에 적합하다.
Box 2. 컴퓨터를 이용한 대사체 분석(Computational tools in metabolomics)
? 대사체 동정 및 관련 데이터베이스(Metabolite identification and databases)
대사체 정보의 초기 형태는 질량 대 전하 비율값으로 도출되며, 몇몇 데이터베이스를 사용하면 이러한 초기 데이터는 해당 대사체를 동정하는데 사용할 수 있다. 잘 알려진 데이터베이스 몇 개를 소개하면 METLIN (https://metlin.scripps.edu/landing_page.php?pgcontent=mainPage), HMDB (http://www.hmdb.ca), MassBank (https://massbank.eu/MassBank/) and GMD (http://gmd.mpimp-golm.mpg.de)이 있다. 많은 대사체들은 구조적으로 유사한 형태의 구조 이성질체를 가질 수 있다. in silico 분석도구를 사용하면 대사체의 특성 (단편의 특징 및 시간정보)에 기반하여 대사체와 구조 이성질체에 대한 식별이 가능해 진다. 물론 데이터베이스에 대사체 정보가 저장되어 있어야 분석이 가능하다.
? 대사체의 생물학적 해석(biological interpretation)
네트워크 모델링 및 경로 매핑(mapping) 도구들은 대사체 사이의 상관관계 또는 생물학적으로 비정상적인 상태에서의 대사체 역할을 이해하는데 많은 도움이 된다. 그리고 대사체를 상위 유전자나 단백질과 함께 유기적으로 분석할 수 있는데, Kegg, Biocyc, Recon와 mummichog, MSEA와 같은 도구들이 사용하면 포괄적인 대사 네트워크에 대한 분석이 가능하다. 또한, 안정동위원소 대사체와 오믹스 규모의 데이터와의 통합으로 대사체와 유전자 및 단백질 사이의 상관관계를 밝힐 수 있다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식


 pdf_0002875.pdf
pdf_0002875.pdf