기술동향
암 중개연구를 위한 전임상 플렛폼과 활용(in vitro 모델과 in vivo 모델의 최신 기술과 적용)
- 등록일2018-01-18
- 조회수18214
- 분류기술동향
-
자료발간일
2018-01-04
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#암#플렛폼
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
암 중개연구를 위한 전임상 플렛폼과 활용(in vitro 모델과 in vivo 모델의 최신 기술과 적용)
연세대학교 의과대학 의생명과학부/유한-연세 폐암 중개연구소
/ 표경호
[목 차]
? 프롤로그
1. 국내외 암 현황
2. 중개장벽을 허물기 위한 중개연구
3. 인류의 암에 대한 발견과 치료: 광범위한 의미의 중개연구의 역사
4. 신약개발을 위한 전, 임상연구 플렛폼
4.1 In vitro 모델
4.1.1 상업화된 세포 주 모델과 세포주 백과사전 CCLE
4.1.2 환자유래 세포(CRC) 모델
4.1.3 암유전자 삽입 Ba/F3 세포주 모델
4.1.4 오가노이드/스피어 모델
4.2 In vitro 분석 플렛폼
4.2.1 단일세포 NGS를 이용한 오믹스 분석
4.2.2 ddPCR을 활용한 단일세포 수준의 PCR
4.3 In vivo 모델
4.3.1 동종이식 마우스종양모델(Syngeneic mouse model)
4.3.2 유전자재조합 마우스모델(Transgenic mouse model)
4.3.3 이종이식 마우스종양모델(Xenograft mouse model)
4.3.4 인체면역반영 이종이식 마우스모델
4.4 In vivo 분석 플렛폼
4.4.1 Vectra 시스템을 이용한 다중형광이미징 분석
4.4.2 CyTOF를 단일 세포 및 병리분석
4.5 중개연구를 위한 BI 인프라
4.6 중개연구를 위한 임상샘플 뱅킹
5. 중개연구를 위한 플렛폼 적용 전략
6. 참고문헌
[요약문]
중개연구는 기초연구와 임상연구의 중개장벽을 넘기 위한 중요한 연구이며, 신약개발에 있어서 큰 원동력이다. 항암제 신약개발을 위한 다양한 in vitro, in vivo 연구 방법이 있지만, 최근 면역항암제에 대한 개발과 표적치료제의 개발로, 기존과는 다른 암 모델과 분석방법이 요구되고 있다. In vitro 모델에서는 오가노이드(organoid)를 이용하여 좀더 생체와 가까운 시스템으로 다양한 신약들이 적용 및 평가되고 있으며, 단일 세포 수준의 분석을 토대로, 암의 이종성(heterogeneity)를 이해하고 해석하는 시도들이 진행되고 있다. In vivo 실험에서도 동종이식모델을 비롯하여 환자의 암이 이식된 아바타(avatar) 마우스에 이르기까지, 다양한 동물 모델이 활용되고 있다. 최근 면역치료제의 개발로 인체 면역세포를 생산하는 동물 모델이 중개연구에 사용되고 있다. 암의 병리학적 분석 방법에 있어 7가지 이상의 단백질 마커를 병리 슬라이드에서 동시에 정량 가능한 Vectra 시스템, 그리고 인공지능 AI가 적용된 분석방법들과 이온 플라스마와 분광 스펙트럼을 적용한 CyTOF에 이르기까지 다양한 분석 플랫폼 개발, 응용되고 있다. 필자는 ‘암 중개연구를 위한 전임상 플랫폼과 활용’을 주제로 하여, 최근 중개연구에 있어서 요구되는 다양한 연구기술 가운데, 최신 연구 플랫폼을 선별하여 소개하고자 한다.
? 프롤로그
필자는 연세대학교 조병철 교수님 아래에서 박사 후 연구원으로 중개의학연구를 수행하고 있다. 개인적으로 ‘중개연구’에 대한 기초적 지식이 부족하다는 생각이 있어 명확치 않았던 부분들을 정리하고 싶었다. 운 좋게도, Bric에서 이러한 부분들을 정리할 수 있는 기회를 주어 ‘암 중개연구를 위한 전임상 플렛폼과 활용’이라는 주제로 연구동향을 쓸 수 있게 되어 감사하다. 본 내용에서는 ‘암 중개연구’에 대한 개념적인 부분과 최근 중개연구에서 응용되고 있는 몇몇의 최신 기술에 대하여 소개를 하고자 한다.
1. 국내외 암 현황
전 세계적으로 암으로 진단되는 환자는 연간 1천만 명에서, 2020년까지 연간 1천 7백만 명으로 증가될 것으로 보고되었다. 증가에 대한 원인으로는, 다양한 원인이 있는 것으로 보고되었으며, 그 중 가장 큰 원인은 인구의 고령화이다. 사회적으로 고령화가 진행되면서 65세 이상 인구의 비율이 높아지고, 이에 따라 암 발생빈도가 높아지고 있다[1]. 우리나라의 경우에는 2002년부터 고령화 사회에 진입하면서 암 발생과 암 사망률이 더욱 높아지고 있다. 국립암센터의 결과에 의하면, 1983년 이후 26년간 국민 사망원인 1위로 인한, 사회, 경제적 손실 비용은 2005년 기준으로 14.1조에 달한다[2]. 암 환자의 증가는 범 국가적인 손실을 가져온다. 앞으로 더 많은 사람들이 암으로 고통을 받고, 암의 치료를 위한 경제적 어려움을 겪을 것이며, 국가에서는 암을 치료하기 위한 보험을 확대, 예산 확충을 위한 증세 등 악순환의 고리가 지속적으로 유지될 것으로 예상된다.
2. 중개장벽을 허물기 위한 중개연구
암의 극복을 위해서는 무엇보다도 신약개발이 필요하다. 신약개발에서 가장 중요한 아이디어와 타겟 설정은 기초연구에서 기인한다. 다각적인 차원에서 만들어진 신약은 최종적으로 암 환자에 적합한 치료방법 중 한가지로 제공된다. 아이디어-신약개발-임상적용에 이르는 순차적인 프로세스를 위해 다각적인 차원에서 기초연구-기업-임상연구에 이르는 협력연구가 필요하며, 이러한 연구를 중개연구 (translational research, TR)라고 한다. 초기 중개 연구에 대한 개념을 종합하여 보면, 실험실 혹은 임상에서 확인된 발견을 토대로 하여, 이를 인간의 건강에 유익을 줄 수 있는 임상적 ‘번역(translation)’ 과정, 그리고 결과를 통칭하는 연구’로 요약할 수 있다. 중개연구는 ‘중개장벽(Translational blocks)’을 최소화 하기 위한 시도이며, 이는 기초연구에서 임상연구에 이르기까지 수많은 문제점들을 해결해 나아가는 과정이다. 중개장벽은 T1, T2로 구분되며, ‘T1 연구장벽’을 해소하기 위해서는 기초-임상의 연구 교류 등이 필요하고, 원천기술보호를 위한 인프라 등이 이를 뒷받침 해 주어야 한다. ‘T2 연구장벽’을 해소하기 위해서는 ‘확보된 신기술’을 토대로 하여, 신약으로의 ‘가치’, ‘활용’ 등을 평가하기 위한 추가적인 다양한 임상, 전임상 연구들이 필요하다. 이를 위해서는 막대한 비용과 시간이 필요하다[3].
T1 중개연구는 전임상 연구가 포함되며, 신약이 타겟할 수 있는 부분과 기전 등을 확보한다. 따라서 이 연구에 있어서는 연구자의 창의성이 필수적이다. 개발된 신약의 타겟 이외에도 다른 독성을 보일 수 있기 때문에, 이를 임상연구에 진입하기 전에 다양한 가능성을 고려하여 해결해야 하는 bottom up 형태의 연구이다. T2 중개 연구의 경우에는 임상연구가 주된 부분이므로, 질병관점에서 환자 기반으로 임상적 유효성과 유용성을 확인하는 비교평가 및 적용이 필요한 top-down 형태의 기획연구이다. T2의 중개연구가 제대로 수행되기 위해서는 T1에서 확보될 수 있는 수많은 가능성 등을 고려해야 하며, 이를 바탕으로 전임상 연구 등이 뒷받침되어야 성공적인 임상연구가 가능하다[4]. 필자는 보다 성공적인 전임상 연구를 위한 T1 중개연구를 위한 in vivo, in vitro, in silico 플렛폼에 대하여 소개를 하고자 한다.
3. 인류의 암에 대한 발견과 치료: 광범위한 의미의 중개연구의 역사
항암효과를 위한 가장 기초적인 처치는 ‘수술적 요법’이며, 2세기경의 Galen이라고 하는 그리스의 한 의사는 히포크라테스에 필적하는 암환자 진단과 치료에 많은 업적을 가지고 있다. 암 치료는 16세기에 이르러 암이 단순히 수술로만 제거될 수 없다는 것이 밝혀졌고, 이후 Scottish와 John Humter에 의하여 종양 전이(metastasis)가 처음 확인되었다. 19세기는 병리학적으로 종양을 관찰한 시점이며, Rudolf Virchow는 세포 병리(cellular pathology)를 정립하였다[5].
19세기는 호르몬으로 유방암을 치료한 중요한 시점이었다. 1874년 에딘버그 대학을 졸업한 Thomas Beatson은 임신한 토끼의 난소를 제거(oophorectomy)한 토끼의 유선에서 젖이 생산되지 않음을 확인하였고, 난소에서 나오는 어떤 조절인자가 먼 거리에 있는 다른 기관을 조절할 수 있을 것이라는 가설을 세웠다. 그는 사람 또한 난소에서 나오는 특정인자와 유방암이 연관되어 있을 것으로 보고, 그 조절 물질이 에스트로겐(estrogen)이라는 것을 밝혔다. 지금은 호르몬에 의한 종양생성을 억제할 수 있는 tamoxifen, aromatase inhibitor 등이 유방암 억제의 치료 및 예방에 사용되고 있다. 반 세기 이후에 시카고대학의 Beatson과 Charles는 앞서 유방암과 비슷하게 남자의 고환에서 나오는 호르몬이 전립선 암을 일으키는 것을 확인하였고. 호르몬 치료가 개발되어 전립선 암의 치료로 활용하고 있다[5]. 동물실험에서 확인한 발견을 임상 치료제로 이끌어낸 이들의 발견이 전임상-임상을 연결한 중개연구의 대표적인 사례이며, 호르몬 치료제는 이후에 새로운 형태의 약물인 LHRH가 개발되어 유방암과 전립선 암을 치료할 수 있게 되었다.
방사선치료의 시초는 1896년 독일의 물리학교수인 Wilhelm Conrad Roentgen에 의하여 발견된 ‘잘 모르는 방사선’이라고 하여 명명한 ‘X-ray’로부터 시작한다. X-ray가 발견된 이후로 3년 안에 종양을 치료하기 위한 시도가 시작되었다. 1901년 Roentgen은 첫 번째 노벨상을 받은 물리학자이다. 그는 낮은 수치의 X-ray를 이용하여 인체의 몸을 진단할 수 있는 기계를 개발하였다. 실제로 방사선을 치료에 적용하기 시작한 것은 20세기에 이르러서이다. 방사선이 종양도 유발할 수 있지만, 치료에도 응용할 수 있을 것이라는 경험과 지식이 쌓이고 나서야 치료용 방사선이 개발되기 시작하였다. 이 때 개발된 방사선 치료는 CRT (Conformal radiation therapy)로 원하는 부분에 집중하여 치료가 가능한 장치였고, 이는 CT와 MRI로 암의 위치를 확인함과 동시에 특정한 위치에 방사선을 노출 시킬 수 있는 새로운 기술이었다. 이 이후에 지속적으로 개발된 conformal proton beam radiation therapy, Stereotactic radiosurgery, Intraoperative radiation therapy (IORT) 등은 현재 암 치료에 있어서 중요한 부분을 차지하고 있다[5]. 방사선 치료에 있어서 물리학자의 기초연구가 시초가 되어 임상적 적용이 가능했다는 점에서, 중개의학의 대표적인 시작점이다.
암의 화학적 요법이 시작된 것은 우연히 독성물질을 찾게 된 것이 시작이다. 세계 2차대전, 군함에서 일하는 승무원들이 머스타드가스에 노출이 되면, 골수세포에 큰 독성을 보인다는 것을 알게 되었고. 같은 때에, 미군은 머스타드가스에 대하여 저항하기 위한 다양한 화학물을 연구하기 시작하였다. 이러한 과정에서 질소머스타드(nitrogen mustard)라고 불리는 물질이 혈액암에 효과적이라는 것을 우연하게 발견하게 되었고, 이는 현존하는 화학적요법의 시작이었다. 현재는 alkylating agents로 불리는 화학물로 DNA에 손상을 일으켜 암세포를 죽이는 물질이다. 질소머스타드 개발에 이어 Sidney Farver는 aminopterin를 발견하였는데, 어린아이들의 급성 백혈암에 효과가 있음을 확인하였고, 암세포의 DNA 재조합을 억제한다는 것을 밝혀냈다[5]. 이를 계기로 화학물질이 특정기전에 의하여 종양을 억제한다는 것을 확인함과 동시에 종양의 발생과 특징을 연구하기 위한 연구가 생물학자, 생화학자, 독성학자들에 의하여 꾸준히 진행되어 왔다. 그 후 연구 중에 암을 발생하는 특별한 유전자와 돌연변이들이 밝혀 지기 시작했고, 돌연변이들은 암세포가 지속적으로 분열하는 신호전달에 영향을 준다는 것을 확인하였다. 화학물의 개발과 동시에 분자생물학적인 접근을 통해 개발된 것이 바로 선택적인 신호전달을 저해할 수 있는 표적치료제(targeted therapy)의 개발이다. 표적치료제는 기존의 방사선 치료와 화학적 요법과 같은 비특이적 치료방법과는 달리 적은 부작용과 암을 일으키는 요소에 대한 선택적인 치료가 가능하다는 점에서 주목을 받고 있다. BRAF, EGFR, ALK fusion, JAK, KRAS, HER2, 3 등 다양한 종양 특이적 신호전달 차단 치료제들은 신약개발에 있어서 중요한 타겟으로 주목을 받고 있으며, 이어 기존에 개발된 치료제보다 타겟에 대한 부착성과 2차 돌연변이에 의한 내성기전을 제어할 수 있는 더욱 강력한 표적 치료제들이 개발되고 있다.
더욱이 최근에 개발되어 주목받고 있는 면역치료제는 면역학자와 생물학자들이 지속적으로 연구해왔던 기초연구를 발판으로 개발된 항체형 항암제가 시작이다. 암 억제용 항체 개발은 실제로 1970년도에 시작되었으며, rituximab (Rituxan) 그리고 trastuzumab (Herceptin)이 1990년 미국 FDA에 혈액암과 유방암을 타겟하는 치료제로 허가를 받아 치료에 처음으로 응용되기 시작하였다. 이를 바탕으로 다양한 면역치료제가 개발되기 시작하였다.
암 치료를 위한 수술적 요법은 2세기부터 시작되어 기본적인 치료방법으로 지금도 행해져 왔고, 당시 2세기에는 과학자, 의사, 수학자 등 학문이 구분되지 않았던 시기였다. 이후 17세기 이후 과학과 의술이 발달하면서 학문이 구분되고 경계되었던 시점을 근거로 하여 물리학, 화학, 생물학 등 다양한 지식이 축적되고 응용되어 왔다. 특히 의학적인 응용에 있어서, 앞서 설명한 몇몇의 역사적인 발견들은 암 치료에 있어서 우리의 삶의 질을 바꾸어 놓았다. 토끼 실험을 통해 시작된 호르몬 치료, 영상의학과 방사선치료를 이끌어낸 물리학자, 머스타드가스에 대한 독성연구를 통해 우연하게 발견한 화학적 요법 치료제, 분자생물학과 면역학을 토대로 하여 발견한 표적치료제와 면역치료제는 지금도 환자를 치료하는데 활용하고 있다. 이러한 발견은 끊임없는 질문을 통한 기초연구와 임상연구의 결합체이다. 이 결합은 중개연구로서 환자의 생명연장과 삶의 질을 높이는데 중요한 역할을 한다.
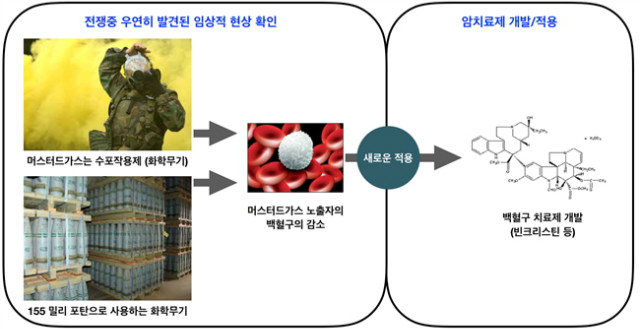
그림 1. 인류 최초의 chemotherapy의 시작은 ‘전쟁 중 우연한 발견’에서.
4. 신약개발을 위한 전, 임상연구 플렛폼
기본적으로 신약개발은 크게, 전임상연구와 임상연구로 나뉘어 진행이 되어왔고, 특히 전임상연구를 위한 연구는 세포실험(in vitro), 동물실험(in vivo), 컴퓨터를 이용한 실험(in silico) 등으로 나뉘어 진행되어 왔다.
4.1 In vitro 모델
In vitro, 라틴어로 시험관이라는 의미를 갖는 이 단어는 시험관 연구(test-tube experiment)의 의미를 가지고 현재 과학분야에서 사용하고 있다. 신약개발을 시험관에서 수행하는 시작점은 세포배양에서부터 시작된다. 인류최초의 암세포인 헬라세포(HeLa)는 1951년 Henrietta의 자궁경부암 환자의 세포에서 유래하였으며, 암세포를 배양하여 연구할 수 있다는 점에서 큰 의미를 가지는 세포이다[6]. 이 세포를 신약개발에 활용한다는 것은 암 연구 및 소아마비 백신 개발을 하는 것 만큼이나 상당히 중요한 의미를 가진다. 암세포는 암세포만의 고유 특징이 있으며, 항암제에 노출되었을 때 이러한 특징들로 인한 반응은 임상에 적용되었을 때의 효과를 반영하기 때문이다. 암연구에 있어서 in vitro 실험의 장점은 1) 낮은 비용으로 약물에 대한 스크리닝이 가능하다는 점이며, 2) 약물에 대한 항암효과뿐만 아니라, intravasation, extravasation, angiogenesis, matrix 모델과 cell dormancy에 대한 실험이 모두 가능하다는 점이다. 추가적으로 최근 3D 세포배양과 조직공학 등이 발달하면서 다양한 in vitro 모델이 개발되었으며, 이로써 비용과 노동력이 많이 드는 동물모델을 일부 대체할 수 있게 되었다. 필자는 in vitro 모델에 있어서 상업화된 세포주 모델, 환자유래 암세포모델, Ba/F3를 이용한 돌연변이 모델, 3D 배양을 이용한 오가노이드 및 스피어 모델을 소개하도록 하겠다.
4.1.1 상업화된 세포주 모델과 세포주 백과사전(CCLE)
상업화된 암세포는 ATCC나 KCLB 등에서 쉽게 구입이 가능하다. 이미 논문으로 검증된 세포주를 포함하여, 최근 다양한 리포터유전자가 삽입되거나, 혹은 필요에 의하여 특정 유전자를 과발현 혹은 억제하는 형태의 세포주 등을 통하여 연구를 많이 하고 있다. 2012년 노바티스에서는 현재 존재하는 대부분의 암세포 >1000개의 암 세포주를 이용하여, 다양한 inhibitor에 대한 IC50, SNP array, microarray (mRNA)에 대한 분석을 수행하여 연구자들이 특정사이트에서 응용이 가능하도록 제공하고 있다(CCLE: https://portals. Broadinstitute.org/ccle/data).
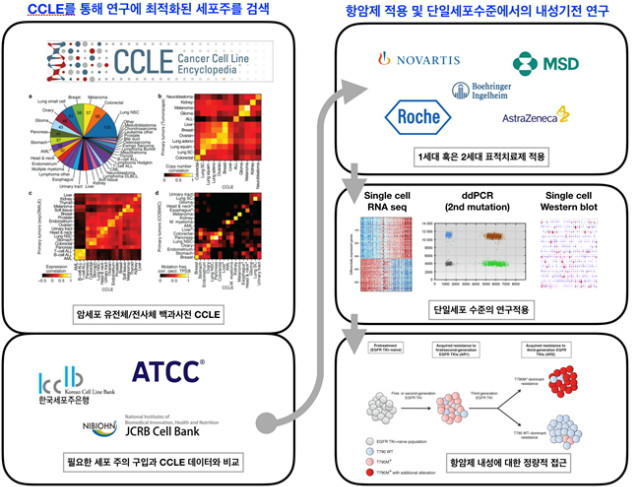
그림 2. CCLE를 활용한 최적화된 세포주 모델의 적용과 활용.
4.1.2 환자유래 암세포(CRC: conditional reprogrammed cell) 모델
최근 약물에 대한 내성을 가지는 종양들이 지속적으로 보고되고 있으며, 이에 대한 해결책을 위해서는 약물 내성을 가지는 종양유래 세포주를 이용한 기전연구가 필요하다. 이러한 세포주는 신약개발에 있어서 내성을 극복할 수 있는 가능성을 열어준다. 앞으로 개발되는 대부분의 신약들도 추후 내성을 가질 수 있기 때문에, 약물 내성을 갖는 환자 유래 세포는 필수적이다. 환자유래 암세포는 수술장에서 확보되는 암 조직과, 생검조직 그리고 암조직에서 유래된 effusion과 혈액 내에 존재하는 circulating tumor cell (CTC)를 통하여 환자유래 암세포를 확보한다[7]. 확보되는 조직의 상태와, 암조직과 정상조직의 비율, 그리고 암의 종류에 따라 배양 성공률에는 차이가 있다. 초기에는 시험관에서 자라는데 어려움이 있어 다양한 growth factor 들어간 배지에 feeder cell과 함께 배양을 하며, 지속적으로 계대수가 늘어남에 따라서 fibroblast (feeder cell)의 특정 growth factor의 의존성이 감소됨과 동시에 안정화가 유지된다. 안정화가 유지된 세포 안에서도 heterogeneity가 존재하며 이러한 점을 검증하기 위하여 다양한 분석방법이 적용된다. 폐암의 경우 TTF-1, p63의 비율을 FACS로 측정하는 방법, 세포의 형태와 군집을 확인하는 방법과 더불어, 암세포에서 발견되는 특정한 돌연변이들은 ddPCR을 이용하여 단일세포수준에서의 heterogeneity를 정량화 한다[8]. 환자유래 암세포 모델을 구축하기 위해서는 임상적으로 환자유래 샘플을 지속적으로 공급을 받음과 동시에 숙련된 연구원들의 집중력과 세포주의 분석능력이 필수적이다. 또한 구축된 세포주에 대한 관리 또한 상당히 중요한 요인 중 한가지이다.
환자유래 암세포는 단순히 실험에 활용하기 위한 일반 세포주와는 별개로, 환자에 대한 치료방법과, 최근 NGS를 이용하여 WES를 통해 CNV, SNV, oncogenic mutation의 정보와 더불어, RNA seq 등이 포함되어 이용되는 경우가 많다. 더불어 약물 처리 전, Pre조직과 처리 후의 Post 조직(항암제 내성획득) 각각의 세포주가 생산되는 경우 활용도가 더욱 높다. 또한 환자유래 암세포는 NOG나 NOD 마우스에 이식되어 동물실험을 통한 효능평가를 수행한다.
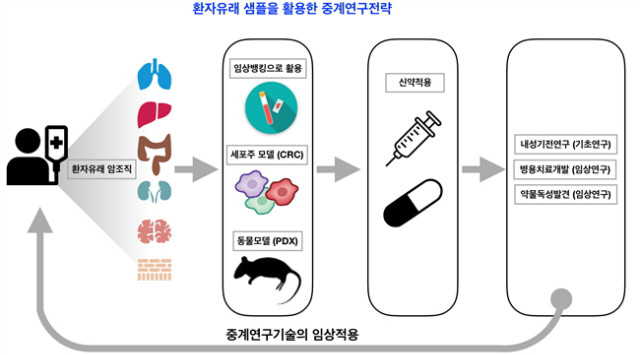
그림 3. 환자유래 샘플을 활용한 중계연구전략.
4.1.3 암유전자 삽입 Ba/F3 세포주 모델
EGFR 및 ALK, BRAF 등 다양한 돌연변이 유래 암세포의 경우에는 표적치료제가 개발되어 활용하고 있다[9]. 임상에서는 이러한 암세포에 대한 내성들이 보고되고 있다. 특히 타겟되는 단백질의 아미노산이 치환되는 2차 돌연변이들이 약물에 대한 내성을 유발 시킨다. 2차 돌연변이에 대한 신약의 효능을 확인하기 위해서 많이 사용하는 세포주 모델이 Ba/F3 세포주이다. Ba/F3는 마우스 B림프구 혈액암이다. IL-3에 대한 의존성으로 세포분열을 하기 때문에 IL-3이 없는 조건에서는 세포가 사멸하게 된다. Oncogene인 EGFR이나 ALK, KRAS 등이 삽입되면서 IL-3에 대한 의존성이 없어도 삽입된 oncogene에 대해서만 의존성을 가지게 된다[9]. 따라서 세포주에 대한 selection도 쉽고, 약물에 의한 억제효과를 쉽게 확인할 수 있다. 뿐만 아니라 부유세포이기 때문에 부착성 세포보다 기계를 이용한 자동화 공정에서 약물을 스크리닝 하는데 쉽다는 장점이 있다. Ba/F3 세포를 개별적으로 실험실에서 생산할 수도 있고, 최근 다양한 플렛폼 회사에서 구축해주는 서비스가 가능하다. EGFR 돌연변이나 ALK-fusion 유전자와 이들 유전자에 2차 돌연변이가 들어가 있는 세포주는 온라인에서 손쉽게 구입할 수 있어 신약개발을 하는데, 도움이 되고 있다.
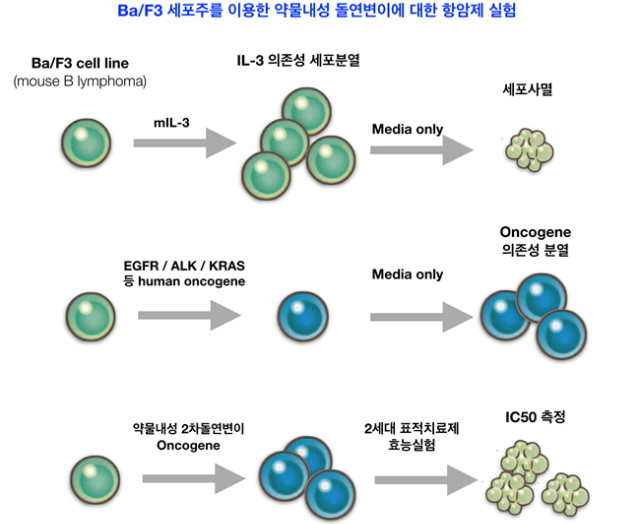
그림 4. Ba/F3 세포주를 이용한 약물내성 돌연변이에 대한 항암제 적용/실험.
4.1.4 오가노이드/스피어 모델
오가노이드(organoid)는 장기의 ‘organ’와 ‘~와 같은’의 의미를 가진 ‘-oid’의 파생어로서 ‘장기와 유사한 기관’을 의미한다. 생성되는 크기나 형태로 보아 기관보다는 조직에 가깝지만, 그 형태가 3차 구조를 가지고 있어 기능적인 부분에 있어 2차 평면의 배양된 암세포보다는 좀더 생체에 가까운 모델이다. 암조직의 경우에도 단순히 암세포만 존재하는 것이 아니라, 암세포와 stroma 조직이 섞여있어 종양미세환경을 좀더 가깝게 유지된다는 의미에서 ‘오가노이드’로 볼 수 있다[10, 11].
오가노이드를 암연구에 적용하는데 있어 현재는 2가지로 재구분이 된다. 기존에는 2차 배양과 3차 배양을 구분지었다면, 현재는 3차 구조를 유지 시킬 수 있는 스케폴드나, 미세유체 시스템을 적용하여, 장기수준의 상호작용을 다룰 수 있다는 점에서 보다 인체에 유사한 시스템이다. 오가노이드 시스템에 대한 장점에 대하여 요약하면, 1) in vivo와 유사한 3차 구조를 제공함으로써, 종양의 유전자 발현과 단백질 발현에 대한 패턴이 생체구조와 유사하다. 2) 세포-세포외 기질의 상호작용 연구가 가능하다. 3) 2차 평면배양이 어려웠던 환자유래 암세포를 좀더 잘 배양할 수 있다.
하지만 오가노이드를 배양하고, 항암제를 이용하여 충분한 정보를 얻기 위해서 정량적인 분석이 가능한 이미징 시스템이나, 고정밀 분석 시스템이 필요하며 일반 세포주를 배양하는 방법과는 달리 운용상 숙련도가 필수적이다. 또한 배양방법에 대한 SOP화는 반복실험에서도 동일한 결과를 확보할 수 있는 중요한 지표가 될 것이다.
오가노이드를 분석할 수 있는 방법으로 confocal microscope가 많이 활용된다. Z-stack 분석은 오가노이드를 단층적으로 이미징, 타겟에 대한 형광을 정량화 할 수 있는 방법으로, 오가노이드 정량적 정보화 기술 중 한 가지다. 또한 오가노이드를 구성하는 세포들 가운데 암세포의 heterogeneity를 분석하기 위해서는 기존에 많이 사용하던 FACS와 single cell western blot를 포함하여 single cell NGS 기술 등을 적용할 수 있다.
최근 2016년 미국암학회 AACR에서 동물과 환자의 종양으로부터 오가노이드를 만들었으며, 오가노이드에 직접적으로 항체치료제를 적용하였을 때, 오가노이드에 존재하는 면역세포가 암세포를 타겟하여 공격하고 이를 정량적으로 검증한 결과를 하버드대학교의 다나암 연구소에서 2017년 AACR 학회에 포스터로 발표하였다.
4.2 In vitro 분석 플렛폼
앞서 언급하였던 세포주와 환자유래 암세포주, 그리고 오가노이드에 이르기까지. 다양한 재료와 신약을 통해 많은 데이터를 확보할 수 있다. 가장 기본적인 암세포의 proliferation test, 세포주기 분석, apoptosis 분석, cell migration 실험 등 다양한 방법 등은 이미 잘 알려져 있다. 과거와 현재, 실험방법의 큰 차이라고 하는 것은 암세포가 가지고 있는 특징 중 heterogeneity를 분석하는 방법이다. 암세포가 분열 하면서 나타나는 heterogeneity는 최근 Nature논문의 동영상에도 게재되었다(https://www.nature.com/). 세포들의 pool을 이용하여 분석하는 western blot, real-time PCR이 단일세포 수준 분석기술과 함께 적용된다면, 기전연구에 상당히 도움이 될 수 있다. 단일세포 수준에서의 분석으로는 가능한 분석방법은 flow cytometry가 일반적이다. 세포 하나하나를 관을 통과하여 레이져를 통해 크기와 타겟하는 형광의 발현을 측정하여 spot으로 나타내는 기술은 단순히 면역세포의 표면에 존재하는 단백질 이외에도, 분자생물학의 영역인 신호전달물질에도 적용됨으로써 pEGFR, pAKT 등 다양한 신호전달 단백질을 가능케 하였다. 이 방법은 두 가지 이상의 분자 신호를 비교할 수 있다. 이외에도 mRNA도 단일세포수준으로 분석이 가능한 ddPCR, single cell 수준의 western blot. 그리고 최근 주목을 받고 있는 단일세포 NGS에 대한 소개를 시작으로 신기술을 소개하겠다.
4.2.1 단일세포 NGS를 이용한 오믹스 분석
단일세포 NSG는 single cell PCR를 수행하였던 세대에 비하여, 획기적 기술임에 틀림이 없다. 필자의 박사과정 동기는 당시 96 well plate 수십 장을 들고 다니며, 실험실마다 가용한 PCR 기계를 빌리러 다녔던 기억이 있다. 친구의 말대로라면, 시간과 비용은 천문학적이었으며, 결국 PCR로 보고자 하는 결과를 얻지 못하였다고 들어 안타까움을 금치 못하였던 적이 있었다. 지금 그 친구가 학위 중이었다면, 단일세포 NSG를 소개하고 싶다. 단일세포 NGS는 말그대로 단일세포 수준에서 DNA, mRNA를 분석하는 것이다. 단일 세포 NGS를 잘 활용한 예들을 살펴보면, 항암제 내성을 가진 암세포에서 어떠한 획득 내성기전을 가지는지에 대한 전체 세포 pool의 비율적인 정량이 가능하다는 점이다. EGFR 돌연변이를 가진 암환자 유래 세포주에 EGFR-TKI로 암을 억제하였을 때, EGFR kinase 영역에 돌연변이를 가지는 암세포, 우회기전을 통해 다른 oncogene의 number를 증가시키는 암세포, 혹은 최근 dormancy tumor와 같이 죽지는 않지만 동면을 하는 것과 같이 존재하는 암세포 등으로 발달하게 되는데, 내성을 가진 암세포의 개별적인 유전체와 전사체를 정량화 할 수 있다는 점이다[12]. Single cell RNA seq에 대한 기술발전은 2009년 전후로로 시작되었다(https://hemberg-lab.github.io/scRNA.seq.course/introduction-to-single-cell-rna-seq.html). 단일세포를 이용한 RNA seq 등의 기술은 수작업방식으로 시작하여 세포 바코딩 시스템까지 비약적으로 발전하였다. 결국 single cell seq의 기술이라고 한다면, 세포 하나하나를 분석하기 단일세포 수준 분주 기술이 중심이라고 할 수 있겠다. 분석방법 또한 바이오인포메틱스 툴이 발전하면서, 분석방법들도 다양해졌으며, 관련 업계도 단일세포 sequencing 기술 등을 축적하고 있는 중이다.
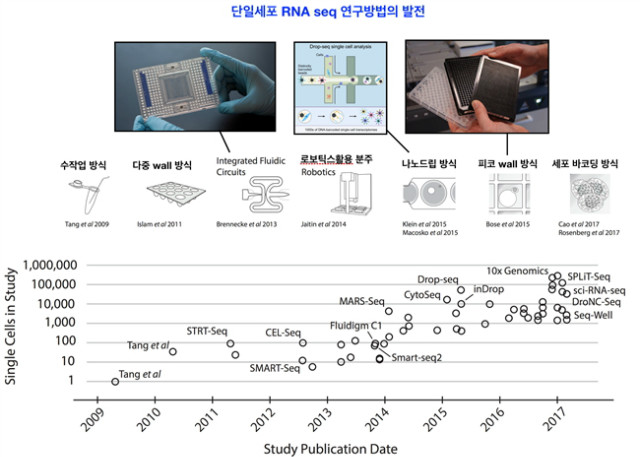
그림 5. 단일세포 RNA seq 연구방법/기술의 발전사.
4.2.2 ddPCR을 활용한 단일세포 수준의 PCR
이미 잘 보고된 2차 돌연변이, oncogene number의 증가, 특정 유전자의 발현도 등을 단일 세포 수준에서 비교를 해보고 싶다면 단일세포 NGS 분석만큼이나 분석능이 좋은 ddPCR를 추천한다. ddPCR은 상업명이다. Droplet Disgital polymerase chain reaction (ddPCR™)은 BioRAD가 가지고 있는 특허기술로 QX100, QX200기기를 이용하여 분석을 한다. 기술에 대한 내용을 간단히 요약하면, 단일세포 수준에서의 RNA나 DNA의 양을 각각의 방울 속에 real time PCR용 probe, primer 을 넣어주어 PCR 과정을 거친 뒤, flow cytometry와 같이 각각의 방울의 형광을 읽어서 정량화 및 각각의 방울들에 대한 발현도를 dot으로 표현한다. ddPCR을 잘 활용하는 예로 EGFR 종양을 가진 폐암의 경우 EGFR-TKI의 장기간 처리에 의하여 내성이 생기는데, 특히 EGFR의 kinase 영역에 L858R, C797S와 같은 돌연변이가 생긴다. 2차 돌연변이에 대한 분포 등을 ddPCR을 통하여 정량화 하여 나타낼 수 있다는 점이 장점이다[13].
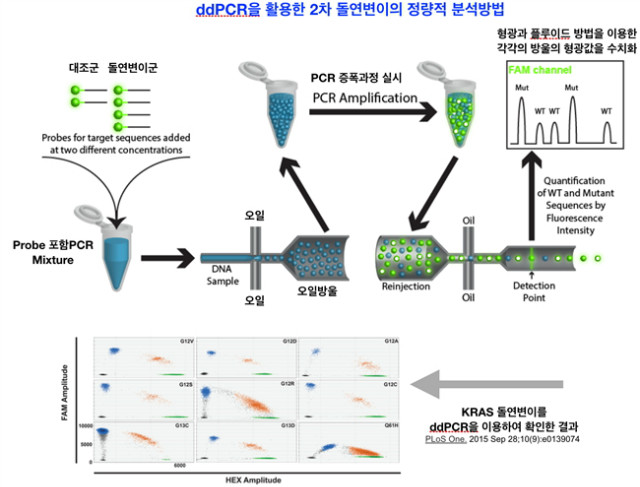
그림 6. ddPCR은 단일세포 수준에서 암세포의 돌연변이를 정량화 할 수 있는 장비.
4.2.3 단일세포 western blot (scWesterns)
2014년 nature지에서 소개된 single-cell western blot은 약 1,000개의 단일세포를 30 um 두께의 플렛폼에 넣어 lysis, electrophoresis, blotting까지 일련의 과정을 수행하고, 스케너에서 분석하여 결과를 확보할 수 있는 신기술이다. 최소 세포 200개까지 분석을 할 수 있다. 이는 단일세포 NGS에서 확인하기 어려운 최종 인산화된 단백질의 형태를 정량화 하여 읽을 수 있다는 점에서 상당히 큰 장점이다[14].
4.2.4 FACS를 이용한 single cell 수준의 신호전달 분석
단일 세포 수준의 분석에 있어서 flow cytometry가 일반적으로 사용하는 방법이다. 복잡성이 높은 단백질의 발현을 현재 개발된 다양한 항체로 핵 내부에 있는 단백질도 분석이 가능하다. 최근에는 인산화된 형태의 단백질을 핵, 세포질, 세포 표면에 이르기까지, 볼 수 있다는 장점과 동시에, 두 가지 이상의 인산화 단백질을 단일세포 수준에서 분석이 가능하므로 co-expression 여부를 확인할 수 있다. 동시에 apoptosis 등 다양한 분석을 동시에 수행하면서 표면인자까지 한번에 최대 15가지 정도를 확인할 수 있다(Flow cytometry의 기기 지원 요소에 따라 다름). 다른 장점을 말하자면 면역세포와 암세포의 co-culture를 수행하고, 암세포와 면역세포 각각에서 나타나는 반응을 flow cytometry로 분석이 가능하다. 예를 들어 대식세포와 암세포를 같이 배양을 한 뒤 암세포의 proliferation에 어떠한 반응이 있는지를 알아보기 위해서, 대식세포의 표면인자인 F4/80 음성인 세포에서의 BrdU를 통해 세포의 분열을 확인할 수 있음과 동시에 세포분열에 관련된 신호전달 인자의 발현이 증가되는지 등을 인산화 된 신호전달 인자와 함께 확인이 가능하다.
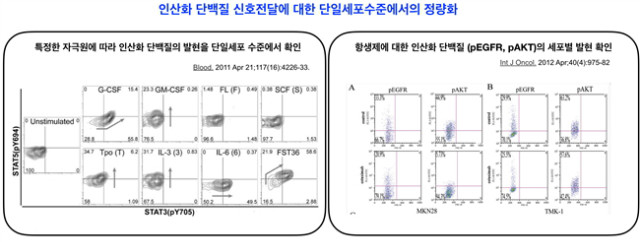
그림 7. 인산화 단백질 신호전달에 대한 단일세포수준에서의 정량화.
4.3 In vivo 모델
앞서 설명하였던 in vitro 모델을 통해 ‘스크리닝’, ‘세포 수준의 기전 연구’가 되었다면, 이를 토대로 하여 in vivo 동물 모델을 통해 임상연구를 위한 다양한 연구도 필요하다. 암 연구에 있어서 동물모델은 동종이식 모델과 이종이식 모델이 존재한다. 동종이식 마우스 종양모델은 마우스에서 유래된 종양을 같은 종에 이식함으로써, 이에 다양한 항암제를 처리하고, 종양크기와 독성 등을 확인하는 기본적인 방법이다. 최근 특정한 신호전달 물질을 타겟하는 표적치료제가 개발되면서, 신약이 타겟하는 단백질을 주로 발현하는 인체유래 암세포주나 환자유래 종양을 면역결핍 마우스에 이식하여 새로운 항암제나 병용요법 등에 대한 효과를 확인하고 있다. 환자 유래 종양을 가지는 모델을 환자의 종양의 성격을 가지기 때문에 ‘아바타 마우스’라고 부르지만, 최근 개발되는 면역치료제는 인체의 면역세포를 타겟하기 때문에 좀더 독특한 동물 모델이 필요하다.
4.3.1 동종이식 마우스종양모델(Syngeneic mouse model)
동종이식 마우스 종양모델의 장점은 마우스의 면역 반응이 제거되지 않은 정상적인 상태에서 종양에 대한 면역 반응을 볼 수 있다. 기존의 연구들에 있어서는 비특이적 타겟을 가지는 화학적 요법과 방사선 요법 등에 대하여 연구가 되어 왔다면, 최근 면역치료제에 대한 연구로 필요한 수단이다[15]. 면역치료제를 적용하기에 앞서서 같은 동종이식모델이라 하더라도, 암세포가 가지고 있는 고유 면역반응에 의한 종양미세환경을 이해해야 한다. 예를 들어 T림프구를 타겟하는 aPD-1 치료제의 경우에는 종양 내에 aPD-1을 가지고 있는 T 림프구 자체가 얼마나 존재하는지가 중요하다. T 림프구 자체가 없는데, aPD-1을 처리한다면 종양에 대한 억제효과가 크지 않을 것이며, M2 대식세포를 타겟하는 CSF-1R의 경우에도 대식세포가 낮은 비율이 유지되는, 종양모델에서는 MOA (mode of action)을 볼 수 없기 때문이다. 따라서, 중개연구를 수행하는 연구소에서 다양한 암종에 대한 면역 프로파일링이 상당히 중요하다. 이러한 기반은 신약(면역치료제)에 대한 적용 가능한 동물모델을 선정하는데 중요한 지표가 될 수 있기 때문이다.
4.3.2 유전자재조합 마우스모델(Transgenic mouse model)
유전자재조합 마우스모델은 특정한 기전을 확인하기 위한 모델 등으로 활용되기도 하지만, 암 연구에 있어서 조직 특이적 암 발현을 위한 방법으로 주로 적용된다. 특히 임상에서 주로 발현되는 주된 특정 돌연변이나 oncogene이 포함되어 있는 종양모델의 경우에는 다양한 신약의 적용에 적용되고 있다[15, 16]. 폐암의 경우 KRAS, EGFR, EML4-ALK, ROS1-fusion 등이 중요한 타겟으로 다양한 치료제가 개발되고 있다[17]. 이러한 oncogene이 폐에서만 발현할 수 있는 조직 특이적 promoter인 SPC나 SSCP 등을 활용하여 인체 폐암 모델을 재현할 수 있다[18]. 이러한 임상적으로 중요한 돌연변이를 가지는 동물들은 중개연구에 있어서 중요한 역할을 한다.
하지만 이러한 동물 모델들도, 암의 발생부위에 따라서 단순히 동물 모델만 가지고 실험이 불가능하다. 예를 들어 폐암의 경우에는 암의 발생과 약물에 대한 효능을 확인하기 위해 이를 분석할 수 있는 이미징 장비가 필수적이며, MRI(T2 이미징) 분석을 통해 임상적인 진단기준을 적용하여 약물에 대한 반응 등을 도출한다.
4.3.3 이종이식 마우스종양모델(Xenograft mouse model)
이종이식 마우스 종양모델에 있어서 환자유래 종양이나, 세포주 등을 이식하여 실험을 수행한다. 주로 이용되는 동물로는 F1에는 NOG, NOD, NSG 마우스 등과 같이 면역세포가 부재된 마우스를 사용하고, 이후 종양의 성장이 안정되는 F2-F5 사이에는 주로 nude mouse를 이용하여 종양을 생성, 이에 적절한 항암제 효과를 확인한다[15, 19]. 이종이식 마우스 모델 가운데 PDX와 같이 환자유래 암조직 이식모델의 경우에는 종양 내 종양미세환경이 잘 유지되어 있는 등의 결과를 볼 수 있다[20, 21]. Stroma 조직의 경우에는 이들은 항암제에 대한 민감도와 내성 등에도 일부 관여하는 것으로 알려져 있으며, 환자가 가지고 있는 특정 돌연변이나, 항암제에 대한 내성기전 등이 환자 유래 종양 조직이나 암세포에 유지가 되어 있으므로[20, 21] 신약이나, 다른 병용치료 요법을 통해 환자에 대한 치료 전략을 확보할 수 있다.
4.3.4 인체면역반영 이종이식 마우스모델
위에서 언급한 PDX모델은 면역치료제를 적용하는데 있어 한계가 존재한다. 특히 인체에 적합한 형태의 항체 치료제 등을 적용하기 위해서는 사람의 면역세포가 필요하다. 최근 NOG, NOD, NSG 마우스는 면역결핍 마우스에 HSC를 이식하여, T 림프구, B 림프구와 항원제시세포를 생산해 낼 수 있다. 면역 아바타 마우스를 이용하여 인체의 면역세포를 타겟하는 치료제와 더불어 환자종양에 대한 항암제의 효능을 확인할 수 있다는 장점이 있다[15, 20].
하지만, 현재 생산되고 있는 humanized mouse에 대한 한계점으로는 T 세포 보다 B세포가 대부분을 차지하고 있으며(>50%), APC의 역할을 하는 대식세포와 수지상세포의 비율이 낮다는 한계가 있다. 이러한 단점을 보완하기 위하여 JAX에서는 SGM3 마우스 등이 개발되어 마우스 내 인체 면역세포의 비율이 보정된 human에 가까운 동물 모델이 생산되고 있다[22].
4.4 In vivo 분석 플렛폼
환자의 유래 종양, 환자의 아바타 종양마우스 모델, 그리고 인간의 면역세포가 포함되어 있는 동물모델에 이르기까지, 동물모델 또한 in vitro 실험의 발전에 못지 않게 상당히 빠르게 개발되고 있는 중이다. 앞서 언급한 모델들은 개발비용과 유지비용이 상당하여, 기초연구에서 활용하기보다는 기업과 연계된 중개연구에서 좀더 활용도가 높다. 특히 암환자로부터 유래된 샘플, 종양세포, 그리고 인체유래 HSC의 이식 등, 임상적으로 연결되어 있는 부분이 상당하다. 따라서 이러한 연구들이 중개연구를 중심으로 개발되는 것이 일반적인 흐름이다. 하지만 단순히 값비싼 동물 모델을 이용하여 종양이 감소되었다는 부분으로는 신약에 대한 평가를 다했다고 할 수 없다. 신약에 대한 효능에 관련된 바이오마커를 확인하기 위한 분석 플렛폼에 대한 적용이 필요하다. 전임상 동물 모델이 임상적으로 가깝기 때문에 다양한 병리조직과 면역세포 등을 확보하여, 환자에게 수행할 수 없었던 심도 있는 면역, 병리, 오믹스 연구 등을 적용할 수 있다. 분석을 보다 효과적으로 수행하기 위하여, 새로 개발된 Vectra 분석장비에 대한 활용과 CyTOF를 이용한 다중 마커 분석 등을 소개하고자 한다.
4.4.1 Vectra 시스템을 이용한 다중형광이미징분석
Vectra 3 혹은 Vectra polaris는 최근 파킨엘머에서 개발된 다중형광 이미징 분석장비로서, whole slide scan 기능을 포함하여 DAPI를 포함한 7가지 형광을 한번에 분석할 수 있는 장비이다. 단순히 ‘찍는다’라는 개념에서 벗어나서, ‘분석한다’의 의미가 큰 분석플렛폼이다[23]. 한번에 80-200개의 조직샘플을 자동화 하여 이미지를 구성하고, 원하는 조직의 위치나, 혹은 원하는 암조직과 기저세포의 비율을 선정하면, 분석장비가 자동으로 최적의 분석 포인트를 확보하여 분석을 하게 된다. 초반에 기계학습을 시키면, 장비에 포함된 분석프로그램이 기계학습 결과를 토대로 하여 자동으로 모든 이미지를 분석하게 된다. 한번에 7가지 바이오마커를 확보할 수 있다는 점에서 암세포, 기저세포, 면역세포에서 확인할 수 있는 특정 타겟발현 패턴을 정량화 하여 분석할 수 있다. Vectra의 다중형광분석 방법으로 암세포는 Pan-CK, 혹은 TTF-1, 혹은 p63 등으로 염색을 하고, CD68은 대식세포, CD3는 T림프구, CD20은 B세포, Foxp3는 Treg으로 각기 달리 염색을 한 뒤, PD-L1의 발현이 암세포에서 확인되는지, 혹은 면역세포에서 나타나는지를 구분할 수 있을 뿐만 아니라, 기저조직과 암조직에 포함되어 있는 면역세포의 비율과 타겟되는 단백질의 발현량, 혹은 Treg과 인접한 CD8+ T 림프구의 거리 등을 분석하는 등 다각적인 차원에서 분석이 가능하다[24, 25].

그림 8. 벡트라 시스템을 이용한 다중형광분석 및 러닝머신을 이용한 조직분석.
4.4.2 CyTOF를 단일 세포 및 병리분석
ICP라는 장비는 단일원소를 분석하는 장비로, 이온플라스마를 이용하여 각각의 원소의 전자가 강력한 에너지를 받았다가, 이를 다시 방출선 형태로 발산하여 이를 분광계를 이용, 미량원소를 확인하는 장치이다. 이를 최근 활용하여, 희귀 원소 36종 이상을 항체 부착한 뒤, 샘플에 binding시킨다. 이후 이온플라스마로 조직이나 세포를 태워버리면서, 미량원소의 스팩트럼을 분석한다. 가능하다면 한번에 36개 이상의 바이오마커를 분석할 수 있을 뿐만 아니라, flow cytometry와 같이 형광에 대한 간섭이 없다는 것이 가장 큰 장점이다[26, 27].
4.5 중개연구를 위한 BI 인프라
신약개발을 하는데 있어서 NGS를 이용한 다양한 오믹스 연구 결과들은 바이오마커의 발굴, 환자군의 분류, 그리고 신약을 타겟하는 돌연변이에 대한 분석 등 다양한 부분에 활용되고 있다[28-30]. 특히 중개연구를 수행하면서, 신약에 대한 추가적인 기전이나, 약물에 대한 획득내성 등을 분석하는데 있어서 바이오인포메틱스는 기본적으로 따라가야 하는 플렛폼이다[30]. 기본적으로 NGS는 돌연변이를 분석할 수 있는 WES, 혹은 암에 대한 특정 돌연변이에 초점을 맞추어 분석할 수 있는 200-500개의 패널을 중심으로 분석하는 captured seq 기술 등이 개발되어 다양한 분야에서 서비스를 하고 있다. 뿐만 아니라 mRNA의 발현을 보기 위한 RNA seq, microRNA나, gene methylation, Chip seq 등 다양한 부분에 sequencing 기술이 적용되고 있다. 최근에는 혈액에 존재하는 cfDNA, ctDNA 등을 확보하여 sequencing을 하는데, 암조직을 생검하는 위험성을 최소화 하면서 신약에 대한 효과를 확인하는 마커로서 활용범위를 넓혀가고 있다. 이제는 중개연구를 수행하는데 있어서 바이오인포메틱스 결과를 잘 활용할 수 있는 인력의 확보도 중요한 부분 중 하나다.
4.6 중개연구를 위한 임상샘플 뱅킹
중개연구에 있어서 임상샘플에 대한 보관과, 이를 관리하는 능력은 상당히 중요하다. 특히 환자유래 혈액이나, PBMC, 종양조직을, 그리고 이로부터 만들어지는 PDX나 CRC를 완벽히 구축하기 위해, 임상과 전임상 팀의 긴밀한 협조와 관리가 이루어져야 한다. 이러한 임상샘플들은 확보와 구축 이외에도 보다 체계적인 연구내용과 방법을 토대로 하여 활용되어야 하기 때문에, 샘플의 장기간 보관이 필수적일 수 있다. 따라서 보관되는 질소탱크, deep freezer의 안정화와 오염방지를 위한 개별적인 보관과 주기적인 마이코플라스마 검사 등은 필수적이다.
5. 중개연구를 위한 플렛폼 적용 전략
중개연구를 위해서 이들 플렛폼을 모두 갖출 수 있다면 신약에 대한 연구를 유기적으로 수행할 수 있다. 신약의 형태가 표적치료제이던, 혹은 면역치료제이던, 최신 플렛폼은 기존에 밝히지 못하였던 약물의 새로운 기전들을 밝힐 수 있을 뿐만 아니라, 연구시간을 최소화 할 수 있고 최적의 병용치료 방법을 제시해 줄 수 있다. 기업 입장에서 신약을 검증하기 위한 플렛폼을 새로 확보하는 것은 상당한 시간과 노력이 필요하므로, 중계연구를 통해 이미 검증된 플렛폼을 적용하는 방법이 가장 효율적인 방법이다. 따라서 중개연구를 수행하는 연구소에서는 이들 플렛폼에 대한 가능성을 확충하는 것과 동시에, 연구를 같이 수행하면서 신약에 대한 효능과 문제점을 같이 해결해 나가기 위한 지속적인 협의 등이 성공적인 신약개발에 중요한 부분이다. 임상-전임상을 같이 수행할 수 있는 최적의 중계연구소를 활용하는 것이 신약개발을 위한 최적의 전략이다.
6. 참고문헌
==> PDF 참조
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향
발간물
- 이슈 보고서 2019 바이오미래유망기술의 이야기 - 제6화 “암 오가노이드 연계 면역세포 치료기술” 편 2019-07-29
- 이슈 보고서 2019 바이오미래유망기술의 이야기 - 제5화 “광의학 치료기술” 편 2019-07-09
- 이슈 보고서 2019 바이오미래유망기술의 이야기 - 제2화 “조직별 면역세포의 세포체 지도” 편 2019-05-16
- 정책/기획보고서 효율적 암 연구개발을 위한 국립암센터기관고유연구사업 성과분석 및 평가 2013-02-22
- 정책/기획보고서 암정복추진연구개발사업 성과분석 및 발전방안 도출을 위한 기획연구 2013-02-22


 pdf_0002884.pdf
pdf_0002884.pdf