기술동향
대식세포를 분류하는 새로운 개념 (대식세포의 발생적 기원과 조직미세환경 그리고 이를 구분 지을 수 있는 새로운 기술들)
- 등록일2018-02-07
- 조회수13071
- 분류기술동향
-
자료발간일
2018-01-23
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#대식세포#조직미세환경
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
대식세포를 분류하는 새로운 개념 (대식세포의 발생적 기원과 조직미세환경
그리고 이를 구분 지을 수 있는 새로운 기술들)
연세대학교 의생명과학부/유한-연세 폐암 중계 연구소 / 표경호
[요약문]
대식세포는 기존의 방법대로라면 M1 혹은 M2로, 2분법적인 방법으로 구분하고 연구를 수행해왔다. 하지만 이러한 방법은 ex vivo 실험에서 구분해왔던 방식으로 in vivo에서 다양하게 분화되는 대식세포를 이해하고 질병과 연계하여 해석하는데 한계점이 있다. 대식세포는 흑, 백으로 나뉘어지는 바둑알이 아니라, 여러 얼굴을 가진 무지개 빛 스펙트럼을 가진 면역세포이다. 이 논문에서는 대식세포의 다차원적인 구분을 언급하고 있다. 대식세포의 발생적 기원에서 시작하여, 각 조직의 내/외적 요인에 의하여 대식세포 활성에 대한 기능적인 부분이 다르다. 이들은 항상성에도 영향을 미치지만, 질병 발생에도 기여한다. 대식세포의 다양한 스펙트럼을 이해하기 위해서는 기존의 방법으로는 어렵다. 최근 개발된 단일세포 수준에서의 연구 기술이 발달하면서, 대식세포의 분화와 기능을 연구할 수 있는 가능성이 열렸다. 본문에서는 분석 방법에 대한 로드맵도 같이 제공을 하면서, 추후 이러한 연구들을 토대로 하여 대식세포에 기인한 다양한 질환들의 연구에 적용이 가능할 수 있음을 시사한다. 대식세포의 다면성 연구들은 추후 암, 자가면역질환 등 다양한 부분에서 새로운 각도의 연구가 진행되는 발판이 될 것이다.
본 자료는 New insights into the multidimensional concept of macrophage ontogeny, activation and function, Nature Immunology 17, 34?40 (2016)의 논문을 한글로 번역, 요약한 자료입니다.
[목 차]
1. 초록
2. 소개
3. 대식세포 활성의 이분법적 해석(Dichotomous concept)
4. 대식세포 활성의 다차원적 모델(The new multidimensional model)
5. 대식세포 활성에 있어서 개체 발생과 조직항상성에 대한 영향
6. 대식세포 활성화의 시공간적인 오차
7. 다차원적 대식세포 활성화에 대한 결과
8. 대식세포활성화를 확인하기 위한 연구방법
9. 결론
1. 초록
유전자의 발현 사이에 어떠한 연관관계가 있는지에 대한 실험이 진행되었다. 예를 들면, 대식세포에 LPS나 R848과 같은 자극으로 유도되는 세포는 이분법적으로 구분되고자 하지만, in vivo에서는 훨씬 다양한 형태의 표현형을 가지게 된다. 따라서 본 연구에 대한 과제는 대식세포가 주어진 환경에서 그들의 기능을 반영할 수 있는 표현형을 분류하는 것이다. 대식세포는 병원체로부터의 방어의 역할과 조직의 발달, 항상성 등 다양한 역할을 수행한다. 대식세포에 이상이 있을 때 염증 등과 같은 질병을 일으키게 된다. 대식세포에 대하여 다양한 연구가 되었지만, 아직도 대식세포의 발달과 기능에 대하여 밝혀지지 않은 부분들이 상당하다. 생명체의 발달과정에서 대식세포는 조직의 미세환경에 대한 신호를 받아 활성화되고 분화된다. 질병과 항상성 등에 관여하는 대식세포의 발달과 활성화 등에 영향을 미친다. 이 논문에서는 개체 발생 과정에 있어서 대식세포 활성화와 기능에 있어서 다차원적인 개념에 대하여 설명 하고자 한다. 또한 과학기술의 향상에 따라 대식세포를 연구할 수 있는 새로운 로드맵(Roadmap)에 대해서도 소개할 예정이다.
2. 소개
대식세포는 조직의 분화, 항상성 그리고 염증에 있어서 중요한 역할을 하지만, 다양한 범위의 염증과 관련된 중요한 치료 타겟이 된다. 하지만, 대식세포를 치료에 대한 표적으로 주목하기 전에 염증 환경에 대한 조절기능에 대해서 잘 알아야 되는 것뿐만 아니라, 대식세포의 기원과 활성화를 유도하는 메커니즘에 대해서도 심도 있는 통찰력이 필요하다. 과거 대식세포의 활성화에 대한 연구는 이분법에 대한 부분으로(Classical & alternative) 나뉘어 in vitro에서 연구가 되어왔다. 그러나, 이러한 시나리오는 과거에 비하여 최근에 들어서 좀 더 복잡하게 변화되었다. 이는 특히 동물실험(in vivo)를 통해서, 다양한 종류의 대식세포가 있다는 것을 알 게 되었으며, 이러한 대식세포가 질병에 있어서 특정한 역할을 한다는 것이다. 대식세포는 조직특이적인 표현형을 가지고 있고, 각각의 대식세포는 전사체와 후성유전체에 대한 차이가 있다는 것을 최근의 연구를 통해 밝혀지게 되었다. 우리는 대식세포의 기원과 활성에 대한 부분을 목적으로, 고해상도의 분석기술을 적용하여 이를 확인하였고, 임상과 전임상 연구에서 단일세포와 조직 수준에서의 분석을 수행하였다. 최종적으로 이러한 기초연구를 토대로 하여 단핵구와 대식세포를 타겟으로 하는 치료 전략으로 응용이 가능할 것으로 보인다.
3. 대식세포 활성의 이분법적 해석(Dichotomous concept)
대식세포의 큰 특징은 주변 환경의 자극에 따라서 ‘맞춤화’가 가능하다는 점이다. 대식세포가 병원균을 만나게 되면, 다양한 사이토카인과 ROS 등을 생산하여 병원체를 사멸시키는 방어 형태가 되며, 반대로 복구에 대한 신호를 내면, 대식세포는 주변 조직 등에 대하여 조직의 복구와 회복에 주요한 역할을 수행한다. 대식세포는 한 가지 표현형이 아닌 동적인 표현형을 통해 주변의 환경에 적응해 나가며, 이는 기능적 다양성으로의 특징에도 기인할 수 있다.
대식세포에게 LPS나 IFN-gamma와 같은 염증성 자극을 주게 되면 Th1의 활성화를 유도하며, 항박테리아를 위한 염증성 대식세포의 형태를 띠게 된다. 이러한 반응들은 소위 ‘classically activa-tion’이라고 부른다. 이와 반대로 대식세포에 IL-4, IL-13에 의한 자극은 대식세포를 ‘alternative acti-vation’을 유도하며, 사이토카인의 발현 감소, 아르기닌의 발현에 특이적 대사와 주변 청소에 관련된 표면 인자의 발현과 대식 기능의 향상 등이 여기에 포함된다. 마우스의 strain에 따라서 대식세포에 대한 활성에 차이가 있다. 예를 들면 in vitro 실험에서 C57BL/6 마우스의 대식세포에 LPS에 의하여 자극을 받았을 때 NO (nitric oxide)를 생산하기 위한 아르기닌 대사가 활성화가 되어 Th1 반응이 강하게 나타나는 반면, BALB/c mouse의 경우에는 Th2 반응으로 활성화 되기 때문이다. 대식세포에서 이러한 반응은 M1 혹은 M2 반응으로 설명이 되며, 이는 곧 Th1과 Th2 반응에 연관된다. M1 대식세포는 LPS와 IFN-gamma에 의하여 자극이 되고, M2 대식세포는 IL-4, IL-13, IL-10에 의하여 활성화가 되는 형태로, 이들 두 그룹은 기능적인 특성과 표현성으로 나뉘어 진다. 하지만. In vitro에서 M2 대식세포는 항 염증 자극에 따라 미묘하게 차이가 나뉘어지게 된다. M2 대식세포는 IL-4, IL-13에 의하여 유도되는 M2a, IL-10에 의하여 유도되는 M2b, LPS와 면역 복합체에 의하여 유도되는 M2c로 나뉜다. 이들은 기능적으로도 분류되어 설명된다. 새로운 기술로 대식세포의 활성화와 복잡성을 확인할 수 있는 새로운 기술을 토대로 앞서 대식세포를 몇몇의 특정 세포로 고정하여 분류하는 방법을 개선할 수 있을 것으로 보인다.
4. 대식세포 활성의 다차원적 모델(The new multidimensional model)
약 10년전 in vitro에서 자극된 대식세포의 전사체 연구는 종양과 지방세포 그리고 기생충의 감염에서 시작되었다. 이러한 연구를 통해 M1-M2의 이분법적 분류를 지지하는 결과들이 되었다. 하지만, 대식세포는 다양한 항상성 혹은 병리학적인 조건에 의하여 M1, M2 표현형으로 완벽하게 구분되어지지 않는다. 예를 들면, 배아 대식세포(embryonic macrophages), rMs* (resolution-phase macrophages), 그리고 몇몇의 종양에서 분리된 대식세포의 경우가 그렇다. 또한, 질병의 진행 정도에 따라서도 대식세포의 표현형이 달라지는 형상을 보인다. 따라서 대식세포를 M1과 M2로 이분화 하여 설명 하는 것이 불충분한 부분이 있다. 대식세포를 해석하는 새로운 방향을 위해서는 다각적인 차원에서 구분이 필요하다. 이러한 방법은 대식세포가 미세환경노출에 대한 신호에 의하여 활성화되는 모델로 ‘그림 1’에 설명하고 있다. 본 논문에서 소개되는 소위 고해상도 적용(higher-resolution approach)은 최근 human 대식세포 연구에 적용되었던 방법으로 28가지의 각각 다른 조건에서의 대식세포 활성화를 통해 M1과 M2의 이분법적인 방법으로 해석이 안 된다는 것을 밝혀냈다. 마찬가지로 마우스에서는 7가지 서로 다른 조직에서 조직특이적인 대식세포가 확인되는 것을 전사체와 후성유전체에 대한 연구를 통해 확인하였다. 이는 대식세포의 활성화, 표현형, 세포의 기능적인 부분들이 서로 다른 조직에서 미세환경에 의하여 프로그래밍 될 수 있다는 것을 뒷받침한다. 이에 앞서서 in vitro에서 대식세포의 자극과 유전자의 발현 사이에 어떠한 연관 관계가 있는지에 대한 실험이 진행되었다. 예를 들면, 대식세포에 LPS나 R848과 같은 자극으로 유도되는 세포는 이분법적으로 구분되고자 하지만, in vivo에서는 훨씬 다양한 형태의 표현형을 가지게 된다. 따라서 본 연구에 대한 과제는 대식세포가 주어진 환경에서 그들의 기능을 반영할 수 있는 표현형을 분류하는 것이다.
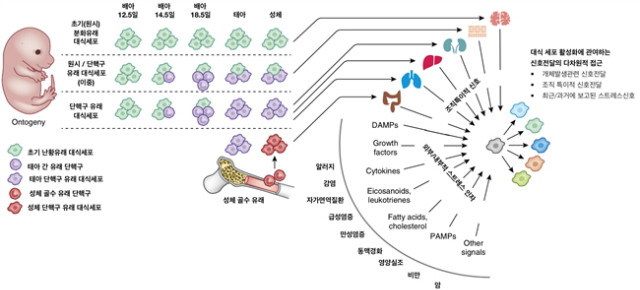
그림 1. 대식세포의 활성에 대한 다차원적인 모델: 다차원적인 모델에서 구분되는 대식세포의 개체 발생적 조건, 각 기관별 미세 환경과 다양한 스트레스 신호전달 요소들은 대식세포의 활성에 대한 반응을 조절한다. 대식세포의 활성은 기본적으로 발생의 기원에 따라 다르며, 조직 내에서도 다양한 요소에 노출됨에 따라서 그 기능적인 부분과 항상성에 영향을 준다.
5. 대식세포 활성에 있어서 개체 발생과 조직항상성에 대한 영향
대식세포의 활성에 대한 연구만큼이나 개체 발생과 항상성과의 연관성에 대한 연구는 빠르게 진전되어 왔다. 1968년 Van Futh에 의한 단핵 식세포의 기초적인 이론(monocuclear phagocyte system concept)은 조직에 상주하고 있는 대식세포의 항상성은 혈액내의 단핵구(monocyte)의 결집에 의존한다는 부분으로 시작하였다. 하지만, 우리는 단핵구가 실질적으로 조직 내 대식세포에 기여하지 않는다는 것을 확인하였다(단, 위와 피부, 심장의 경우에는 단핵구가 지속적으로 침윤하여 대식 세포로 분화하여 역할을 한다). 이는 특정한 염증 상태에서도, 성인의 조직 내 상주하고 있는 대식세포는 단핵구 유래가 아닌, 이는 초기 배아상태에서 조직으로 침윤된 대식세포에서 기인한다.
각각 다른 조직에서의 대식세포 개체군은 전구배아세포의 발생 중에 같은 조직으로부터 기인할 필요가 없다(그림 1). 난황적혈구 전구세포(EMPs)는 최근 난황대식세포와 태아 유래 단핵구의 배아 전구체로 확인되었다. 두 가지의 순차적인 자극이 확인되었는데, 초기 난황에서 단핵구의 초기 형태가 아닌, 대식세포의 초기형태(c-Myb 비의존성), 그리고 후기의 c-Myb에 의한 자극은 태아의 간에서 단핵구를 다양한 형태의 면역세포계열로 분화시킬 수 있다. 그러나 태아 단핵구의 정확한 기원에 대해서는 아직 논란의 여지가 있으며, 이는 최근에 EMP보다도 조혈모세포에 의하여 유래될 수 있다는 연구가 가장 유력하게 기여한다는 연구가 있다. 그럼에도 불구하고 태아 단핵구는 태아조직으로 이동 된 후에 대식 세포로 분화한다. 그러므로 원래의 ‘단핵구 유래 분화(monocyte seeding)’와는 다른 방식으로 대식세포의 개체군은 조혈모세포에 독립적으로 난황과 태아 간의 배아전구체에 의해 영향을 받아 분화한다.
대식세포는 초기태아에서 성체가 되는 발달 과정의 모든 조직에서 분화를 하여 존재한다. 이러한 점은 태아대식세포가 아마도 조직의 항상성 유지와 발달에 연관성이 있음을 보여주는데, 이와 연관하여, 태아 대식세포가 없는 상태나 혹은 대식세포의 기능이 고장이 나 있는 상태에서 폐나 뇌의 발달에 대한 기능과 분화가 비정상적으로 되는 것을 볼 수 있다. 이러한 현상은 조직미세환경과 대식세포분화와의 관계가 대식세포의 활성화뿐만 아니라, 조직 분화에 필수적임을 보여준다. 외부적 환경에 의한 조직 대식세포 분화신호의 교란은 태아에게 다양한 질병 발생의 영향에 놓여 성인 시기에 질병 발생의 원인이 되기도 한다. 예를 들어, 뇌의 microglia는 뇌에 상주하는 대식세포로서 대부분의 난황 유래의 대식세포로 구성이 되어 있고, 이는 다양한 형태의 뇌 신경정신적인 질환에 영향을 준다. 정신분열증과 자폐증, 강박장애를 포함한 몇몇의 질환들은 뇌의 발달장애와 연관이 있으며, 이는 초기 성인기나 청소년기에 나타날 수 있다. 이러한 질환들은 대뇌 발달과 함께 microglial 세포의 기능 불 활성화와 연관이 있다고 보고되었다. 따라서, 조직 안에서의 대식세포의 분화 및 활성화에 대한 더 확실한 분석을 위하여 다차원 모델의 필요성이 대두된다 (그림 1). 동적인 태아 대식세포의 분화와 병행하여, 조직의 성숙과 대식세포 활성화 획득의 기초가 되는 분자 경로를 밝히는 것이 추후 치료 등의 목적으로 활용하는데 중요한 기반이 된다. 또 다른 문제는 대식세포 생물학에서 배아 혹은 성체 기원 조직에서의 기능과 활성화가 어떠한 영향을 미치는 지에 대한 여부를 판단하는 것이다. 다시 말해, 개별적인 개체발생 대식세포는 조직의 특정 항상성 기능에 연관이 있을 수 있다. 이는 기관에 존재하는 대식세포가 각 기관에서 조직의 복구와 항상성 유지에 있어서 어떠한 역할을 수행하는지에 대해 알아볼 필요가 있으며, 이를 대체할 수 있는지에 대한 여부가 중요하다. 혈액 내의 단핵구는 대식세포 군집에 중요한 역할을 한다. 이는 질병이 유도된 염증상태에서 대식세포와 수지상 세포로 분화가 가능하다. 일단 염증이 시작되면, 단핵구는 염증 부위로 신속히 이동하며, 조직 특이 인자에 영향으로 다양한 형태의 활성화된 면역 세포로 분화한다. 단핵구에서 유래된 세포는 다양성을 가지며, 심지어 단일 기관이나 염증 조직 그리고 미세환경에서 받는 신호를 기반으로 다양한 기능적 모듈을 확보한다. 그러나 장기간 상주하고 있던 대식세포집단과 비교하여 보면, 이들 단핵구 유래 세포의 장기 지속성 및 기능적 차이점에 대해서는 아직 확인되어야 할 부분이다. 배아유래 조직 내 대식세포가 감염이나 염증에 노출되었을 시, 성인 골수 유래 세포(단핵구가 아닐 수 있다)로 대체된 최근의 실험 모델은 성인 골수 유래 세포가 다음과 같은 표현형과 기능적 특징에 차이가 있음을 나타낸다. 성인 골수 유래 대식세포는 기존의 개체군과 비슷한 유전자 프로파일을 나타내지만, 일부 차이가 있다고 보고되었으며, 이는 조직 환경이 대식세포의 표현형을 결정한다는 것을 시사한다. 특별한 조직 내 대식세포를 확인하는 방법에 대한 통찰력은 면역세포가 미세환경에 의하여 영향을 받을지에 대한 부분이 밝혀져야 하며, 반대로 세포의 내재적 기전과는 다르게, 새로운 분석이 이러한 부분을 이해하는데 활용될 것이다. 특별한 조직과 대식세포에서의 주된 신호전달기전과, 대식세포의 생존에 대한 새로운 부분을 이해하는 것이 중요한 부분이 될 것이다.
6. 대식세포 활성화의 시공간적인 오차
우리가 대식세포의 계층적인 유동성과 미세 환경 신호에 의하여 유도되는 활성 조건에 대하여 인정한다면, 이들은 시공간적인 부분에서의 해석이 필요하며, 이를 해석하기 위해 좀 더 많은 것들을 고려해야 한다. 대식세포활성화의 계층성(heterogeneity)은 단일세포 수준에서 섬세하게 다루어져야 한다.
또한 대식세포는 시간적인 부분과 공간적인 부분(미세환경적인 부분에서) 실험 설계에 새롭게 해석되어야 한다. 이러한 변수들에 대한 해석은 상당히 도전적인 일들이다. 특히 상주하고 있는 대식세포가 활성화되면 주변에서 단핵구 유래의 대식세포들이 모여들게 된다. 서로 다른 시점에서 그리고 서로 다른 지점들 사이에 서로 다른 세포들끼리, 어떠한 역할을 수행하는지에 대한 부분을 해석하는 일들이며, 이는 최근 박테리아에 의한 요도 감염과 대식세포의 이동, 그리고 상주하는 대식세포에 대한 영향을 연구 했었던 연구를 예로 들 수 있겠다. 신경시스템에 있어서 Microglia는 신경계 주변의 부스러기 등을 제거하는 역할을 하는 반면 이는 단핵구 유래의 대식세포는 신경세포의 축색돌기를 둘러쌓고 있는 수초의 손상을 일으킨다. 그리고 간 손상 모델에서 최초에 CCR2loCX3CR1hi 세포가 말초지역에서의 사이토카인을 발현하고, CCR2hiCX3CR1lo 단핵구가 손상부위 주변으로 모여들게 하여 상처 치료의 효과를 보여 준다. 다른 방향의 연구로, 단핵구가 조직으로 들어와서 어떻게 변하는가 이다. 장기간 동안 들어와 있던 단핵구는 조직 내 대식세포로 변한다면, 얼마만큼의 빈도로, 그리고 어떠한 부분이 같고, 틀린 것인가에 대하여 알아볼 필요가 있다. 일단 대식세포의 분자적인 기전이 시간과 공간에 따라서 차이가 있음을 지도화(mapping) 할 수 있다면, 어떤 대식세포가 어느 수준으로 존재하는 지에 대한 것을 결정할 수 있을 뿐만 아니라, 신호전달기전, 그리고 전사 인자 네트워크와, 기능적인 차이가 어떠한 환경에서 유래되는지를 알 수 있다. 후성유전학적인 부분에서의 대식세포의 특징은 항상성에 의하여 나타나는 미세 환경의 차이에 의하여 조절이 된다. 이들 환경은 후생유전학적인 변화를 유도 할 수 있으며, 이는 기능적인 차이를 유발하게 된다. 예를 들면, 복강 내 대식세포, 쿠퍼 세포, 그리고 비장 내 세포에서 조직 특이적으로 후성유전학적인 부분에 대한 발현에 차이를 보인다(복강 내 대식세포: GATA-6, 쿠퍼세포와 비장세포: LXRA, 비장 내 red pulp에 존재하는 대식세포: SPIC, microglia: MEF2C). 더불어, STAT과 IRF에 대한 전사인자들의 축적은 대식세포의 스트레스 기반 활성에 직간접적으로 연관이 된다. 그러나 우리의 최근 연구에 의하면, 후성유전학적 연관성과 유전자 발현 기전에 대한 차이는 현재도 이해하는데 한계가 있다. 덧붙이자면, Long noncoding RNA나, RNA에 부착되는 단백질인 tirstetraprolin과 같은것들이 존재하는데 이러한 부분도 추후 연구를 수행할 때 짚고 넘어가야할 중요한 부분이다. 이러한 문맥에서, 선천성 기억과 교육된 선천성 면역이라는 개념이 이를 이해하는데 도움이 된다. 예를 들어 대식세포가 LPS나 글루칸(glucan) 등에 의하여 한번 자극을 받으면, 이후에 같은 자극이 왔을 때, 그 반응 강도가 높아지는 것이 좋은 예이다. 현재까지도 후성유전학적인 기전은 교육된 선천성 면역과 관용에 대한 부분을 설명하는데 도움이 되기는 하지만, noncoding RNA와 RBP는 빠질 수 없는 부분이므로, 이도 같이 확인이 필요하다.
7. 다차원적 대식세포 활성화에 대한 결과
대식세포는 기원의 유래에 차이가 있지만, 공통적으로 면역을 억제하는 기능을 가지고 있으며 이는 대식세포가 가진 항상성의 중요한 기능일 수 있다. 예를 들면, 태아 간 유래 폐 대식세포와 난황유래 뇌의 대식세포는 공통적으로 T림프구의 활성과 분화를 억제할 수 있는 기능을 가지고 있다. 단핵구 유래의 장내 대식세포의 경우에도 동일하게 IL-10 관여 Foxp3+Treg이 장내 lamina propria라는 위치에 생성할 수 있도록 중계 역할을 한다. 개체발생적으로 서로 다른 기관 내 대식세포에 대한 in vitro 활성 실험에서 각기 다른 기능적인 차이를 보여주고 있다. 태아 간 유래 폐 대식세포가 LPS에 의하여 자극을 받았을 때에는 T 림프구 활성되는 반면, 난황 유래 뇌 내 대식세포는 IL-10을 더욱 분비하여 T 림프구의 억제가 강하게 유지된다. 또 다른 대식세포로 단핵구 유래 장내 대식세포의 경우의 경우에는 LPS에 의하여 자극 받아 IL-10이 유지가 되어야, 장내 염증이 억제되는 효과를 보여준다. LPS와 같은 염증 매게 물질은 서로 조직에 상주하고 있는 대식세포에 대하여 서로 다른 결과를 보여주며, 이는 기관발생과정, 그리고 기관의 미세환경에서 나타나는 특정한 자극에 의한 차이에 의한 것임을 알 수 있다. 이러한 반응들이 개체의 항상성과 면역관용 등에 영향을 미칠 수 있다. 활성산소에 의한 in vivo 수준에서의 자극은 상주 대식세포가 림프절로 이동하여, 면역 조절의 기능을 수행하며, 이는 특히 항원에 의하여 자극할 수 있는 Treg을 활성화 시키고, 유지시키는 역할을 수행한다. 이와는 반대로, 단핵구 유래의 대식세포에서는 조직 내에서 강력한 염증반응을 야기한다. 그리고 IFN-gamma에 의한 T 림프구 의존적 면역반응을 기전으로 이러한 염증반응이 작동한다. 이러한 반응들은 병원체 유래 후성유전학적인 리프로그래밍에 의하여 유발되는 기전이다. 이는 ‘Trained immunity', 즉 ‘선천성 면역기억’과 연관되어 있다. 염증성 단핵구 유래 대식세포는 염증을 유발시키는 유발원이 없어지면, 비염증성 대식세포로 변하며, 이는 T림프구의 억제에 관여한다. 각 기관의 미세환경은 염증반응에 있어 단핵구유래 대식세포의 조직 내 침윤과 활성 그리고 기능을 조절한다. IFN과 대식세포의 분화에 관여하는 CSF-1의 억제는 염증성 단핵구가 억제성 대식세포로의 분화를 촉진한다고 보고가 되고 있다. 이는 T림프구에 의하여 조절이 되며, 결국 면역관용의 단계로 이어진다. CSF-1의 조절은 단핵구가 조직 내 대식세포로의 리모델링 그리고 염증 억제에 대한 역할을 수행할 수 있도록 대식세포로 분화를 하게 되며, 따라서 CSF-1를 억제하게 되면, 암의 전이와 진행을 억제할 수 있게 되는 것이다. 대식세포를 타겟하는 다른 치료전략으로는 염증성 대식세포를 감소시키는 방법, 그리고 조직 내에 침윤되는 정도를 억제하는 방법이 있다. 이러한 방법은 이미 다양한 모델에서 효과가 있음이 검증이 되었으며, 동맥경화 모델과 조직이식, 암 등의 모델에서 연구가 확인되었다. In vitro에서 단핵구 유래 대식세포의 활성은 사이토카인, 성장인자, 프로스타글란딘, 글루코코르티코이드와 TLR 자극원 등이 사용되고 있으며, 이들에 대한 복합적인 처리에 의하여 질병이 악화되는 것을 방지하기 위한 다양한 시도가 동물과 인체를 대상으로 진행되고 있다. 예를 들면, IL-4에 의하여 활성화된 대식세포는 in vitro 조건 내에서 PBL과 helper T 림프구의 분화할 수 있음이 보고되고 있다. 하지만, IL-4와 CSF-1를 같이 자극하게 되면, T 림프구의 분화를 억제하는 결과뿐만 아니라, T세포의 성장을 유도하는 것이 보고 되었다. 이러한 결과는 자극의 강도, 경로 등이 면역반응을 결정할 수 있다는 것을 시사하는 바이다. 따라서, 단핵구 유래 대식세포를 타겟하여 성공적인 치료를 이끌어 내기 위해서, 치료 전략으로 자극원에 대한 다양한 반응스펙트럼에 대한 이해가 필요하고, 분화된 대식세포에 대한 개별적인 분화 등에 대한 연구가 필요하다. 대식세포 자체를 치료의 목적으로 수행하고자 하는 시도가 있다. 임상적으로 진행되고 있는 이 대식세포는 신장을 이식 받은 사람이 조직 이식 거부반응을 최소화 하기 위한 치료용 목적으로 독일에서 진행되고 있다(clinicaltrials.gov: NCT02085629). 현재까지 두 명의 환자가 이러한 치료를 받았으며, 조직거부반응이 6개월까지 보이지 않았음이 보고 되었다.
8. 대식세포활성화를 확인하기 위한 연구방법
대식세포의 다분화연구를 위해, 세포 수준에서의 연구가 필요하며, 시공간적인 접근이 필요하다. 골수 유래 세포의 분화를 확인하기 위한 리포터마우스를 이용하여, 세포의 이동과 분화를 연구할 수 있다. 이러한 기술은 단일세포 수준에서의 전사체를 연구할 수 있는 single cell RNA seq 분석기술, 그리고, iCHIP 기술, 그리고 single-cell ATAC 서열 분석 기술을 통해 후성유전학적인 수준에서의 접근을 통해 가능할 수 있다(그림 2). 단일세포 수준에서의 RNA seq이 가능한 이 기술은 기존에 사용되어 왔던 FACS와 같은 기술을 뛰어넘어 수많은 유전자와 각 세포의 특성들을 실질적으로 비교, 분석할 수 있는 기반이 된다. 이러한 기술들은 면역학과 생명과학 연구를 위해 필수적이라고 확신한다. 단일세포 염기서열분석기술과 필적하게 면역 표현성 평가를 위한 CyTOF 기술은 기존의 flow cytometry 분석기술에서 진보된 새로운 기술로서 한번에 50가지 표현형을 확인할 수 있는 기술이다. 이는 앞서 단일세포 전사체에서 확보된 마커를 단백질 수준에서 확인할 수 있는 방법으로, 서로 다른 대식세포의 표현형에 따라서, 염증과정에서 진행되는 항상성의 결과를 확보할 수 있는 방법이다(그림 2). 결국 고성능의 분해능을 가진 이러한 기술들은 단일세포 유전체, 후성유전 리프로그래밍 결과와 분화지도를 구축할 수 있으며, 이는 대식세포의 활성과 기원에 대한 연구를 가능케 한다. 이러한 기술들은 골수유래 세포의 분화와 면역 시스템과의 동적인 변화에 대한 이해를 가능케 하는 것 이외에도 다양한 결과를 확보할 수 있는 동력원이 될 것이다.
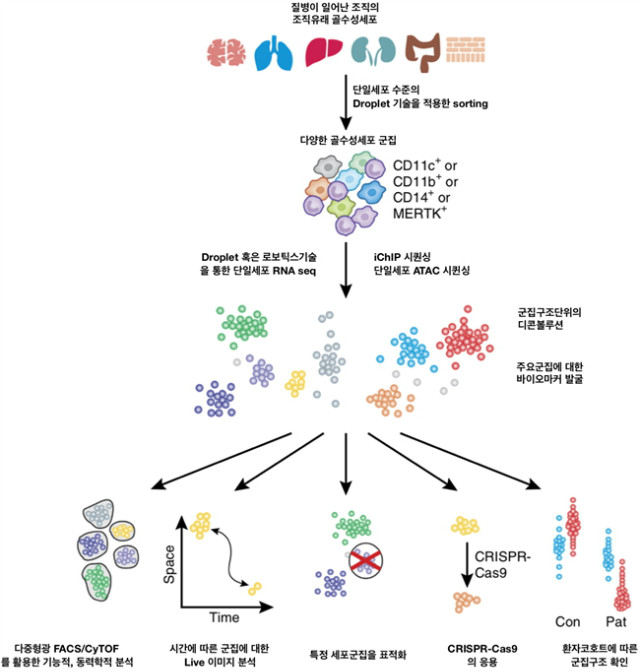
그림 2. 대식세포활성 연구를 위한 단일세포 수준의 연구기술과 적용: 위의 그림에서는 대식세포에 대한 연구를 위한 로드맵을 제공하고 있다. 특히 단일세포수준에서의 분석을 통해서, 질병을 매개하는 대식세포에 대한 분석을 수행하고, 다양한 방법을 통해 질병의 원인들을 제거하여 항상성을 다시 유지할 수 있는 근거들을 확보할 수 있는 접근방법이 될 것이다.
9. 결론
대식세포의 항상성과 질병에 대한 결정적인 역할들을 이해하면 치료에 대한 타겟을 설정하는데 있어서 중요한 방향성을 보여줄 것이다. 특히 앞서 설명한 기술들을 토대로 하여 이들 타겟에 대한 중요한 기틀을 마련할 것이다. 더불어 새로운 유전적 기법과 iPS를 이용한 세포치료수준에서의 치료전략은 다양한 질병의 치료에 적용될 수 있을 것이다. 대식세포의 기원과 활성에 대한 지난 수년간 두드러진 연구가 진행되었다고 하더라도, 아직까지 밝혀져야 할 부분은 많다. 대식세포의 활성이 각각의 조직에서 나타나는 부분이나, 조직의 미세환경의 조절 시스템, 그리고 염증에 대한 프로세스 등에 대한 기전들이 바로 그것이다. 예를 들면, 상처치유에 관여하는 M2 유사 표현형을 대식세포가 가진다고 하더라도, 전체적으로 보면 이 기능이 전체 프로세스 중에 한가지일 뿐이다. 이러한 프로세스를 이해한다면 이식, 수술, 줄기세포 등에 대한 의학적 치료전략으로 응용될 여지가 충분하다. 다른 쪽으로는 사람과 마우스 대식세포반응에 대한 차이점을 이해하는 것이다.
[추가 설명]
rMs*: rMs는 M1 대식세포와는 달리 COX2와 iNOS의 발현이 다르고 표면 인자도 다르다고 보고됨. (Blood. 2008 Nov 15; 112(10): 4117?4127)
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0002891.pdf
pdf_0002891.pdf