기술동향
키메라 항원 수용체(Chimeric Antigen Receptor, CAR)기반 항암면역 T세포치료제
- 등록일2018-10-04
- 조회수12193
- 분류기술동향
키메라 항원 수용체(Chimeric Antigen Receptor, CAR)기반 항암면역 T세포치료제
(김찬혁, 카이스트 생명과학과 조교수, 큐로셀 CTO)
1. 서론
1800년대 말 미국인 의사인 윌리엄 콜리는 열을 가해 죽인 박테리아를 주입한 일부 환자에게서 암이 줄어드는 것을 관찰하였다. 이후 환자의 면역계를 활성화 시킴으로써 암을 치료하려는 ‘항암면역치료’는 기대와 실망을 거듭하면서도 꾸준히 연구되어왔고, 비로소 2000년대에 이르러 그 효과가 임상에서 검증되면서 항암치료법의 주요한 축으로 자리매김하며 큰 관심을 받기에 이르렀다. 현재 이러한 임상적 성공의 선두에 위치한 치료제는 크게 세 부류 ? 면역관문 수용체 차단항체, 항 CD3항체 기반 이중 항체, 그리고 키메라 항원 수용체(chimeric antigen receptor, CAR)를 발현하는 T 세포 치료제-로 나뉠 수 있는데, 이들 모두 공히 T세포의 활성에 기반한 항암 작용기전을 가지고 있다는 점은 주목할 만 하다. 이들 중 CAR-T세포 치료제는 면역학, 바이러스학, 단백질공학, 세포공학, 암 생물학, 그리고 기초 및 임상의약학 등과 같이 매우 다양한 학문 분야에 걸친 기술과 지식이 함께 시너지를 이루어 탄생한 치료제이다. 특히 B세포 특이 항원인 CD19을 표적하는 CAR-T세포 치료제 2종은 난치성 B세포 유래 혈액암에서 괄목할 만한 효능을 보이며 2017년 미국 식약청의 허가를 받았다. 본 글에서는 인간에 의해 디자인되어 만들어진 수용체인 CAR의 구주를 중심으로 CAR-T치료제의 효능, 안전성, 및 환자의 접근성을 향상시키기 위한 노력과, 나아가 항암제를 넘어 면역 조절을 통한 다른 인간 질병 치료에의 적응 가능성에 대해서 논의하려 한다.
2. 키메라 항원 수용체의 디자인
CAR의 기본적인 디자인은 크게 세포 외 도메인(표적 및 연결 도메인으로 이루어짐), 막 관통 도메인, 그리고 신호전달 도메인으로 이루어져 있다. 이들 각각의 요소들은 CAR의 효율적인 발현뿐만 아니라 CAR-T 세포의 항암 효능과 안전성에 큰 영향을 미칠 수 있다.
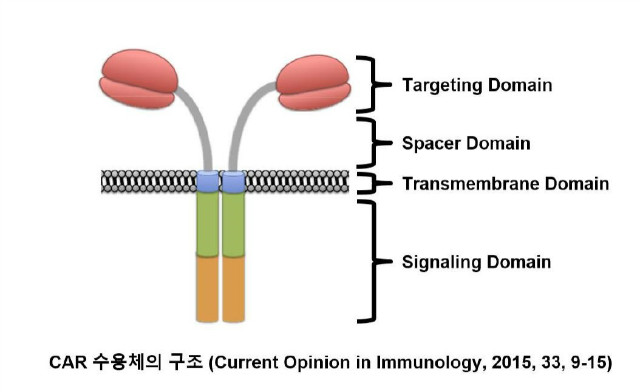
2.1. 표적 도메인 (Targeting Domain)
일반적으로 T 세포는 T 세포 수용체 (T cell receptor, TCR)를 통해 표적 세포의 표면에 주조직 적합 복합체 (Major Histocompatibility Complex, MHC)를 통해 제시된 펩타이드를 항원으로 인지한다. 반면 CAR는 주로 단일사슬 형태의 항체 단편 (single-chain variable fragment, scFv)를 이용하기 때문에, 암세포의 표면에 과발현하는 것으로 알려진 암관련항원 단백질 (e.g. HER2, PSMA, CEA etc) 뿐만아니라, 당 사슬 (e.g. Lewis Y), 혹은 당지질 (e.g. GD2)에 이르기까지 다양한 종류의 항원들을 인식할 수 있다 . 또한 일부 CAR에서는 scFv가 아닌 특정 수용체에 대한 리간드 (e.g. NKG2D ) 혹은 그 유도체들 (e.g. IL13) 들을 이용하기도 한다.
단일클론 항체에 기반한 단백질 치료제의 경우, 생쥐의 면역접종으로 부터 얻어진 서열을 그대로 이용하였을 때 발생하는 면역원성 (immunogenicity)은 항체의 반감기와 항원 인식에 영향을 미칠 수 있다. 이에 비해 생쥐의 서열에 기반한 scFv를 사용한 CAR-T 세포치료제의 경우에는, 반복 투여시 환자의 몸안에서 심각한 과민증 (anaphylaxis)을 일으켜 안전성에 영향을 미칠 수 있다는 것이 보고된 바 있다 [1]. 뿐만아니라 면역원성이 CAR-T 세포가 체내에서 지속되는 기간을 감소시킬 수 있음을 시사하는 임상시험 결과 또한 보고되었다 [2]. 이러한 면역원성의 문제를 극복하기 위해서는 항체 서열의 인간화 과정을 거치거나, 인간서열 항체를 발현하는 유전자조작 생쥐 혹은 디스플레이 라이브러리로부터 새로이 항체를 발굴하는 시도가 가능하다.
암세포에 과발현하는 암관련항원 (tumor-associated antigens, TAA)은 많은 경우 일반세포에서도 낮은 수준으로 발현하고 있다. 따라서 CAR-T 치료제의 on-target off-tumor 부작용은 환자에게서 심각한 결과를 초래할 수 있다. 일례로 여러 암에서 일부 과발현되는 것으로 잘 알려진 HER2 단백질을 표적하는 CAR-T 세포를 전이성 대장암 환자에게 주입하였을 때, 폐 안에서 낮은 수준으로 발현하는 HER2를 인식하여 활성화됨으로써 환자를 사망에 이르게한 경우가 보고되었다 [3]. 이런 부작용은 HER2 표적 항체치료제의 경우에는 매우 드문 것으로 알려져있다. 아마도 이러한 차이는 세포 표면에 다수의scFv를 발현하는 CAR-T가 증가된 avidity로 인해 항원의 발현 수준에 대해서 더욱 민감하게 반응하기 때문인 것으로 이해될 수 있다. CAR-T의 증가된 항원 민감성에 의해 발생하는 부작용을 줄이기 위한 노력으로, 항체의 항원 인식부위에 돌연변이를 도입하여 원조 단일 클론 항체에 비해 고의적으로 친화력을 낮춘 시도들이 보고되었다 [4, 5].
T 세포가 TCR을 통해 MHC에 표지된 펩타이드 항원을 인식할 때는 펩타이드의 서열과 무관하게 T 세포와 표적 세포간의 거리가 대략 13~15 nm로 일정하게 유지된다 [6]. 이해 비해 CAR의 표적이 되는 항원의 크기는 매우 다양하며, 심지어 동일한 항원에 대해서도 CAR에 사용된 scFv가 인식하는 에피토프의 위치에 따라 CAR-T 세포와 표적 세포와의 거리는 큰 영향을 받게 된다 [7]. T 세포가 표적 세포를 인식하여 소위 면역 시냅스 (immunological synapse)를 형성하였을 때, 두 세포간의 적절한 거리는 T 세포에서 최적의 활성화를 유도하는데 매우 중요한 역할을 한다. 이를 설명하는T 세포의 활성화 기작에 대한 이론으로 “kinetic-segregation model”이 있다 [8]. 이 이론에 따르면 TCR의 활성화를 촉발시키는 lck와 같은 kinase는 diacylation 된 형태로 세포막 내부의 lipid raft 에 존재하므로 두 세포간의 거리에 영향을 받지 않는다. 그러나 CD45 혹은 CD148과 같은 phosphatase는 커다란 세포외 도메인 (extracellular domain)을 갖는 막관통 단백질 (transmembrane protein)로서 세포간의 거리가 일정 수준 이상 가까워지게 되면 물리적으로 면역 시냅스에서 제외되므로, 결과적으로 시냅스 내 인산화의 증가가 일어나게 된다. CAR에 의해 만들어지는 시냅스와 TCR에 의해 만들어지는 시냅스 사이에는 형태와 기능적으로 상이한 부분이 존재한다 [9]. 그러나 여전히 세포간의 거리는CAR-T 세포의 활성화에서도 핵심적 역할을 하는 것으로 생각된다 [10, 11]. 이를 뒷받침 하는 결과 중 하나로 동일한 CD22 항원을 표적하는 항체들 중에 에피토프의 위치가 상대적으로 세포막에서 가까운 쪽을 인식하는 scFv를 사용하였을 때 CAR-T 세포의 활성화가 더욱 효율적으로 일어나는 것이 보고되었다 [12].
2.2. 연결 도메인 (Spacer Domain)
연결 도메인은 표적 도메인으로 하여금 CAR-T 세포막 과의 일정 거리를 두고 보다 유연하게 표적 항원을 인식할 수 있도록 도입되었다. 앞서 언급된 표적 항원의 크기 및 에피토프의 위치 뿐만아니라, 연결 도메인의 길이 또한 CAR-T와 표적 세포 사이의 거리에 영향을 미칠 수 있다. 따라서 지나치게 길이가 긴 연결도메인은 CAR-T의 활성화에 부정적인 영향을 미칠 수 있다. 다른 한편으로는 표적 항원의 크기가 클 경우 표적 도메인의 원활한 접근을 위하여 일정 길이 이상의 연결 도메인이 필요할 수 있다 [7, 13].
최근 CAR 디자인에 주로 사용되는 연결도메인 서열들은 CD8a나 CD28의 hinge 부위, 혹은 항체 (IgG1 혹은 IgG4)의 Fc 부위 등이 있다. CD28과 CD8 hinge 를 차용한 연결 도메인은 대략 40여개의 아미노산으로 이루어지며 특정한 3차구조를 이루지 않는데 비해, 항체의 Fc (CH2와 CH3)를 이용한 연결 도메인은 200개 이상의 아미노산을 포함하며 immunoglobulin fold로 이루어진 3차 구조를 갖는다. 이러한 잘 접혀진3차 구조로 인해 현저히 많은 아미노산 숫자에도 불구하고 Fc 기반 연결 도메인은 CD8a 나 CD28 hinge에 기반한 연결 도메인에 비교했을 때 유사한 길이를 갖게 될 것으로 추측할 수 있다. 이외에도CD8 혹은 CD28 hinge 는 서열 안에 존재하는 시스테인 잔기에 의존하여CAR homodimer를 이루는 반면, Fc 기반 연결 도메인은 추가적인 단백질-단백질 상호작용 (protein-protein interaction)을 통해 더욱 강하게 CAR homodimer를 이룰 수 있다.
연결 도메인의 서열이 off-target 단백질에 대해 친화력을 갖게 될 경우 CAR-T세포의 효능과 안전성에 부정적인 영향을 미칠 수 있다. 일례로, Fc 에 기반한 연결 도메인을 사용한 CAR의 경우 표적 항원의 존재와는 무관하게 대식세포 등의 표면에 존재하는 Fc 수용체와 결합 할 수 있다. 그 결과 동물모델에서 CAR-T 세포의 비특이적인 사멸이 증가되고 생쥐의 폐에서 시간이 지나도 비정상적으로 분포하는 것이 관찰되었다 [14, 15] . 이러한 문제를 해결하기 위하여 Fc 서열 중에서 Fc 수용체와 상호작용을 하는 CH2 부위에 돌연변이를 도입하거나, 아예 CH2를 제거하고 CH3 부분으로만 이루어진 연결 도메인을 사용하는 것이 가능하다.
2.3. 막관통 도메인 (Transmembrane Domain)
막관통 도메인은 세포막 외부의 연결 도메인과 세포막 내부의 신호전달 도메인을 연결하는 역할을 하며, CAR의 구조 중 유일하게 소수성 환경에 노출된 부분이다. 이 도메인은 대략 20여개의 짧은 아미노산으로 이루어져 있으며 소수성 잔기를 가진 아미노산들의 alpha-helical 이차 구조로 이루어져 있다. 막관통 도메인은CAR의 발현양에 큰 영향을 미칠 수 있다 [16]. 최근 보고되는 CAR의 디자인에 사용되는 막관통 도메인은CD8a와 CD28의 서열에서 차용된 것들이 주를 이루고 있다. 초기 1세대 CAR의 디자인에는 CD3 zeta 도메인의 막관통 도메인이 사용되었는데, 이러한 CAR는 T 세포에 존재하는CD3-zeta 사슬과 heterodimer를 형성하며 내재적인 TCR과 상호작용 할 수 있음이 보고되었다 [17].
TCR을 비롯한 여러 활성 면역 수용체들 (e.g. NKG2D, FcRs, TREM2 etc.)은 많은 경우 세포 밖의 리간드를 인식하는 부위와 세포 내의 신호전달을 담당하는 부위가 비공유적으로 (non-covalently) 연결된 복합체를 형성하고 있다 [18]. 이 때, 막관통 도메인들은 이온 결합 등을 통해 두 부위가 상호작용을 하는데 중요한 역할을 한다. 이러한 성질을 이용하여 서로 다른 막관통 도메인을 조합함으로써 단일 폴리펩타이드가 아닌 두 개 이상의 폴리펩타이드의 복합체로 이루어진 형태의 CAR를 디자인하는 것이 가능하다 [19, 20].
2.4. 신호전달 도메인 (Signaling Domain)
TCR 과 달리 일반적으로 CAR는 항원인식 부위와 신호전달 부위가 연결된 하나의 폴리펩타이드 사슬로 이루어져 있다. 초기 CAR 디자인에서는 신호전달 도메인으로서 TCR의 주요 신호전달 사슬인 CD3-zeta 혹은 활성 Fc 수용체의 신호전달 사슬인 FcR-gamma 가 주로 이용되었다. 두 신호전달 도메인 모두 Immunoreceptor Tyrosine-based Activation Motif (ITAM) 서열을 포함하고 있으나, ITAM의 개수 (CD3-zeta는 3개, FcR-gamma는 1개)와 인산화된 ITAM과 주로 상호작용하는 kinase의 종류 (CD3-zeta는 ZAP70, FcR-gamma는 Syk) 등이 서로 다르다. 이들을 비교한 실험들 중에서, 더 많은 개수의 ITAM을 가진 CD3-zeta에 기반한 CAR가 Fc-gamma CAR에 비해 상대적으로 높은 항원 민감성을 보이는 것이 보고되었다 [21]. 뿐만 아니라 최근 발표된 논문에서는 발현이 낮은 항원에 대해 CAR의 반응성을 향상시키기 위해 CD3-zeta의 ITAM의 개수를 더욱 늘리는 시도 또한 보고되었다 [22]. 그러나 이와는 달리 CD3-zeta의 ITAM들이 부분적으로만 인산화될 경우 오히려 T 세포의 활성을 저해시킬 수도 있다는 보고와 [23, 24], 세 개의 CD3-zeta ITAM 중 두 개를 돌연변이로 불활성화 시켰을 때 CAR-T 세포의 사멸이 오히려 감소한다는 보고도 있다 [25]. 이렇게 서로 상반된 결과들이 관찰되는 이유는 아마도 각 실험에 사용된 CAR 수용체의 항원에 대한 친화도 및 표적 세포 표면의 항원의 발현 수준 등이 서로 다르기 때문일 수 있다.
CD3-zeta 신호전달 도메인으로만 구성된 소위 ‘1세대’ CAR-T 들은 체내에서 증식과 장기간 생존이 제한되어, 임상에서 인상적인 효능을 보여주지 못하였다. 이를 극복하기 위하여 CD28 또는41BB (CD137)와 같은 costimulatory 수용체의 신호전달 부위를 CD3-zeta에 추가한 것이 “2세대” CAR-T로 불린다. 실제로 CD28이나41BB에 기반한 2세대 CAR-T들은 생체내에서 급격하고 왕성한 증식과 오랜 생존 능력을 보였는데, 이러한 특징은 매우 향상된 항암효과로 연결되었다. 그 결과 현재까지 미국 식약청의 허가를 받은 두 종의 CAR-T 중 노바티스사의 Kymriah는 41BB, 길리어드사의 YESCARTA는 CD28 신호전달 도메인에 기반한 것이다.
CD28과 41BB는 세포막에 존재하는 수용체들로서 ,리간드에 결합했을 때 둘 다 CD3의 신호를 보강하며 세포사멸에 관련된 인자들을 억제한다는 공통점을 가지고 있다. 그러나 두 단백질은 구조적으로 매우 다른 그룹 (CD28 family vs TNFR family)에 속할 뿐만 아니라, 이들 수용체들과 밀접하게 상호작용하며 활성의 조절과 신호전달에 관여하는 단백질들의 부류 또한 매우 다르다. 예를 들어, CD28의 활성은 주로 인산화에 의해 조절되는 반면, 41BB의 활성에는ubiquitination 이 중요한 역할을 한다. 두 종류의 2 세대 CAR-T 세포의 형질을 일반적으로 비교했을 때, CD28기반 CAR-T는 상대적으로 빠른 증식을 보이고 많은 양의 IL-2와 IFN-gamma와 같은 TH1사이토카인들을 분비한다. 이에 비해 41BB 기반 CAR-T는 상대적으로 지연된 반응을 보이나 더욱 오랜 기간 (수개월~수년) 체내에서 생존하며 덜 탈진(exhaustion)된 형질을 보이는 것이 보고되었다 [26, 27]. 이 두 수용체 외에도 ICOS나 OX40와 같은 costimulatory 수용체를 포함한 CAR-T들이 개발되었으나 아직 임상에서의 검증을 앞두고 있다.
2세대 CAR-T 치료제에서 한걸음 더 나아가, 서로 다른 두 종류의 costimulatory 수용체를 조합한 ‘3세대’ CAR-T 들이 개발되었다. 그러나 3세대가 실제로 2세대에 비해 향상된 항암 효능을 갖는 가에 대해서는 서로 엇갈린 결과들이 보고되고 있다. 또한 일부 실험결과들에 따르면 두 종류의 costimulatory 신호 전달 부위가 하나의 폴리펩타이드 사슬로 연결되었을 때 각각이 완벽하게 작동하지 않을 가능성을 배재할 수 없다. 이를 극복하기 위해서는 두 종류의 costimulatory 신호를 서로 다른 폴리펩타이트 사슬로 분리해 배치하는 디자인이 가능하다 [28].
T 세포의 최적의 활성화를 위해서는3종류의 신호 (TCR, costimulatory, 그리고 사이토카인)를 함께 전달하는 것이 이상적이다.이를 위해 기존의 CAR 디자인에 사이토카인 신호를 추가하기 위하여 2A 혹은 IRES와 같은 시스템을 이용해 원하는 사이토카인 유전자를CAR와 동시에 발현하는 시도들이 보고되었다 [29, 30]. 그러나 이러한 디자인으로 만들어진 CAR-T 세포는 사이토카인을 항상 발현하는 상태이므로 체내에서 독성을 유발할 위험이 있다. 이를 극복하기 위해서 CAR의 디자인 내부에 IL2 수용체 beta chain의 일부를 삽입하고 CD3-zeta에 돌연변이를 도입함으로써, CAR-T 세포의 내부로만 항원 의존적으로STAT3와 STAT5 신호를 전달하는 디자인이 개발되었다 [31].
3. 보다 나은 CAR-T 치료제를 만들기 위한 노력
다양한CAR 구조의 개선을 거치며 탄생한2세대 CD19 표적 CAR-T세포는 난치성 B 세포 유래 백혈병 및 림프종 환자들에게서 매우 높은 항암 효능을 보이며, 조혈모세포 이식을 위한 연계 혹은 대체 치료법으로까지 논의되고 있다 [32]. 이외에도CAR-T 를 이용한 항암치료는 다발골수종 환자들을 대상으로한 임상시험에서 매우 성공적으로 진행되고 있으며, 급성 골수성 백혈병을 대상으로 확장이 시도되고 있다. 그러나 이러한 임상에서의 성공은 아직까지 혈액암에 국한되어 있으며, 암 환자 숫자의90% 이상에 해당하는 고형암에서는 아직까지 인상적인 결과를 보여주지 못하고 있다. 이는 앞으로 CAR-T 치료제의 효능과 안전성을 향상시키기 위해 더욱 많은 연구와 임상에서의 평가가 필요함을 의미한다 [33].
효과적인 암세포 제거의 관점에서 이상적인 CAR-T 세포의 형질은 1) 면역 억제적 환경에서도 암세포에 대해 높은 살상 능력을 보이며, 2) 항원 특이적으로 뛰어난 증식능을 보이고, 3) 일정 기간 이상 체내에서 유지되는 생존 능력을 갖는 것이다. 이러한 CAR-T 치료제를 만들기 위해 CAR의 디자인 못지않게 중요한 것은 T 세포 자체이다. 예를 들어, 만성 백혈성 환자의 몸에서 분리된 T 세포가 이미 탈진된 형질을 보일 경우 이를 통해 만들어진CAR-T 치료제의 효과가 저해될 수 있음이 최근 보고되었다 [34]. 이러한 탈진된 T 세포를 엔지니어링을 통해 어떻게 reinvigorate 시킬 수 있을 것인가는 앞으로 해결해야 할 중요한 과제이다 [35]. 또한 동일한 T 세포로 만들어진 CAR-T 세포일지라도 배양조건에 따라 더욱 “젊은” 형질 (e.g. TCM)을 유지하며, 이것이 체내에서 더욱 왕성한 증식과 향상된 항암 효과로 이어진다는 것이 보고되었다 [36, 37].
현재 임상에서 사용되고 있는CAR-T 치료제는 원료에 해당하는 T 세포를 모두 말초 혈액에서 분리해서 사용하고 있기 때문에 제작된 CAR-T 세포 간의 상당한 질적 및 양적 차이가 존재한다. 그뿐만 아니라 이는 자가 혹은 타가유래 혈액에 관계없이 진정한 의미의 off-the-shelf CAR-T를 만드는데도 한계로 작용한다. 이를 극복하기 위해 T 세포주를 이용하거나 줄기세포로부터의 분화 [38]를 통해 안정적으로 대량의 T 세포를 얻는 것이 가능하지만, 이를 통해 만들어진 CAR-T 치료제들의 안전성 및 효능에 대해서는 앞으로 기존의 말초 혈액 유래 CAR-T와 비교가 필요하다. 다른 한편으로는 현재 CAR-T 치료제를 환자에게 투여하는 용량 (10^6 ~ 10^8 cell/kg)을 획기적으로 낮추는 것 또한 대안이 될 수 있다. 흥미롭게도 최근 CAR 유전자가 TET2 유전자 위치에 우연히 삽입된 CAR-T 세포가 하나의 클론에서 유래되어 급격한 증식을 거쳐 환자에게서 완전관해를 유도한 것이 보고되었다 [39] . 이러한 결과는 향후 CAR-T 세포의 악성 형질전환 가능성 등의 확인을 통해 안전성이 보장될 경우 현재의 치료 패러다임을 바꿀 수도 있을 것이다.
현재까지 CAR-T의 표적도메인으로 사용되는 scFv들은 대부분 기존 단일클론 항체의 서열을 이용하여 제작되었다. 단일클론 항체들은 일반적으로 최초의 수많은 후보 서열들로부터 단백질 치료제로서의 용도를 고려하여 다양한 기준들 (친화력, 항원 선택성, 이종 항원인식, 생물리적 특성, 반감기 등)을 통과하고, 이후 단일클론 항체 형태로 효능 시험을 거친 후에 선택된다. 그러나 이러한 항체의 선별 기준들 중 일부는 CAR-T 세포 치료제에 적용되었을 경우 무관하거나 상반된 영향을 미칠 수 있는 반면, CAR-T의 효능에 결정적 영향을 미치는 것으로 알려진 요인들 (e.g. 에피토프의 위치)이 고려되지 않는 경우가 많다. 따라서 향후CAR-T의 효능에 최적화된 scFv를 발굴하기 위해서는 새로운 전략의 수립이 필요하다.
높은 치료 효능에도 불구하고 현재 임상에서 사용되고 있는 CAR-T 치료제는 가격이 매우 높게 (Kymriah $475,000, YESCARTA $373,000) 책정되어 이로 인한 환자의 경제적 부담이 문제로 지적된다. 그뿐만 아니라 높은 가격은 향후 CAR-T 치료제가 고형암에 이르기까지 확대 적용될 경우 환자와 보험재정에 큰 부담으로 작용할 것이 자명하다. 이렇게 CAR-T 치료제의 가격이 높게 책정된 원인으로는 자가 혈액을 이용한 제작 공정 뿐만아니라 임상품질 바이러스의 높은 제작 비용을 들을 수 있다. 이에 대한 대안으로 Piggy-back 이나 Sleeping Beauty와 같은 transposon 시스템을 이용하여 DNA플라스미드 형태로CAR 유전자를 전달하는 방법이 개발되어 임상에서 시험되고 있다 [40]. 더 나아가, transposon 시스템이 CAR 유전자를 무작위적으로 삽입하는 문제를 해결하기 위해, CRISPR 등과 같은 유전자 편집 도구를 이용해 CAR 유전자를 genome 상의 특정 위치에 삽입하는 시도들이 보고되었다 [41, 42]. 특히 이러한 유전자 편집도구를 이용한 위치 특이적 (site-specific) 삽입 방법은 원하는 CAR 유전자의 삽입과 동시에 원하지 않는 유전자를 제거할 수 있다는 점에서, CAR-T의 효능 향상 [43] 또는 동종 타가유래 CAR-T의 제작 [44]과 같은 목적을 동시에 달성할 수 있는 잠재력을 갖고 있다. 그러나 이러한 유전자 편집을 위해서는 먼저 DNA의 이중나선에 결손이 일어나야 하는데, 이로 인해 대표적인 종양억제 단백질인p53의 활성화가 일어나 삽입효율이 감소하는 것이 보고되었고[45, 46], DNA의 large deletion [47] 혹은 translocation [44]이 일어나는 등, 아직 안전성에 대한 우려가 존재하고 있다.
최근들어 T 세포 뿐만 아니라CAR 유전자를NK, gamma delta T, NKT와 같이 세포 독성능을 가진 면역세포들 [48] 혹은 대식세포 [49]에 도입하여 항암면역 세포치료제로 활용하려는 연구 및 개발이 활발히 이루어지고 있다. 또한 CAR-T세포를 이용하여 병원성 면역세포를 제거하거나 [50] , 혹은 CAR를 조절 T 세포 (Treg)에 도입하여 [51] 자가면역 질환 및 장기이식에 적용하는 것이 가능하다. 이와 같이 면역세포의 엔지니어링 개념은 비단 암 뿐만아니라 자가면역, 과민반응, 장기이식, 더 나아가 대사질환 및 퇴행성 신경질환과 같이 면역계와 밀접하게 관련된 질환의 치료제 개발에 폭넓게 적용될 수 있는 잠재력을 가지고 있다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
이전글
- 스트레스 인지율 추이
-
다음글
- 박테리아 기반의 유용 단백질 발현전략 최신동향

