기술동향
HGF/c-MET 신호전달경로 및 종양미세환경에서의 역할
- 등록일2019-04-17
- 조회수10278
- 분류기술동향
HGF/c-MET 신호전달경로 및 종양미세환경에서의 역할
유영제약 중앙연구소 연구소장 송성원
1. HGF/c-MET 신호전달과 암
간세포성장인자 (Hepatocyte growth factor, HGF)는 산란인자 (Scatter Factor, SF)라고도 불리는데, 중간엽줄기세포(mesenchymal stem cell)에 의해 생산되는 다기능성 이종이중체(heterodimer) 폴리펩타이드로서 수용체인 c-MET에 결합하여 세포의 성장, 형성, 운동성 및 생존과 관련하여 다양한 역할을 수행한다. 특히 종양발달 및 예후와도 관련이 있어 뇌, 간, 전립선, 대장, 유방 및 피부를 포함한 다양한 암 조직에서 과발현되어 있음이 보고되어 있다. 이러한 HGF/c-MET의 과발현은 종양의 공격성 및 전이의 증가를 유발하여 생존기간의 단축을 포함하는 환자의 예후와도 높은 상관관계를 가지며 화학약물 요법과 방사선 치료 및 항암 치료법들에 대해 저항성을 부여하는 등 여러 가지 측면에서 암과 관련된 중요한 신호전달체계이다.
구조적으로 인간 간세포 성장인자는 생물학적으로 비활성인 단일 사슬(single chain) 형태의 전구체로 합성된다. 이후 혈청 세린 프로테아제에 의해 절단되어 4개의 크링글 도메인(NK4, 4-K domain)을 포함하는 알파-체인과 세린 프로테아제(serine protease) 기능을 갖는 베타-체인이 형성된 후, 이들 두 체인이 이황화 결합으로 연결된 이종이중체(heterodimer)가 형성되어 생물학적으로 활성을 가지는 HGF가 된다. HGF의 수용체인 c-MET은 receptor tyrosine kinase (RTK) subfamily에 속하는 단백질로 α와 β 두 개의 subunit으로 이루어져 있는데 β-unit의 sema domain이 신호를 전달하는 역할을 담당한다. c-MET은 HGF의 결합에 의해 dimer가 형성되면서 3개의 tyrosine residue(Tyr1230, Tyr1234, Tyr1235)가 자가인산화(auto-phosphorylation)되고, 이어서 카르복시 말단에 있는 두 개의 tyrosine residue(Tyr1349, Tyr1356)의 인산화로 ‘docking site’ 를 형성하여 Ras/Raf, PI3K/AKT/mTOR, STAT3 경로를 매개하는 하위의 신호전달물질(signaling molecule)들이 이 부근에 recruitment되면서 세포 내로 신호를 전달하게 되며 이러한 c-MET의 활성화는 세포 증식, 유동성, 침투, 신혈관 형성의 증가 및 항-세포사멸작용을 유도한다 (그림 1).
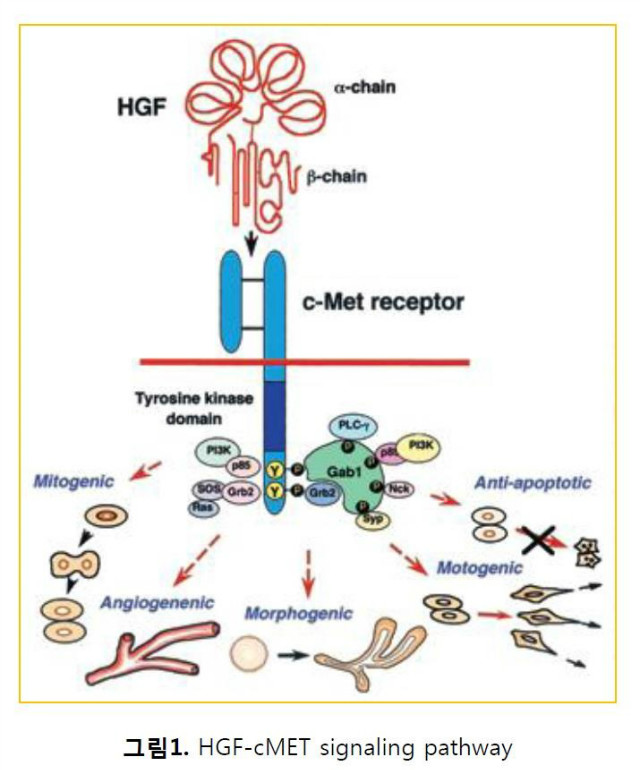
암세포에서 발견되는 HGF와 c-MET 간의 조절이상 (dysregulation) 및 c-MET의 과발현은 주로 Met 유전자 증폭(gene amplification), 전사 증가(transcriptional up-regulation), 점 돌연변이 (point mutations), 그리고 리간드인 HGF의 자가분비(autocrine)나 측분비(paracrine) 기작들을 통해 활성화된다. HGF와 MET 간의 비정상적인 신호전달은 암세포의 생존(survival), 증식(proliferation), 이동(migration), EMT(Epithelial-to-Mesenchymal Transition), 혈관생성(angiogenesis), 치료내성 및 stemness의 유지를 통하여 종양의 성장(progression), 침윤(invasion), 전이(metastasis)와 재발(recurrence)에 관여한다. 이처럼 종양 성장과 발달에서 HGF/c-MET 신호전달 경로가 핵심적인 역할을 수행한다는 점은 이미 잘 알려져 있었으나 최근 들어 이 외에도 HGF/c-MET 신호전달이 종양미세환경에서 암세포의 면역회피 기전과 관련되어 있음이 보고되면서 새로운 시각에서 HGF/c-MET 신호전달 경로를 해석하려는 움직임이 있다. 이에 본 글에서는 암발생과 성장을 촉진하는 역할 이외에 특히 종양미세환경에서 HGF/c-MET의 역할에 대해서 살펴보고 이를 통해 새로운 시각에서 항암 치료 타겟으로서의 HGF/c-MET의 기대효과를 논의해보고자 한다.
2. HGF/c-MET 신호전달과 종양미세환경
종양세포는 고립되어 자라는 것이 아니라 복잡한 종양미세환경(Tumor microenvironment, TME) 내에 존재한다. 종양미세환경은 기질세포(stromal cells)와 섬유아세포(fibroblast), 혈관(blood vessels), 면역세포(immune cells) 그리고 세포 외 기질(extracellular matrix, ECM)로 이루어진 복잡한 조직구조를 지닌다. 종양미세환경은 단순히 종양세포 주변을 둘러싸고 있는 조직이 아니라, 암의 발생과 성장, 치료내성 및 전이와 관련이 있다. 또한 섬유아세포는 다양한 성장인자 및 cytokine을 분비하고, 세포 외 기질은 종양세포의 성장, 생존 및 전이를 촉진한다.
특히 이러한 종양미세환경에 위치한 섬유아세포 (Cancer Associated Fibroblast, CAF)에서 분비된 HGF는 측분비 방식 (paracrine mode)으로 종양세포를 자극하여 다양한 생리적인 기능을 수행하게 된다. 실제로 암세포와 동시 배양한 섬유아세포(fibroblast)는 단독배양 시보다 많은 양의 HGF를 분비하는데 이는 종양세포와 주변조직이 상호작용을 하고 있음을 암시한다. 또한 HGF가 존재하는 환경에서는 Met 표적 치료제에 민감도가 달라질 수 있다. Pennacchietti 등의 연구에 따르면 Met의 증폭을 가지고 있어서 MET을 표적으로 하는 티로신 인산화 저해제(Tyrosine Kinase Inhibitor, TKI)에 매우 민감한 암세포일지라도 HGF가 존재하는 경우 항암활성이 저해되며, 이러한 저해는 HGF 중화항체인 ficalatuzumab 처리에 의해 회복될 수 있음을 확인하였다. 또한 비록 Met 증폭이 드문 종양일지라도 종양미세환경의 섬유아세포에서 분비된 HGF가 암세포의 성장, 이동 및 침윤에 영향을 줄 수 있으므로 HGF의 저해를 통하여 MET을 표적으로 하는 치료제의 효력을 향상 시킬 수 있다.
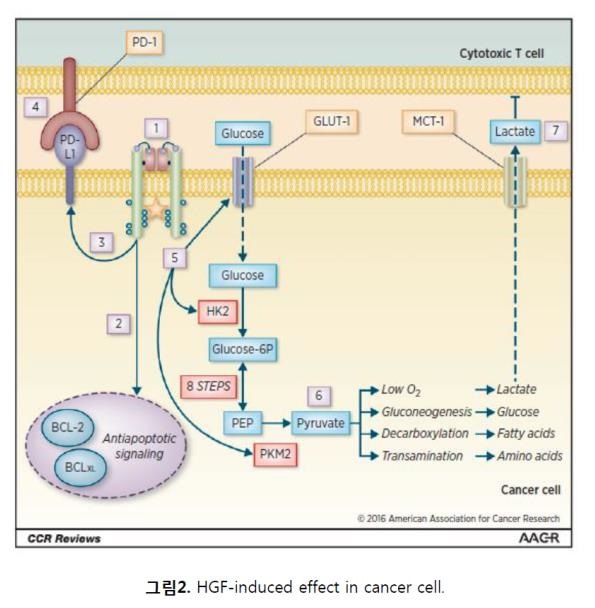
종양미세환경의 HGF는 당대사 조절에 영향을 미치기도 하는데, 지속적인 HGF에 의한 자극은 암세포로의 포도당의 유입과 세포표면의 포도당 transporter인 GLUT-1과 GLUT-4의 발현을 증가시킨다. 이러한 포도당의 유입은 에너지 소모가 많은 암세포에 특이적인 현상으로 와버그 효과 (Warberg effect)라고도 알려져 있다. Kaplan 등은 유방암 모델에서 HGF의 자극에 의하여 포도당의 소비와 젖산의 생성이 증가됨을 보고하였다. 또한 NSCLC 모델에서는 Met의 저해제인 PHA-665752의 처리에 의해 해당과정(glycolysis)의 개시에 중요한 효소인 hexokinase-2(HK2)가 하향조절(down regulation)되었으며, 또한 Met의 저해는 암세포에서 와버그 효과를 유지하는 핵심인자인 p-PKM2(Phosphorylated pyruvate kinase isoenzyme 2)를 감소시켰다. 이러한 결과는 종양미세환경의 HGF에 의한 자극이 당대사와 관련된 암세포의 저항성과 관련이 있을 수 있음을 시사한다 (그림2). 해당과정의 증가에 의해 암세포에서 생성된 다량의 젖산(lactate)은 MCT(Monocarboxylate transporters)에 의해 종양미세환경으로 배출되는데 실제로 HGF와 MCT-1/4의 mRNA 발현량은 높은 상관관계를 지니고 있다. 젖산은 단순히 해당과정에서 생성된 폐기물일 뿐이 아니라 암세포의 이동을 촉발하고 단핵구세포(monocytes)의 활성화와 이동을 억제하는 기능을 가지고 있다는 점을 고려할 때, HGF는 당대사에 관여하여 종양미세환경의 에너지 대사의 변화뿐만 아니라 면역작용에도 영향을 줄 수 있다.
3. HGF/c-MET 신호전달과 항암면역반응 (antitumor immune response)
종양미세환경에서 암세포와 면역계의 상호작용은 치료효과를 높이기 위한 전략으로 매우 중요하다. HGF/c-MET 신호전달은 면역반응과도 관련되어 있는데 HGF로 대식세포(macrophage)를 자극하면 항암활성을 지닌 M1 대식세포가 암세포의 성장을 유발하는 M2 대식세포로 분화함으로써 항암면역작용을 억제하게 된다. 또한 HGF/c-MET 신호전달은 세포독성 T 림프구 (Cytotoxic T Lymphocyte, CTL)의 증식과 활성화를 억제하는데, 이는 전술한 바와 같이 HGF/c-MET 신호전달에 의해 촉진된 암세포의 해당과정(glycolysis)에서 생성된 다량의 젖산에 의한 세포독성 T 림프구의 억제 때문이다. 중간엽줄기세포(Mesenchymal Stem Cell, MSC)에서 생성된 HGF는 STAT3 의존적으로 골수유래억제세포(Myeloid derived suppressor cell, MDSC)를 활성화하고 확장시킨다. 활성화된 MDSCs는 CTLs의 확장을 억제하고 더 나아가 조절 T 세포(Regulator T cell)를 확장시켜 면역 반응을 저해한다.
T 세포의 활성화는 수지상세포 (dendritic cell)에 의해서 조절되기도 한다. 자가면역성 뇌염모델(autoimmune encephalitis)에서 HGF는 강력한 면역조절 인자로서 수지상세포의 항원제시기능(antigen presenting function)을 저해하고 CD25+Foxp3+ 조절 T 세포의 성장을 유발하며 IL-10의 생성을 증가시킨다. 생성된 IL-10은 stem cell에서 수지상세포로의 분화를 억제하고 수지상세포의 apoptosis를 촉진시키는데 이러한 작용으로 암모델에서는 암세포가 CTLs로부터 보호된다. Multiple myeloma에서는 혈청 내 높은 수준의 HGF 농도가 질병의 진행과 면역계의 기능과 관련이 있는데 이는 Indoleamine 2,3-dioxygeanse I (IDO I)의 증가에 의한다. 또한 최근 보고에 의하면 HGF 자극에 의해 신장암세포는 PD-L1의 발현이 증가되며 이는 Met과 동시 발현(Colocalization)된다.
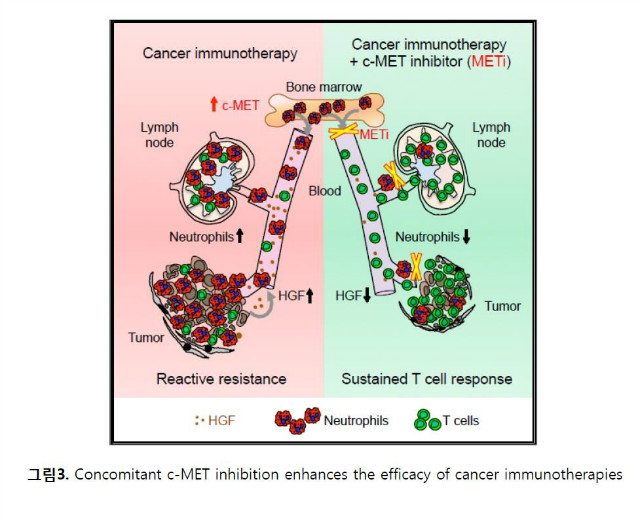
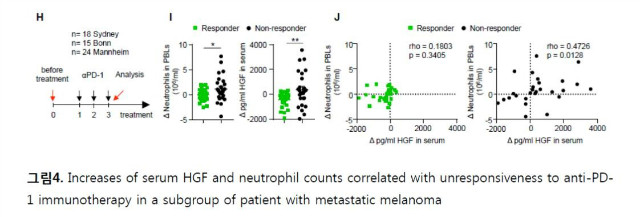
최근 HGF/c-MET 저해제가 T 세포 치료(adoptive T cell transfer) 나 면역관문억제제의 효과를 더욱 상승시킬 수 있는 가능성이 제시되었다. HGF/c-MET 저해제를 T 세포 치료(adoptive T cell transfer) 나 면역관문억제제와 동시에 사용할 경우, 종양부위로의 효과 세포 (effector T cell)의 침투(infiltration)를 증가시키고 이로 인해 면역치료의 효과가 증대될 수 있음이 보고되었다. 특히 이러한 상승효과는 종양세포의 내재적인 c-MET 의존성과는 관계가 없는데, 이는 기전적으로 c-MET의 저해가 면역치료로 유도되는 종양부위 및 draining 림프절로의 호중구(neutrophil)의 이동과 결집을 방해하기 때문이다. c-MET의 저해가 없다면 T 세포가 침투 (T cell-inflamed)된 종양미세환경에서는 호중구는 빠르게 면역억제 속성을 획득하게 되어 T 세포의 확장과 효과작용(effecter function)을 제한한다 (그림3). 특히 임상적으로 암환자의 높은 혈청 HGF 농도는 호중구의 숫자 및 면역관문억제제에 대한 낮은 반응률과 상관관계가 있다. 실제로 PD-1 항체 투여로 면역치료를 받은 전이성 흑색종(metastatic melanoma) 환자 57명을 대상으로 3회 투여 전 후의 호중구와 혈청 HGF의 농도를 분석한 결과, 비 반응군에서는 혈청 HGF 및 호중구의 수가 증가된 반면 반응군에서는 증가가 제한적이었다 (그림4). 이러한 결과는 HGF/c-MET 경로 억제를 통하여 종양부위로의 호중구의 이동과 면역억제기능을 제한함을 통하여 종양면역치료의 반응율 및 효과를 상승시킬 수 있는 가능성을 제시하고 있다.
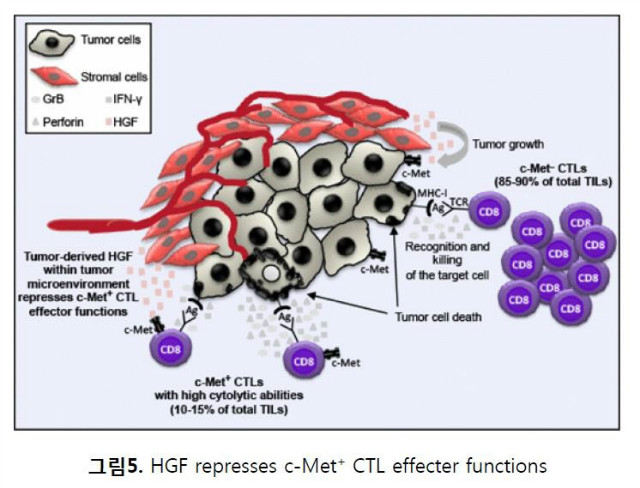
HGF는 세포독성 T 림프구의 기능을 조절하기도 한다. CD8+ 세포독성 T 림프구(CTL)는 항암면역에서 매우 중요한 세포로서 환자의 치료효과를 극대화 하는데 결정적인 역할을 한다. Mahdia 등의 보고에 따르면 마우스모델 실험을 통하여 CTLs의 일부(10~15%)는 c-Met을 발현(c-Met+ CTLs)하고 있으며, 이러한 c-Met+ CTLs는 c-Met- CTLs(85~90% of TILs)에 비하여 매우 강력한 세포분해활성(Cytolytic Capacity)을 지니고 있어 종양면역에 있어 매우 중요한 역할을 담당하고 있다. 종양미세환경에서 분비된 HGF는 이러한 c-Met+ CTLs에 작용하여 이의 기능을 무력화 시킴으로써 세포매개 세포독성(Cell mediated cytotoxicity)를 저해하여 CD8+ T 세포 매개 항암면역을 조절하고 있음을 전이성 흑색종에 대한 동물모델에서 확인하였다 (그림5).
4. HGF/c-MET 신호전달과 약물저항성
종양미세환경은 종양의 성장과 전이에 영향을 줄 뿐 아니라 치료제에 대한 내성을 부여한다. 화학 요법과 방사선을 포함한 기존의 항암치료법은 정상 세포와 암 세포를 구별하지 않기 때문에 부작용을 동반하지만 표적치료의 경우 종양세포 특이적인 기작 (예로 EGFR, BRAF, MET, HER2 신호)을 억제함으로 부작용을 최소화한다. 하지만 표적치료의 효과는 모든 환자에게서 동일하지 않은데 이는 각각의 종양이 서로 이질적인 특성을 가질 뿐만 아니라 동일 종양 내의 암세포일지라도 유전적 혹은 대사적으로 서로 차이가 있기 때문에 일부 환자만이 표적 치료에 반응하고, 일시적인 반응을 보였던 환자도 수개월 내에 다시 내성을 갖게 되어 표적 치료 방법의 효율성을 제한하게 된다. 이러한 관점에서 효과적이었던 항암치료에 저항성을 획득 하는 기전을 이해하고 이를 극복할 수 있는 분자표적을 발굴하는 것은 항암제 개발에 있어 매우 중요하다. KRAS의 변이에 의한 EGFR 억제제에 대한 저항성 획득기전은 잘 알려져 있다. 이와 더불어 종양미세환경에서의 HGF는 Snail1 과 Zeb1을 포함하여 EMT 관련 전사 인자의 발현을 유도함으로써 EMT(epithelial mesenchymal transition)를 촉진시킨다. EMT가 촉진된 세포는 세포 사멸에 저항성이 강하며 또한 치료 저항성이 있음이 입증되었다. 결과적으로 HGF는 EMT를 촉진하여 항암치료에 대한 내성을 부여하는 능력에 기여할 뿐만 아니라, 수용체인 MET의 활성화를 통해 EGFR, FGFR, BRAF, VEGF 및 HER2를 표적으로 하는 약물 치료에 대한 내성 유발에도 영향을 주고 있다.
또한 BRAF 변이 melanoma 환자는 RAF 저해제에 대해 선천적인 저항성을 보이는데 흥미롭게도 면역염색에서 기질세포에 의한 HGF 발현과 RAF 저해제 저항성 사이의 상관관계를 보여주었고, RAF 저해제와 HGF/c-MET 저해제와의 병용투여 시 약물저항성을 낮춰줄 수 있었다. 이는 HGF 또는 c-MET 저해제가 약물저항성이 있는 환자에 대한 치료옵션으로서의 가능성을 보여주는 것이다. 또한 Cetuximab과 같은 EGFR 타겟 항암치료 시, HGF 또는 HGF 생산 섬유아세포(HGF-producing fibroblast)가 종양세포의 내성을 야기하는 것이 보고되었으며, HGF/c-MET의 활성을 억제할 경우 대장암에서 EGFR 저해제에 대한 약물저항성을 극복할 수 있음이 보고되었다. 많은 비임상 결과 및 KRAS 변이가 없는 대장암 환자와 NSCLC 환자에서 증가된 HGF가 EGFR 저해제에 대한 낮은 치료효과와 연관이 있음을 보여주고 있어, EGFR와 MET 또는 HGF를 동시에 억제하는 것이 치료효과의 향상이나 내성극복의 대안이 될 수 있음을 시사하고 있다.
5. 맺음말
HGF/c-MET 신호 전달은 종양세포의 생성, 성장, 침윤 및 전이와 관련되어 있어 항암 치료의 매우 중요한 표적분자로 주목을 받고 있으며, 다양한 저분자 및 항체치료제의 개발이 진행 중에 있다. 이러한 종양 세포의 성장 및 전이 등과 관련된 암성장의 driver로서의 역할에 더하여 최근 에는 면역억제환경조성, EMT에 의한 치료저항성을 유발하는 등 종양미세환경의 조절과 관련된 다양한 기능을 수행하고 있음이 밝혀지고 있다.
먼저 종양미세환경에서 HGF는 암세포와 상호작용(cross-talk)을 통하여 암세포의 성장에 유리한 환경을 조성한다. 종양세포의 당 대사(glycolysis)의 패턴을 조절하여 암세포의 성장을 유발하고, 대사산물을 통해 종양미세환경을 면역저해환경으로의 전환을 유발하기도 한다. 또한 종양미세환경에서 면역세포는 HGF에 의해 M2 대식세포나 골수유래억제세포(MDSC)로 분화 촉진 및 수지상세포의 항원제시 기능의 저하 등을 통해 면역을 억제하는 방향으로 작용하기도 한다. 특히 면역관문억제제의 낮은 반응률이 HGF/c-MET에 의한 호중구의 종양부위로 이동 및 면역억제형질 획득과 관련되어 있어 HGF/c-MET 저해에 의해 항암면역치료의 효과를 상승시킬 수 있는 가능성 또한 제시되었다. 이와 더불어 종양미세환경에서의 HGF는 EMT를 촉진시켜 항암치료에 대한 내성을 부여하므로 특정 표적치료제와 HGF/c-MET 저해제의 병용은 항암치료의 내성 극복이나 기존 치료에 대한 민감성을 회복하게 한다.
이처럼 HGF/c-MET 신호전달은 종양미세환경에서 종양의 면역회피 및 치료저항성에 중요한 역할을 하고 있다. 따라서 HGF/c-MET 신호전달 억제를 통한 종양미세환경의 “정상화”는 면역관문억제제를 포함하는 면역치료제에 대한 반응을 증가시킬 뿐 아니라 다양한 항암치료에 대한 민감성 회복을 가능하게 하므로 HGF 항체를 포함하는 HGF/c-MET 저해제는 적절한 약물과의 병용을 통해 항암활성을 극대화 할 수 있을 것으로 기대된다.
6. 참고문헌
1. Scagliotti GV, Novello S, von Pawel J. The emerging role of MET/HGF inhibitors in oncology. Cancer Treat Rev. 2013, 39(7):793-801.
2. Matsumoto K, Umitsu M, De Silva D. M., Roy A. & Bottaro D. P. Hepatocyte growth factor/MET in cancer progression and biomarker discovery. Cancer Sci. 2017, 108: 296?307.
3. Hiroshi F, Toshikazu N. Hepatocyte growth factor: from diagnosis to clinical applications. Clinica Chimica Acta 2003, 327: 1?23.
4. Fasolo A, Sessa C, Gianni L, Broggini M. Seminars in clinical pharmacology: an introduction to MET inhibitors for the medical oncologist. Ann Oncol. 2013, 24(1):14-20.
5. Scagliotti GV, Novello S, von Pawel J. The emerging role of MET/HGF inhibitors in oncology. Cancer Treat Rev. 2013, 39(7):793-801.
6. Li H, Fan X, Houghton J. Tumor microenvironment: The role of the tumor stroma in cancer. J. Cell. Biochem. 2007, 101: 805?815.
7. Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis. Nat. Med. 2013, 19: 1423?1437.
8. Sun Y. Tumor microenvironment and cancer therapy resistance. Cancer Lett. 2016, 380: 205?215.
9. Knowles LM, Stabile LP, et al. HGF and c-Met participate in paracrine tumorigenic pathways in head and neck squamous cell cancer. Clin. Cancer Res 2009;15:3740-50
10. Pennacchietti S, Cazzanti M, Bertotti A, et al. Microenvironment-derived HGF overcomes genetically determined sensitivity to anti-MET drugs. Cancer Res 2014;74:6598-609
11. Kaplan O, Firon M, et al. HGF/SF activates glycolysis and oxidative phosphorylation in DA3 murine mammary cancer cells. Neoplasia 2000;2:365-77
12. Stefan H, Neil EB. HGF/Met Signaling in Head and Neck Cancer: Impact on the tumor microenvironment. Clin Cancer Res 2016;22:4005-4013
13. Nicole G, Tobias B, et al. Reactive neutrophil responses dependant on the receptor tyrosine kinase c-MET limit cancer immunotherapy. Immunity 2017;47:789-802
14. Mahdia B, Nicolas M, et al. Identification of a novel population of highly cytotoxic c-Met-expressiong CD8+ T lymphocytes. EMBO Rep. 2017;18:1545-1558
15. Owusu BY, Galemmo R, Janetka J, Klampfer L. Hepatocyte Growth Factor, a Key Tumor-Promoting Factor in the Tumor Microenvironment. Cancers 2017, 9(4): E35
16. Straussman R, Morikawa T, Shee K, Barzily-Rokni M, Qian ZR, Du J, Davis A, Mongare MM, Gould J, Frederick DT, et al. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature 2012, 487:500?504.
17. Luraghi P, Reato G, Cipriano E, Sassi F, Orzan F, Bigatto V, De Bacco F, Menietti E, Han M, Rideout WM 3rd, et al. MET signaling in colon cancer stem-like cells blunts the therapeutic response to egfr inhibitors. Cancer Res. 2014, 74: 1857?1869.
18. Takahashi N, Yamada Y, Furuta K, Honma Y, Iwasa S, Takashima A, Kato K, Hamaguchi T, Shimada Y. Serum levels of hepatocyte growth factor and epiregulin are associated with the prognosis on anti-EGFR antibody treatment in KRAS wild-type metastatic colorectal cancer. Br. J. Cancer 2014, 110: 2716?2727.
19. Kasahara K, Arao T, Sakai K, Matsumoto K, Sakai A, Kimura H, Sone T, Horiike A, Nishio M, Ohira T, et al. Impact of serum hepatocyte growth factor on treatment response to epidermal growth factor receptor tyrosine kinase inhibitors in patients with non-small cell lung adenocarcinoma. Clin. Cancer Res. 2010, 16: 4616?4624.
☞ 자세한 내용은 내용바로가기를 이용하시기 바랍니다.

