기술동향
알츠하이머병에서의 산화적 스트레스와 아밀로이드 베타 펩타이드
- 등록일2019-10-10
- 조회수9038
- 분류기술동향 > 레드바이오 > 의약기술
-
자료발간일
2019-09-26
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#알츠하이머#산화적 스트레스#아밀로이드 베타 펩타이드
- 첨부파일
알츠하이머병에서의 산화적 스트레스와 아밀로이드 베타 펩타이드
< 목 차 >
1. 서론
2. 산화적 스트레스와 알츠하이머병의 연관성
2.1. 알츠하이머병의 정의와 특징
2.2. Aβ와 아밀로이드 플라크의 형성
2.3. 주변 분자들의 산화
2.3.1. AD에서의 산화적/질산화적(nitrosative) 스트레스의 증거
2.3.2. 막의 상태와 단백질의 기능에 영향을 미치는 생체 분자 산화의 결과
3. AD에서 금속의 영향
3.1. 뇌에서의 금속의 역할
3.2. AD에서의 오조정(misregulation)
3.3. 금속과 산화적 스트레스
4. Aβ 펩타이드와 ROS 생성
4.1. Aβ와 금속 이온의 조화
4.1.1. Zn(II)와 Aβ의 배위 결합
4.1.2. Cu(II)와 Aβ의 배위 결합
4.1.3. Cu(I)와 Aβ의 배위 결합
4.1.4. Fe(II)와 Aβ의 배위 결합
4.2. Aβ-금속에 의한 ROS 생성
5. Aβ에 의한 산화적 손상
5.1. 체외에서의 금속 촉매에 의한 산화(metal-catalyzed oxidation, MCO) 과정 중, Aβ 잔기의 손상
5.1.1. 아스파르트산의 산화
5.1.2. 히스티딘의 산화
5.1.3. 페닐알라닌의 산화
5.1.4. 티로신의 산화
5.1.5. 메티오닌의 산화
5.1.6. 기타 절단
6. 전망과 앞으로의 연구
----------------------------------------------------------------------
1. 서론
에너지 변환은 생명의 가장 근본적인 작용 중 하나이다. 에너지 변환은 생명의 근원부터 존재했으며, 이온이 반투막을 통과하는 것과 같은 기본적인 메커니즘은 모든 살아있는 생물에 존재한다. 이온 농도 구배(gradient)를 ATP와 같은 화학적 에너지로 변환시키는 효소의 전반적인 디자인은생물 전반에 걸쳐 동일하다.
전자 전달 반응은 막을 경계로 이온 농도 구배를 형성하는데 사용된다. 바꾸어 말하면, 이는전자들이 첫 번째 공여자에서 시작하여 몇몇 중간체를 거쳐 최종 수용체에 전달되는 산화-환원 반응이다. 인간, 동물, 수많은 다른 생물체에서의 최종 전자 수용체는 dioxygen이다. 이 최종 전자 수용체의 장점은 높은 산화-환원 잠재력이며, 이로 인한 반응에서의 높은 에너지이다.
O2 + 4 e? + 4H+ → 2H2O (1)
원칙적으로 전자 공여자는 우리가 섭취한 음식물이다. 우리의 삶에 필요한 에너지는 음식물과 O2의 산화-환원 반응으로부터 유래한다. (1)번 반응에서, O2는 네 개의 전자와 네 개의 양성자를받아들이고, 두 개의 물 분자를 생산해 낸다. (2)번 반응에서, 부분적인 O2의 환원이 superoxide ani-on (O2??), 과산화수소(H2O2), 그리고 수산화 라디칼(hydroxyl radical:HO?)을 만들어낸다.
+e? +e? + 2H+ +e?
O2 → O2?? → H2O2 → HO? + HO? (2)
이러한 중간산물들은 HO?처럼 매우 반응성이 커서 조절하기 힘든 물질이거나, (O2?? + NO → peroxynitrite 반응에서처럼) 반응성이 크고 조절하기 힘든 물질로 쉽게 바뀌는 전구체들이다. O2와 유기(organic) 전자 공여자의 반응이 열역학적으로는 유리하지만, 이는 O2의 삼중 기저 상태에 의해동역학적으로 저해된다. 그러므로 (1)번 반응은 부분적인 환원 반응이 일어나는 (2)번 반응이 거의 일어나지 않도록 잘 조절될 수 있다. 부분적으로 환원된 산소 종류들인 O2??, H2O2, HO?는 활성산소종(reactive oxygen species;ROS)에 포함된다. ROS는 반응성을 가진 산소를 포함하는 화학물질이라고 정의된다. 산소를 최종 전자 수용체로 이용하는 호기성 환경 내에 존재하는 생명체는 결과적으로 몸속에서 지속적으로 ROS를 생성하게 된다. ROS는 효소적으로 (예를 들면 대식세포(macrophage)가 침입자를 죽이기 위해) 혹은 부반응으로 비효소적으로 생성된다. 후자는 거의 모든 생리적 반응이 (1)번 반응인 호흡 연쇄(respiratory chain)에서 일어나는데, 이 때 원치 않는 부반응이 ROS를 생성하게된다. 몸에서 만들어진 대부분의 ROS는 호흡 연쇄에서 생성되고, 위험성을 안고 있다. 그러므로 몇몇 효소와 작은 물질들이 ROS의 양을 조절하기 위해 존재한다. 일반적으로 ROS는 적은 양으로 유지되며 완전히 제거되지는 않는다. ROS는 세포 신호 전달 기능도 있기 때문에, 전체적인 억제는 해롭다. 많은 양의 ROS의 축적은 위험하고, 이는 산화적 스트레스(oxidative stress)라고 정의되어 있다.
ROS의 제거는 항산화물질에 의해 다양한 기전으로 일어나게 된다. 항산화물질을 정의하자면, 산화될 수 있는 기질 보다 적은 양으로 기질의 산화를 저해하거나 막을 수 있는 내인성 혹은 외인성 물질이다. ROS 제거의 다양한 기전으로는 i) ROS의 포식(scavenging of ROS), ii) ROS의 제거 (quenching of ROS), iii) 내인성 항산화제의 재생산(regeneration of endogenous antioxidants) 같은 것들이 있다.
알츠하이머나 파킨슨병과 같은 신경변성질환(neurodegenerative disease)에서 뇌는 산화적 손상을 보이고, 많은 경우에 산화적 스트레스가 관련되어 있음을 볼 수 있다. 뇌는 특별히 산화적 스트레스에 의한 산화적 손상을 잘 입는데, 이는 뇌가 매우 많은 양의 산소를 소비하기 때문이다(신체전체 소비량의 20%). 비록 몇몇 신경변성질환에서 산화적 스트레스의 발생이 비교적 잘 알려졌으나, 이것이 질병의 원인인지 결과인지에 대해서는 답하기 힘든 상황이다.
2. 산화적 스트레스와 알츠하이머병(Alzheimer’s disease; AD)의 연관성 2.1. AD의 정의와 특징
2.1. AD의 정의와 특징
1907년, Alois Alzheimer는 “대뇌 피질의 특이한 질병에 관하여”라는 논문에서 기억력 상실, 방향감각 상실, 환각, 인지 장애로 고통받고 있는 51세 환자의 경우에 대해 언급하였다. 이 환자의사후 조사를 통해,“특이한 물질이 뇌 피질에 쌓임”으로 인한 “신경섬유의 놀라운 변화”와 “미세한 군사 초첨(minute military foci)”이 환자의 위축된 뇌에서 발견되었다. 한 세기가 지나서, AD이라는 이름이 붙여진 이 “특이한 질병”은 아직까지도 원인이 밝혀지지 않은 가장 흔한 신경변성질환이 되었다.
World Alzheimer Report에 따르면, 2015년 현재, 4,680만명이 치매로 고통받고 있다. 이는 20년마다 두 배씩 증가할 것으로 예상된다. 65세 이상의 약 5-8%, 75세 이상의 15-20%, 85세 이상의 25-50%가 치매에 걸린다. 유럽과 아프리카의 환자수가 각각 2,050만명, 940만명인데 비해, 아시아(2,290만명)의 환자수가 가장 많다.
AD는 점차적인 인지 기능의 감퇴가 특징인데, 이는 상당한 정도로 뇌의 부피가 줄어드는 것과 상관성이 있다. 이러한 뇌의 위축은 특히 기억과 방향을 담당하는 해마에서의 시냅스의 퇴화와신경세포 사멸의 결과이다. AD의 최대 위험 요소는 연령인데, 85세가 넘어가면 발병률이 50%에 이른다. 여성의 수명이 더 길고, 폐경으로 인한 에스트로겐의 감소가 AD의 발병을 증가시키기 때문에, 여성이 남성에 비해 AD에 더 취약하다.
전반적인 뇌 부피의 감소 외에도, Alois Alzheimer가 처음 언급했던,“ 특이한 물질이 피질에쌓임”으로 인한 뇌의 아밀로이드 플라크(amyloid plaque)는 AD의 특징 중 하나이다. 노인성 반점(senile plaque)이라고도 불리우는 이 플라크는 AD 환자의 해마의 세포 바깥 공간에서 발견된다. 이는 주로 아밀로이드 베타(Amyloid-β)라는 펩타이드(Aβ)로 구성되어 있는데, 이는 서로 엉겨 붙어 있고, 대부분 β-sheet 구조가 많은 섬유질이다. 또 하나의 특징은 파킨슨병에서도 발견되는 과인산화된타우(Tau) 단백질로 이루어진 신경섬유엉킴(neurofibrillary tangle)이 뇌세포 안에 존재한다는 것이다. 세포 내 미소관(microtubule)과 연관된 이 단백질은 튜블린(tubulin)과 결합하여 미소관을 안정화 시킨다. AD와 파킨슨병에서는 Aβ가 p38 MAPK을 활성화 시키고, 활성화 된 p38 MAPK가 타우를 비정상적으로 인산화 시킨다. 이는 신경세포 안에서 헬릭스 구조의 쌍을 이루고 있는 필라멘트를 신경섬유엉킴의 형태로 축적시켜서 미소관을 불안정하게 하고, 신경의 기능을 잃게 만든다.
2.2. Aβ와 아밀로이드 플라크의 형성
Aβ는 아미노산 38-43개로 이루어진 DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIAT의 시퀀스를 가진 펩타이드이다. 여러 조직 특히 중추신경계에 존재하는 타입 1 트랜스 멤브레인 단백질인 아밀로이드 프리커서 프로테인(Amyloid precursor protein; APP)이 β- 와 γ-secretase에 의해 잘려 생성된다. 신경에 존재하는 APP의 주요한 아이소폼은 695개의 아미노산 잔기를 가지고 있다. 비록 생리적 기능은 아직 알려지지 않았지만, APP는 뇌의 발달, 기억과 시냅스 가소성에 중요한 역할을 할 것으로 생각된다. APP는 서로 다른 두 가지 경로로 대사 된다 (그림 1). 비아밀로이드 경로(우세함)에서는 APP가 먼저 α-secretase에 의해 절단되고, 그리고 나서 γ-secretase에 의해 절단되어Aβ17-40 (P3) 펩타이드를 형성하거나 β-secretase에 의해 절단되어 Aβ1-16 펩타이드를 형성한다. 경미한정도로 일어나는 아밀로이드 대사 경로에서는 APP가 β-secretase, γ-secretase에 의해 차례대로 절단되어 온전한 Aβ 펩타이드(주로 Aβ1-40/42)가 생성된다. 두 경로 모두 먼저 N 말단 조각(secreted APP (sAPP) α 혹은 β)과 C 말단 조각(CTF83 혹은 CTF99)을 생성한 후, N 말단 APP intracellular domain (AICD)를 생성한다. AICD는 세포 핵의 신호 전달에 관여되어 있다. γ-secretase의 절단 위치에 따라, Aβ1-38에서부터 Aβ1-43까지 여러 가지 길이의 펩타이드가 생성된다. 뇌에서 가장 많이 생성되는 종류는 Aβ1-40이고 그 다음으로 Aβ1-42가 많이 생성된다. APP 절단의 세 번째 방법은 최근에 발견되었다.
여기에는 APP의 504-505 아미노산 사이를 절단하는 η-secretase가 관여되는데, α-와 β-secretase에의해 2차로 절단되고 나면, 더 큰 분자량을 가진 C 말단 조각인 Aη-α와 Aη-β가 생성되게 된다. Aη-α는 Aβ1-16을 포함하고 있으며, 신경 독성이 있다고 알려져 있다.
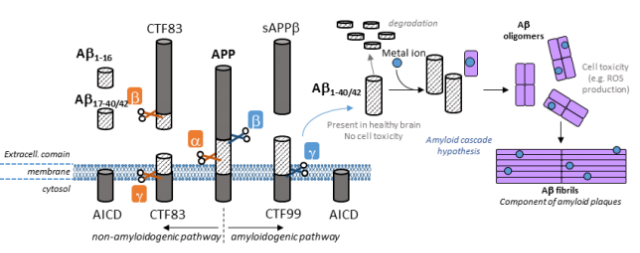
그러므로, Aβ 펩타이드는 APP 대사 중 주요하지 않은 대사 경로로부터 생성되는 것이다. 건강한 뇌에서는 신경 활동을 하는 동안 주로 엔도좀 같은 세포 내 소낭(vesicle)에서 생성되어서 세포밖 공간으로 분비된다. Aβ는 뇌의 Aβ 양을 조절하는 Aβ-degrading protease (AβDP)에 의해 분해된다.
Aβ가 신경 가소성과 기억에 작용할 수도 있겠지만, 아직 Aβ의 기능은 아직 잘 알려져 있지 않다.AD는 산발적이고 고령에 발생하는 가장 흔한 형태와 5% 미만으로 발생하는 가족 유전성이거나 조기 발병하는 두 가지 형태가 있다. 다운증후군(3염색체성 21 (trisomy 21)이라고도 불리우는)을 앓고 있는 사람들은 조기 발병 AD의 위험성이 높다. 왜냐하면 그들은 21번 염색체를 추가로 더 가지고 있는데, 이 부위에 APP를 생성하는 유전자가 존재하기 때문이다. ApoE (Aβ의 제거에 관여하는)의 돌연변이는 고령에 발병하는 AD의 가장 흔한 유전적 위험 인자로 간주되고 있는 반면에, APP와 Presenilin 1, Presenilin 2 (γ-secretase의 두 개의 서브유닛)를 코딩하는 AD의 원인 유전자로 알려진 몇몇 유전자들의 돌연변이는 주로 조기 발병 AD의 원인으로 알려졌다. PSEN1과 PSEN2 유전자의 돌연변이는 더 많은 Aβ 생성으로 이어지고, PSEN1의 돌연변이는 특히 Aβ1-42의 형성을 증가시킨다.
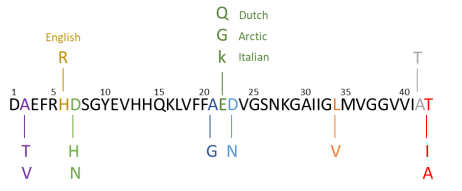
Alzheimer Disease & Frontotemporal Dementia Mutation Database에서 보면, APP에 65개의 돌연변이 가 존재하는데, 이 중 15개만이 비병원성이다. APP의 돌연변이는 Aβ 부분에서 발생할 수도 있기 때문에, β- 와 γ-secretase에 의한 APP의 절단이 변형된 Aβ의 형성을 야기할 수 있다(가장 흔한 경우는 그림 2에 정리했음). 돌연변이는 세 가지 카테고리로 나뉘어진다.
β-secretase의 절단 부위(N 말단), γ-secretase의 절단 부위(C 말단), 그리고 Aβ 부위의 중간 부분의 돌연변이이다. γ-secretase의 절단 부위의 돌연변이는 절단 부위를 변경시킬 수 있고, Aβ1-42/Aβ1-40의 비율을 증가시킬 수 있다. β-secretase의 절단 부위의 돌연변이는 β-secretase에 의한 APP의 절단 속도를 증가시킨다. APP에 포함되어 있는 Aβ의 중간 부분의 돌연변이는 Aβ가 올리고머나 섬유질을 형성하려는 경향성을 증가시켜 Aβ의 뭉침에 영향을 준다.
AD는 많은 요소로 구성된 질병이며 이 질병과 연관된 다양한 메커니즘은 아직 명확하지 않다. Aβ가 건강한 뇌에서는 용해성 있는 형태로 발견되었으나, AD 환자의 뇌에서는 뭉쳐진 형태로 발견되었기 때문에, 노인성 반점의 형성을 설명하는 한 가설이 제시되었다. 비록 여전히 논쟁의 여지가 있음에도 불구하고 1990년대 전기에 형성된 아밀로이드 케스케이드 가설(그림 1)이 AD의 발생에서 우세한 모델이다. 이 가설은 세포 밖 Aβ 양의 비정상적인 증가로 Aβ가 뭉쳐 β-sheet이 많은 구조를 형성하게 만든다고 한다. 뭉침 현상은 올리고머를 형성하면서 시작된다. 이 올리고머는 아밀로이드 플라크에서 발견되는 protofibril과 fibril로 재배열 된다. AD 환자의 뇌 안에서 축적되는 올리고머는 특별히 세포막을 투과하여 세포의 기능 장애나 죽음을 일으킬 수 있기 때문에, 더욱 독성이 있는 종류로 알려졌다. 이 가설에 따르면, 세포 내의 신경섬유엉킴의 형성이나 시냅스 기능의 파괴와 같은 현상이 이러한 현상에 의해 일어날 수도 있다고 한다. 이러한 일련의 과정에 영향을 주는 요인들이 조절인자이다. 산화적 스트레스, 아연, 철, 구리와 같은 금속 이온들이 이런 조절인자들이며, 이조절인자들은 아밀로이드 플라크에서 발견되었다. 어떤 신경에서는 구리와 아연이 시냅스 사이로 배출된다. 아밀로이드 케스케이드 가설에 따르면, 구리와 아연은 Aβ와 결합하여서 단백질 뭉침 과정을조절할 수 있기 때문에, 단백질의 뭉침 현상에 있어서 중요한 역할을 할 것으로 생각된다. 구리와 아연은 생성된 단백질 뭉치의 형태에 영향을 미침으로써 동역학 혹은 열역학에 작용한다. 게다가 구리와 같이 산화-환원 작용이 활발한 금속 이온과 함께 뭉쳐진 아밀로이드 단백질 응집체(낮은 분자량)는 Aβ 펩타이드 그 자체와 주변 생체 분자에 유해한 ROS를 생성할 수 있기 때문에, 더욱 독성이 있는 것으로 여겨진다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식


 pdf_0003323.pdf
pdf_0003323.pdf