기술동향
알코올성 간질환 치료를 위한 간성상세포의 기능 연구에 대한 동향
- 등록일2019-10-10
- 조회수7591
- 분류기술동향 > 레드바이오 > 의약기술
-
자료발간일
2019-09-27
-
출처
지능형바이오시스템 설계및합성연구단
- 원문링크
-
키워드
#올코올성 간질환#간성상세포#만성간질환
- 첨부파일
알코올성 간질환 치료를 위한 간성상세포의 기능 연구에 대한 동향
1. 개요
알코올성 간질환은 단순 지방간염부터 심각한 질환인 섬유화, 경변증 및 간암에 이르는 폭넓은 범위를 보이는 일련의 질환군이며, 전 세계적으로 만성간질환의 가장 흔한 형태로 높은 유병률과 사망률을 나타내는 질환이다. 알코올성 간질환 치료의 초석은 금주에 있지만 금주를 시행한 환자의 약 30%에서만 간조직의 정상화를 볼 수 있었고, 나머지 환자들은 알코올성 간염이 지속되어 간경변증에 이르게 된다. 이러한 사실만을 놓고 볼 때 금주가 간의 완전한 회복을 보장하지 않으며 다른 추가적인 요인의 조절이 중요한 것으로 보인다.
코티코스테로이드는 알코올성 간질환의 치료에 있어서 40년 동안 꾸준히 사용되어 왔고, 현재 미국간학회와 유럽간학회의 치료지침에 의하면 중증 알코올성 간염 환자의 치료에 강력히 추천되는 약물이다. 그러나, 코티코스테로이드가 단기 생존율을 높일 수는 있지만, 6개월 사망률의 위험은 30-40%로 높게 보고되고 있고, 코티코스테로이드에 반응하지 않는 환자군 아형도 존재한다. 코티코스테로이드 외에 항 종양괴사인자 치료 (anti-tumor necrosis factor antibody), 펜톡시필린 및 항산화물질 등이 알코올성 간염 치료에 사용될 수 있지만, 이렇게 다양한 약제가 사용되는 것은 알코올성 간염의 치료기작이 확실하게 알려져 있지 않고 이에 대한 추가적인 연구 및 치료제 개발이 필요함을 시사한다.
이전의 연구들에서 알코올 분해시 아세트알데히드 부산물의 생성, 알코올 대사 유래 산화적 스트레스에 의한 활성산소(Reactive Oxygen Species, ROS)의 생성, 비정상적인 메티오닌 대사와 글루타치온 고갈과 같은 간세포 내에서 알코올 대사의 이상에 초점을 맞추어 진행 되었다면 최근에는 실질세포인 간세포(hepatocyte)와 비실질세포들(non-parenchymal cels) 간의 상호작용이 알코올성 간질환의 발병기전에 중요한 역할을 함이 밝혀지고 있다. 예를 들어, 간세포와 인접한 비실질세포인 간성상세포(heptic stelate cel)와 쿠퍼세포(Kupfer cel)가 직접적으로 간세포와의 상호작용을 통해 또는 간내 다양한 면역세포와의 간접적인 상호작용을 통해서도 알코올성 간질환의 발생과 진행에 영향을 미친다는 것이 보고되고 있다. 따라서 본 동향소개에서는 알코올성 간질환의 병태생리에 중요한 간내 비실질세
포들과 면역세포들의 역할에 대해 소개하고, 세포간 상호작용에 중요한 역할을 하는 세포외소포체의 역할과 이를 표적으로 하는 알코올성 간질환의 치료법의 개발 가능성에 대해 고찰해 보고자 한다.
2. 알코올성 간질환에서 비실질세포들의 기능 연구동향
1) 알코올성 지방간 (Alcoholic steatosis, faty liver)의 발병기전
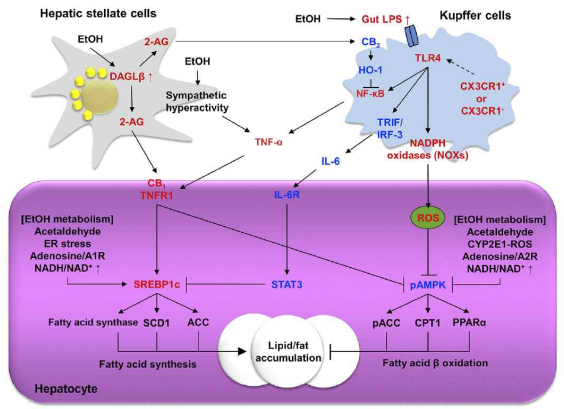
지방간은 만성 음주의 가장 흔한 형태로 나타나는 질환으로 간세포 내 중성지방의 비정상적인 축적을 특징으로 한다. 간세포내 지방 축적의 주요 기전은 신생지질생성의 주요 조절인자인 sterol regulatory element-binding protein 1c (SREBP1c)의 유전자 발현이 증가하고 이와 반대로 유리 지방산(fre faty acid)의 합성과 수송 조절에 중요한 역할을 하는 peroxisome proliferator-activated receptor α (PARα)의 유전자 발현감소를 통해 지방 대사 불균형에서 기인한다. 에탄올은 직접적으로 SREBP1c 유전자 전사를 증가시키고, 간세포 내에서 PARα 활성을 억제하고, 간접적으로는 세포질 세망(Endoplasmic reticulum, ER)의 스트레스 반응과 싸이토크롬 효소(cytochrome P450 2E1, CYP2E1) 발현 증가에 의해 유래되는 산화적인 스트레스와 엔도카나비노이드 신호전달 기전을 통해 지방 대사의 불균형을 초래한다(그림 1).
1-1) 알코올성 지방간에서 쿠퍼세포의 다양한 역할
간내 상주 대식세포인 쿠퍼세포는 알코올 섭취에 의해 증가된 장내 미생물이 분비하는 리포폴리사카라이드 (LPS; Lipopolysacharide) 가 쿠퍼세포의 톨유사수용체 (tol-like receptor 4, TLR4)에 결합해 tumor necrosis factor (TNF)-α, 인터류킨 (IL; Interleukin)-1, IL-6, ROS 와 같은 염증매개물질의 생성을 촉진한다. 이 중 TNF-α 는 알코올성 지방간의 발생에 중요한 역할을 하는 싸이토카인이다. TNF-α 는 마우스와 인간의 간내 SREBP1c 의 전사를 증가시켜 간내 지방산의 합성을 증가시키는 것으로 알려져 있다. 이와는 대조적으로 쿠퍼세포/대식구에 의해 분비되는 인터류킨(IL)-6 는 간세포 내 signal transducer and activator of transcription (STAT) 3를 활성화 시켜 알코올성 지방간을 보호하는 작용을 한다. 또한 합성 double-stranded RNA 인 polyinosinic-polycytidylic acid (poly I:C) 자극에 의해 활성화된 TLR3 는 쿠퍼세포와 간성상세포에서 IL-10 분비를 통해 알코올성 지방간을 완화시킨다고 보고되고 있다.
1-2) 간성상세포와 엔도카나비노이드 시스템
정상적인 상태에서 휴지기의 간성상세포는 우리 몸의 레티놀 (비타민 A)을 지방 방울로 저장하면서 레티노이드 항상성을 조절한다. 여러 원인에 의해 간손상이 생기면 간성상세포는 활성화되어 유사 근섬유아세포(myofibroblast-like cel)로 분화해서 세포외 기질(extracelular matrix)의 생산이 촉진되어 간섬유화(liver fibrosis)를 유도한다. 그러나 알코올 섭취시 간성상세포는 엔도카나비노이드(endocanabinoid)를 분비하게 되고 간세포의 카나비노이드 수용체 (CB1)에 결합해 마리화나와 유사한 신호전달을 하게 되어 지방산의 신생합성은 증가되며 반대로 산화작용은 감소되어 결과적으로 알코올성 지방간이 유발된다는 것이 보고되었다. 두 가지의 주요한 엔도카나비노이드인 arachidonoyl ethanolamide (anandamide, AEA) 와 2-arachidonoylglycerol (2-AG) 중 만성 음주시 마우스 간성상세포에서 2-AG 분비가 촉진되고, 간세포에서 CB1를 활성화시키며 카나비노이드 수용체 길항제인 리모나반트 (Rimonabant) 처리 또는 CB1 수용체 결손에 의해 알코올성 지방간이 완화된다. 흥미로운 내용은 간세포의 CB1 수용체 활성화는 CYP2E1 매개 산화적 스트레스를 더욱 촉진한다는 사실이다. CB1 수용체와는 대조적으로 CB2 수용체는 알코올성 간염과 지방간을 보호하는 효과를 가지고 있다. 쿠포세포에서 CB2 수용체가 활성화되면 heme oxygenase-1 (HO-1) 유전자 발현이 증가해 LPS 유도의 nuclear factor-κB (NF-κB) 의 활성과 M1 형태로의 변화를 억제해 지방간을 완화시키는 것으로 알려져 있다. 1-3) 간 동모양 내피세포(liver sinusoidal endothelial cel)의 특징적인 역할간손상시 간 동모양 내피세포들은 구조적인 변화를 겪게 된다. 간 동모양 내피세포의 천공들(fenestrae)은 급, 만성 알코올 섭취에 의해서도 영향을 받는데 급성 알코올 급여시 간 동모양 내피세포의 천공 직경이 증가되나 12주 이상의 만성적인 음주시 간 동모양 내피세포의 천공 수가 급격히 감소하는 것이 보고되었다. 따라서 알코올 섭취는 간 동모양 내피세포의 기능과 구조에 영향을 주어 인접한 비실질세포인 쿠퍼세포와 간성상세포와의 상호작용을 통해 알코올성 지방간의 발달에 영향을 미친다.
2) 알코올성 지방간염 (Alcoholic steatohepatitis)의 발병기전
2-1) 장내세균의 과증식과 미생물총의 불균형
폭음자들은 비음주자와 비교했을 때 장내 Bacteroidetes의 비율이 낮고, Proteobacteria의 비율이 높은 미생물총의 불균형을 보여 내독소의 양이 증가되어 있다. 실제로 프로바이오틱스는 마우스 모델에서 장내 미생물총을 회복시켜 주어 간염을 완화시켜주었다.
2-2) 선천성 면역(Inate immunity)의 관여
쿠퍼세포에서 톨유사수용체(tol-like receptor 4, TLR4)의 활성화는 MyD8 의존적 또는 비의존적 경로를 통해 인터페론 조절인자 3 (IRF3; interferon regulatory factor 3)를 활성화시켜 TNF-α, IL-6 및 monocyte chemotactic protein (MCP)-1과 같은 염증성 싸이토카인과 1형 인터페론 (type I interferons)의 생성을 촉진한다. 흥미롭게도 알코올성 간질환에 중요한 쿠퍼세포의 2개의 아형이 있는데 하나는 CD1b+F4/80highCX3CR1+ 가 있고, 다른 하나는 CD1b+F4/80highCX3CR1- 가 있다. 만성 음주시 CX3CR1+ 인 전자의 쿠퍼세포는 CX3CR1- 인후자의 쿠퍼세포에 비해 TNF-α 와 IL-1β 발현이 상대적으로 높아 좀 더 염증성 표현형을 보인다. 또한 쿠퍼세포 내의 nicotinamide adenine dinucleotide phosphate oxidase (NOX) 매개 ROS 의 생성은 염증성 신호를 증가시킴으로 알코올성 간손상에 영향을 준다. 반면 IL-2 는 간세포 내 STAT3를 활성화시켜 간보호 효과(항산화, 항세포자멸, 항지방간, 증식과 항미생물 효과)를 가진다고 알려져 있다. 쿠퍼세포 외 만성 음주시 단핵구/대식세포의 축적이 유도되는데, 침윤한 대식구는 Ly6C의 발현 비율의 차이에 따라 Ly6C+ 대식구와 Ly6Clow 대식구로 구분된다. Ly6C+ 대식구는 염증성 표현형을 보이는 반면 Ly6Clow 대식구는 항염증성 표현형을 보인다. 쿠퍼세포와 비교했을 때 침윤성 대식구는 알코올성 간질환의 발생에 중요한 역할을 하는 것으로 알려져 있다. 백혈구(호중구) 침윤은 알코올성 지방간염의 중요한 특징으로 LPS 에 대한 염증성 반응을 배가시킨다. 최근 연구에 따르면 급성 폭음을 동반한 고지방식이는 CXCL1 (C-X-C motif chemokine ligand 1) 의 발현을 유도해 간내 호중구의 침윤을 증가시킨다는 것이 알려져 있다. 알코올성 간염 환자에서 IL-8, CXCL1, IL-17 과 같은 다양한 염증성 매개물질이 증가되어 호중구의 침윤을 증가시키고 알코올성 간염을 악화시킨다. 게다가 알코올 중독환자와 설치류의 급만성 에탈올 모델에서 microRNA-23 은 알코올성 지방간염에서 호중구의 침윤에 중요한 조절인자로서 알려져 있다.
2-3) 후천성 면역(Adaptive immunity)의 관여
선천면역 뿐만 아니라 후천성 면역 역시 알코올성 지방간염의 진행에 영향을 미친다. 장기적인 알코올 섭취는 간내 지질 과산화산물에 대한 항체와 T 세포의 수를 증가시킨다. 최근 보고에 따르면 쿠퍼세포의 인플라마좀(inflammasome)의 활성화로 인해 IL-1β가 증가하고 NKT 세포의 활성화에 의해 간세포의 세포자멸사가 유도되어 알코올성 간손상이 촉진된다. 또한 NKT 세포는호중구의 간내 이동을 촉진시켜 알코올성 지방간염 발생에 중요한 역할을 한다.
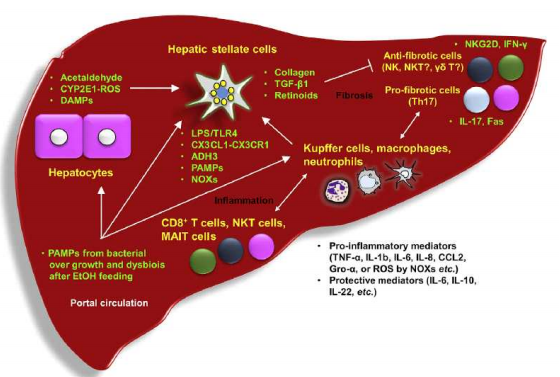
3) 알코올성 간섬유화 (Alcoholic liver fibrosis)의 발병
기전만성 음주는 간섬유화의 주요 원인 중의 하나이다. 일반적으로 평균 25년 이상 매일 40-80 g을 음주 시 40-60% 의 환자에서 간섬유화의 초기단계인 간정맥주위 섬유화가 발생한다. 활성화된 간성상세포가 생산하는 세포외기질의 증가가 만성 간손상의 주요 원인 중의 하나인데 최근 보고에 따르면 활성화된 간성상세포와 쿠퍼세포 혹은 림프구들과의 세포-세포간
의 상호작용이 알코올성 간섬유화시 주요 특징으로 알려져 있다. 먼저 알코올 대사에 의해 생성된 아세트알데히드가 인접한 간성상세포를 활성화시켜 콜라겐과 TGF-β1을 생산하게 하고, 쿠퍼세포에서 TLR4 매개 NOX 활성화에 의해 생성된 활성산소가 간성상세포를 활성화시켜 간섬유화를 가속화시킨다. 기존에 알려진 기전 외에 간성상세포와 NK 세포, 면역 세포간의 세포-세포 상호작용이 알코올성 간섬유화의 발생에 중요한 역할을 한다는 것이 증명되었다 (그림 2).
3-1) 활성화된 간성상세포와 NK 세포의 상호작용
NK 세포는 natural kiler group 2 member D (NKG2D) 와 TNF-related apoptosis and inducing ligand (TRAIL) 의존적인 방법으로 활성화된 간성상세포를 사멸시켜 간섬유화의 예방에 중요한 역할을 한다. 하지만, 휴지기의 간성상세포는 NK 세포 활성화 리간드인retinoic acid early inducible 1 (RAE1)의 발현은 감소되어 있는 반면 NK 세포 억제 리간드인 major histocompatibilty complex-1 (MHC-1) 의 발현은 증가시켜 간성상세포 사멸을 회피한다. 또한 NK 세포는 인터페론(interferon, IFN)-γ를 생성해 STAT1 의존적으로 간성상세포의 세포주기를 억제해 간섬유화 발생을 억제한다. 하지만, 만성 음주시 NK 세포의 NKG2D 발현이 억제되고 IFN-γ 발현이 감소하기 때문에 간섬유화가 촉진된다. 또한 알코올 탈수소효소 3 (ADH3) 는 레티놀 대사로 매개되는 TGF-β 의 생성을 통해 NK 세포를 억제해 간섬유화를 촉진하는데 중요한 역할을 하는 것으로 알려져 있다. ADH3 결손 또는 4-methylpyrazole 에 의한 ADH3 억제 시 NK 세포 활성화에 의해 간섬유화가 완화된다. 따라서 ADH3 는 간섬유화의 치료용 타깃으로 가능성이 있을 수 있겠다. 3-2) 활성화된 간성상세포와 면역 세포의 상호작용 NK 세포 뿐만아니라 NKT 세포는 간섬유화의 초기 단계에서 직접적으로 간성상세포를 사멸시킬 수 있다. 하지만, 최근 NKT 세포는 Fas 와 TNF 수용체 1 신호를 통해 알코올성 간손상을 악화시킨다는 보고도 있어 알코올성 간손상에 있어서 NKT 세포의 역할을 아직 논란의 여지가 있다. 최근Th17 림프구에 의해 생성된 IL-17 은 간성상세포에 작용해 호중구의 간내 이동을 증가시켜 간섬유화의 촉진에 관여하는 것으로 알려져 있다. 또한 간내 림프구 중 소수로 존재하는 γδ T 세포는 간섬유화의 초기 단계에서 급성 간손상시 IL-17A를 분비하는주요한 세포로 보고되고 있고, 이는 간세포 유래 엑소좀(exosome)을 통해 활성화된 간성상 세포가 γδ T 세포의 IL-17A분비를 촉진시킨다고 알려져 있다.
3. 알코올성 간질환의 새로운 치료 타깃
앞서 언급된 바와 같이 알코올성 간질환의 발병기전은 각 단계별로 특징적인 기전이 있을 뿐만 아니라 모든 단계에서 공통되는 기전 또한 존재한다. 따라서 각각의 치료는 환자 개개인별로 맞춤 치료가 시행이 되어야 한다. 알코올성 지방간염의 발생에서는 세균의 과증식과 장내 미생물총의 불균형이 중요한 기전으로 밝혀짐으로 인해 프로바이오틱스, 항생제, TLR4 길항제를 통한 장내 미생물총의 조절이 알코올성 간질환 치료에 중요한 타깃이 되고 있다. 간내 비실질세포들은 간세포 뿐만 아니라 알코올성 간질환의 모든 단계에서 중요한 역할을 함으로써 치료 타깃으로서 간세포와 함께 고려되어야 한다. 알코올성 지방간의 치료의 경우 엔도카나비노이드는 매력적인 치료 타깃이 될 수 있다. CB1 수용체 결손 마우스는 지방간의 발생에 저항성이 있고, CB2수용체 결손 마우스는 지방간의 발생을 유발하기 때문에 CB1 국소 길항제나 CB2 작용제는 알코올성 지방간의 완화를 위해 시도될 수 있는 치료제가 될 것이다. 앞서 언급된 쿠퍼세포 내 활성산소를 발생하는 NOX을 표적으로 활성산소를 억제하는 치료도 흥미로운 치료 타깃이 될 것이다. 또한 호중구의 간내 침윤은 알코올성 지방간염의 특징적인 발병기전으로 호중구의 침윤을 유도하는 IL-8 과 CXCL1 역시 염증을 감소시키는 중요한 치료 타깃이 될 수 있다. IL-2 또한 항산화, 항세포자멸사, 항지방간, 항
미생물 효과로 인해 매력적인 치료 타깃이 될 수 있다. NK 세포를 매개로 하는 활성화된 간성상세포의 사멸은 알코올성 간섬화의 치료 타깃이 될 것이다. 간섬유화 초기 IFN-γ의 투여와 IFN-γ 와 TGF-β 중화 항체의 병용 투여는 알코올성 간섬유화 치료에가능한 접근법이 될 수 있다. 더욱이 ADH3를 타깃으로 하는 간섬유화 치료에 있어서 새로운 시도가 있고, 실제로 마우스에 ADH3차단제인 4-methylpyrazole 의 투여가 간섬유화를 완화시켜 향후 추가적인 연구가 필요할 것으로 생각된다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
이전글
- 2019 ACA (American Crystallographic Association) Annual Meeting 참석 후기
-
다음글
- 알츠하이머병에서의 산화적 스트레스와 아밀로이드 베타 펩타이드


 알코올성 간질환 치료를 위한 간성상세포의 기능 연구에 대한 동...
알코올성 간질환 치료를 위한 간성상세포의 기능 연구에 대한 동...