기술동향
다약제 내성 극복을 위한 MDR 트랜스포터의 작용 기전
- 등록일2019-10-24
- 조회수6436
- 분류기술동향
-
자료발간일
2019-09-20
-
출처
한국분자·세포생물학회
- 원문링크
-
키워드
#다약제 내성#MDR 트랜스포터#MDR transporter#단백질
다약제 내성 극복을 위한 MDR 트랜스포터의 작용 기전
POSTECH(생명과학과)
김영진
서론
암세포의 사멸을 위한 항암 약제 치료는 실패하는 경우가 많다. 항암 치료가 실패하게 되는 여러 요인 중에서 암세포에 다약제 내성 (multidrug resistance, MDR)이 생기면서 약물 효과가 감소하는 것이 주요한 원인으로 알려져 있다. 약물 내성의 원인으로 MDR transporter들의 과발현을 들 수 있다. 이들은 항암제를 세포 밖으로 배출하는 기능을 가지고 있기 때문이다. 항암제 내성과 관련된 MDR transporters로는 P-glycoprotein (P-gp, ABCB1), multidrug resistance-associated protein (MRP1, ABCC1) 및 breast cancer resistance protein (BCRP, ABCG2) 등 이 있다. 암세포에서 MDR transporter들의 과발현이 항암제 내성과 관련이 있다는 사실을 발견된 후, MDR transporter들은 치료 표적으로서 관심의 대상이 되어왔다. MDR transporter의 잠재적 중요성은 이 들을 대상으로 하는 항암제, 억제제의 개발로 엿볼 수 있다. 한 예로 1976년에 빅터 링(Victor Ling)에 의해 처음 발견된 P-gp는 생화학, 세포생물학, 예측된 모델 구조 연구를 통하여 이 transporter의 기능을 억제하는 약물이 제 3세대 (zosuquidar, tariquidar, elacridar 등)까지 개발되었지만, 임상에서 좋은 결과를 얻지 못했다고 보고되었다[1]. 그러므로 암환자들의 항암치료 효율을 높이기 위해서는 MDR transporter들의 3차원 구조를 기반으로 하는 새로운 항암제의 개발이 필요하다.
이 글에서는 최근 보고된 항암제 내성과 관련된 대표적인 MDR transporter들의 3차원 분자 구조 규명 연구들을 간략히 소개하고, 알려진 기질 간의 특이적인 결합 및 기질 방출 과정에 대한 분자적 메커니즘을 소개하고자 한다. 이를 통해 MDR transporter들을 잘 억제하는 항암제 또는 억제제에 대한 실마리를 제공하고자 한다.
MDR transporter
임상 치료에서 끊임없이 발생하는 약물 내성의 원인은 MDR transporter들의 과발현을 들 수 있다. 이들은 항암제를 세포 밖으로 배출하는 기능을 가지고 있기 때문이다. 항암제 내성과 관련이 있는 대표적인 MDR transporter 들은 ATP-binding cassette (ABC) transporter 패밀리에 속하며 이들은 ATP 가수분해로부터 온 에너지를 이용하여 기질을 세포 밖으로 운반하는 역할을 하고 비슷한 구조 특징을 가진다.
ATP-binding cassette (ABC) transporter는 원핵생물에서부터 인간까지를 아우르는 대부분의 생물체에 존재하고 인간의 ABC Transporters는 7개의 subfamilies (ABCA부터 ABCG)로 나뉘고 48 종류가 알려져 있다. 이들은 공통적으로 세포막을 관통하는 도메인 (transmembrane domain, TMD)과 뉴클레오타이드가 결합하는 도메인 (nucleotide-binding domain, NBD)을 가진다. 1개의 TMD와 NBD을 1개의 half (반쪽) transporter라고 명명하며, 2개의 half transporter가 모여서 ABC transporter들을 형성한다. ABC transporter들의 NBD는 ATP가 결합하는 부위의 아미노산 잔기를 가지고 있어서 ATP와 결합할 수 있고, 후에 ATP 가수분해도 일어난다. 그리고 TMD는 이합체 (dimer) 를 이루어서 기질이 결합할 수 있는 공간을 형성하지만, 이러한 기질 결합 포켓은 다른 ABC transporter들 사이에서 아미노산 서열이 보존되지 않아서 다양한 기질을 인식할 수 있다.
인간의 ABC transporter들은 위장관, 신장, 간, 혈액 - 뇌 장벽(BBB), 유방 등에 주로 분포한다. 이들은 간단한 이온에서부터 소수성 분자와 펩타이드 그리고 콜레스테롤 등을 포함하는 다양한 기질들을 운반한다. 따라서, 이들의 기능 장애는 여러 가지 질병을 초래한다고 보고되어 왔다. 예를 들어 CFTR (cystic fibrosis transmembrane conductance regulator, ABCC7)은 낭포성 섬유증에 관련되있고, SUR (sulfonylurea receptors, ABCB8: ABCB9)은 당뇨병과 관련이 있다. 일부 ABC transporter들은 매우 좁은 기질 특이성을 가지지만, 대부분의 MDR transporter들은 넓은 기질 특이성을 가지므로 이들의 기질 특이성과 역할을 항암제 내성과 관련지을 수 있다.
MDR transporter 중에서는 P-gp는 약 40년전에 발견된 이후에 다약제 내성의 중요성 때문에 단백질의 고해상도 구조 연구가 X-선 결정학으로 시도되어 왔으나, P-gp의 적은 단백질 발현과 단백질 결정을 얻는 어려움 때문에 2012년에 들어서야 첫번째 MDR transporter 구조가 규명이 되었다[2]. 다른 MDR transporter 들의 구조들은 2017년에 단백질 결정이 필요 없는 극저온 전자현미경 (Cryo-EM)을 이용하여 MRP1과 ABCG2 구조가 차례로 규명됐다 [3, 4].
MDR transporter들의 기질간의 특이적인 결합
MDR 트랜스포터들이 운송하는 기질들은 약간의 차이를 보인다고 보고되었다. 예를 들어, MRP1은 양친매성 화합물을, P-gp는 구조나 기능이 다른 서로 다른 소수성 화합물을, ABCG2는 항암제인 methotrexate, mitoxantrone, topotecan, irinotecan 및 flavopiridol를 운반한다 [3, 5, 6].
최근에 극저온 전자 현미경을 이용하여 얻은 기질이 결합된 P-gp, MRP1, ABCG2의 복합체 3차원 구조들은 MDR transporter들이 기질 특이성을 보이는지 잘 설명하고 있다.
P-gp는 ABCB subfamily에 속하며, 2개의 TMD과 2개의 NBD로 구성되어 있고 NBD1과 TMD2을 연결하는 링커를 가지고 있어서 pseudo-2 fold-symmetry 을 가진 monomer를 형성한다 (그림 1A). 밝혀진 구조연구에 따르면, P-gp의 기질 결합 포켓은 소수성과 방향족 아미노산으로 구성되어 있고 6000A3의 면적을 가지므로 330 Da에서 4000 Da 사이의 크기를 가진 다양한 소수성 기질을 인식할 수 있다 [7]. 그리고 기질 결합 포켓에 존재하는 TM4와 TM6 그리고 180도 돌린 TM10과 TM12가 기질이 출입 할 수 있는 입구를 형성하는데, TM4, TM10, TM12의 기질이 이동하는 경로에 위치한 헬릭스가 루프처럼 바뀌어 있음을 3차원 구조분석을 통해서 보여 줬다[8]. 그리고 Zosuquidar이 결합된 복합체 구조 정보를 통하여 두개의 저해제가 기질 결합 포켓에 존재하는 TM1, TM4, TM5 및 TM6 (P-gp의 첫 번째 half) 및 TM7, TM10, TM11 및 TM12 (P-gp의 두 번째 half)에 있는 많은 방향족 및 소수성 염기 및 극성을 띄는 아미노산과 결합을 하고 있음을 보여주었다[9]. 이는 P-gp가 큰 기질 또는 하나 이상의 기질을 운반하기 위해, TM4, TM10, TM12 구조의 일부가 자유롭게 바뀔 수 있어야 한다고 결론지을 수 있다. 그리고 약물이 기질 결합 포켓에 결합함으로서 두 NBD 사이가 가까워지고 두 NBD에 ATP가 결합함으로써 기질 결합 포켓을 구성하는 TMD가 inward (세포질 방향) 에서 outward (세포밖 방향)으로 형태변화가 일어나고 있음을 3차원 구조분석을 통해 밝혀지게 되었고, MRP1 와 ABCG2 구조를 통해서 이 가설이 맞는 것으로 증명되었다 [10, 11].
두 번째 규명된 MRP1는 ABCC subfamily에 속하며, 세 개의 TMD과 2개의 NBD로 구성되어 있고 TMD0와 TMD1, 그리고 NBD1과 TMD2을 연결하는 링커를 가지고 있고 monomer를 형성한다 (그림 1A).
MRP1에 GSH-conjugated leukotriene C4 (LTC4)이 결합된 3차원 복합체 구조에 따르면, MRP1의 기질이 결합하는 포켓은 양전하를 띄는 P-포켓과 소수성을 띄는 H-포켓으로 구성되어 있어서 양친매성 기질을 인식할 수 있다고 보고된 바 있다 [3].
마지막으로 ABCG2는 ABCG subfamily에 속하며, 하나의 NBD와 하나의 TMD로 구성된 half transporter로서 상동이합체를 이룬다 (그림 1A). 기질 결합 포켓은 한쪽 monomer에 위치한 TM2와 반대쪽 monomer에 위치한 TM5a로 이루어지며, P-gp와 다르게 길고 좁은 틈 (slit)을 형성하여 편평한 소수성 기질을 인식하는데 적합하다고 보고되어 있다[4]. 그리고 흥미로운 점은 ABCG2 가 상동이합체를 형성하므로 2 fold-symmetry을 이루므로, 기질 결합 포켓은 두개의 약물 또는 기질과 결합이 가능하지만, 그 포켓의 면적이 작아서 기질 또는 약물의 크기가 크면 하나의 기질만이 결합이 가능하다고 보고된 바 있다 [11].
그리고 기질 결합 포켓을 향하는 기질의 이동 경로를 살펴보면, P-gp는 주로 소수성 약물 결합이 가능한 포켓을 향하는 막 입구가 지질 이중 층에서 inner leaflet 방향으로 열려져 있는 점을 통해 앞서 언급한 TM4, TM10, TM12의 헬릭스에서 inner leaflet에 가까운 부분이 루프화를 이루는 이유를 설명할 수 있다 [8]. 그리고 MRP1은 기질 결합 포켓이 세포질 방향으로 열려 있으며, 반면에 ABCG2는 이 포켓이 세포질과 inner leaflet 두 방향으로 열려 있다 (그림 1B) [3, 4]. 따라서 P-gp는 지질 이중층을 통과해 온 소수성을 띤 기질과, MRP1은 세포질로부터 직접 수송될 수 있는 양친매성 기질과, ABCG2는 세포질을 통해 또는 지질 이중 층을 향한 막 입구를 통해 들어온 기질과 각각 결합 하는 이유에 대한 의문이 풀린다. 그리고 이를 통해 왜 MDR 트랜스포터들간에 몇몇 같은 기질들에 대해서 교차 반응성을 보이는지에 대한 해석을 가능하게 했다. 예를 들면 Elacridar와 tariquidar는 P-gp와 ABCG2를 모두 억제하는 반면, cyclosporine A와 biricodar는 P-gp, MRP1과 ABCG2를 억제하는 것으로 알려져 있다.
MDR transporter 기질 방출 메커니즘
MDR transporter들의 3차원 구조분석 결과로는 MDR transporter 들은 결합된 ATP가 없는 경우, 기질이 결합하는 포켓이 세포막의 세포질이나 지질 이중층의 내부에 노출이 된다. 이 때, 기질 결합이 두 NBD 사이를 가깝게 만듦으로써 ATP가 NBD에 결합할 가능성을 높여주며 그 후 기질과 ATP의 결합은 TMD에서 기질 결합하는 포켓이 세포 밖으로 노출되도록 구조 변화를 유도하고 기질은 기질이 운반되는 경로를 통해서 세포 밖으로 배출된다. 그 후에 ATP 가수 분해가 일어나면서 기질이 결합하는 포켓이 세포질 방향으로 되돌아오도록 TMD의 구조가 변화한다는 메커니즘을 제시할 수 있다 (그림 1C). 흥미로운 점은 ATP가 결합된 ABCG2와 P-gp 구조는 기질이 방출되면서 기질이 결합하는 포켓이 완전히 붕괴됨을 확인할 수 있었는데, 기질 방출 경로를 통해 이동된 기질은 다시 transporter을 통해서 유입될 수 없다는 점을 유추할 수 있었다[8, 11]. 반면에 기질을 방출하면서 기질이 결합하는 포켓이 유지되는 박테리아 ABC transporter들과의 다른 점에 대해서는 여전히 추가적인 연구가 필요하다.
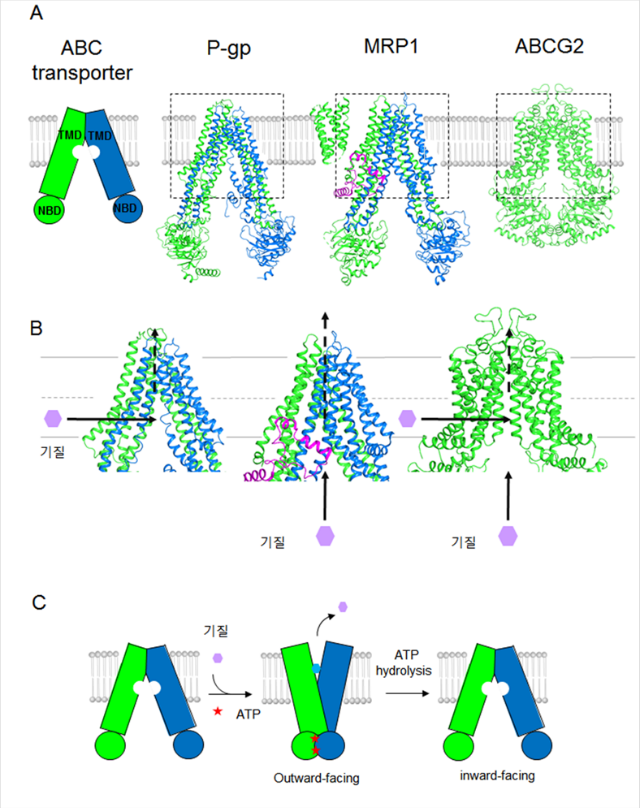
(A) ABC transporter와 P-gp (4F4C), MRP1(5UJ9), ABCG2(5NJ3)의 구조. (B) MDR transporters들과
결합하는 기질의 이동 경로. (C) MDR transporters의 기질 방출 메커니즘 모델.
결론
MDR transporter 최근 구조는 이러한 기초 생물적 또한 의학적으로 중요한 막 단백질의 기능적 다양성에 대한 새로운 통찰력을 제공해왔다. 극저온 전자 현미경의 출현과 함께, 다음 과제는 다양한 항암제 또는 억제제가 결합된 다양한 중간 상태의 MDR transporter 단백질의 구조를 결정하는 것이다. 기질을 운반하는 MDR transporter의 빠르고 역동적인 메커니즘 때문에, 더욱 다양한 구조를 통한 단백질에 대한 자세한 이해는 억제제의 특이성을 향상시키며 항암제 치료의 효율에 큰 영향을 끼칠 것으로 생각한다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.

