기술동향
미토콘드리아로의 RNA 이동, 그 분자 기전과 기능
- 등록일2019-10-28
- 조회수8943
- 분류기술동향
-
자료발간일
2019-09-20
-
출처
한국분자세포생물학회
- 원문링크
-
키워드
#미토콘드리아로#RNA#분자 기전
미토콘드리아로의 RNA 이동, 그 분자 기전과 기능
전남대학교 생명산업공학과
노지헌
서론
지금으로부터 약 40년 전 리처드 도킨스는 당시로서는 대중들뿐만 아니라 과학자들에게도 다소 충격으로 다가왔던 이론을 제시한 바 있다. 이제는 고전의 하나가 된 ‘이기적 유전자’라는 한권의 책을 통해서다.15 생명의 진화과정(다윈의 자연선택설에 기초한)을 유전자의 관점이라는 매우 독창적인 시각에서 대중의 언어로 설명한 ‘이기적 유전자’ 이론의 핵심은 다음과 같다. 유전자는 다양한 개체들(자연선택의 단위가 된다고 여겨져 왔던) 사이에 ‘분산’되어 존재하며, 결국 이를 통해 자신의 유전자 풀(pool)을 늘리려는 ‘이기적’인 목적을 달성하고자 하는 진화의 주체라는 것이다. 이러한 관점에서 봤을 때 인간을 비롯한 생명체는 유전자 발현을 돕고 단지 이를 후세대로 전달하는 역할을 수행하는 기계에 지나지 않는다는 그의 설명은 이론의 논리성을 떠나 매우 위험한 발상일 수도 있을 것이며, 실제로 그 부분에 있어서 많은 비난을 받은 것도 사실이다. 동료 과학자(peer reviewer)들로부터 검증받지 않은, 혹은 검증이 불가능했던, ‘이기적 유전자’론은 그래서 앞서 언급한 것처럼 하나의 과학적인 ‘이론’(theory)이라기보다는 생명현상 더 나아가 사회현상까지 아울러 설명하고자 했던 도킨스 자신의 신선한 ‘관점’(perspective)이라는 표현이 더욱 적합할 것이다.
주제와 다소 동떨어진 이야기였는지도 모르겠다. 그런데 만약 이 글을 읽고 있는 당신이 필자와 같은 생물학(혹은 생명공학) 분야의 연구에 종사하고 있다면, 예상하건데 추리소설과도 같은 도킨스의 발칙한 상상은 우리의 머릿속 어딘가에 언젠가부터 슬며시 자리 잡고 있을지도 모른다. 생물학 연구를 세포, 더 나아가 분자 수준에서 특정 유전자(혹은 유전체)의 작동 원리를 이해하는 것으로 한정한다면(물론 예외적인 경우도 많지만) 더욱 그렇다. 오늘 아침 출근 후 여느 날과 다름없이 siRNA를 이용해 silencing한 그 ‘녀석’, 실체를 본적도 없지만 나름 이름까지 가지고 있는 친근한 그 ‘녀석들’에게 우리는 때로 감정이입을 해보기도 한다. 아 이 ‘녀석’은 이럴 때 도대체 어떻게 행동할까? 혹은 도대체 이 ‘녀석’이 이런 일을 하게 돕는 또 다른 ‘녀석들’은 누구일까? 하는 식으로 말이다. 우리가 가진 궁금증이자 나도 모르게 어느새 갖게 된 생명 현상을 바라보는 독특한 관점이다. 이번 논단에서는 세포 안에서 벌어지는 수많은 분자 수준의 사건(event)들 중 하나로서, 비암호화 RNA(noncoding RNA)의 미토콘드리아로의 이동(mitochondrial transport)을 바라보는 몇 가지 관점에 대해 이야기해 보고자 한다.
본론
진핵생물과 미토콘드리아의 공생관계
앞서 도킨스의 관점에 대해서 설명했지만, 현 시대의 진핵생물(modern eukaryotes)과 미토콘드리아가 함께 공존하게 된 경위를 따라가다 보면, 이 둘의 관계만큼 ‘이기적 유전자’적인 관점을 잘 설명해 주는 예도 없을 것 같다. 잘 알려진 것처럼 미토콘드리아는 한때(약 15억 년 전) 원시 박테리아 세포(proteobacteria)에서 유래되었다는 몇몇 증거가 발견되었고(물론 과학적으로 명확히 검증된 바는 없다), 이 증거들에 근거하여 주장된 이론이 바로 세포내 공생설(endosymbiotic theory)이다. 미토콘드리아의 유입은 진핵생물에게 진화적으로 매우 유리한 환경을 제공했다. 또한 공생이라는 표현에서 알 수 있듯이, 이 사건으로 말미암아 미토콘드리아 역시 원핵생물(prokaryotes)인 자신의 조상과는 확연히 다른 방식의 삶을 이어갈 수 있게 되었다. 그 면면을 자세히 살펴보는 것도 흥미롭겠지만, 보다 주제와 관련된 내용을 이야기하자면 우선 진핵생물의 미토콘드리아가 자신이 필요로 하는 유전자를 얻는 방식에 어떤 변화가 생겼는지에 주목할 필요가 있다. 진핵생물과의 공생을 이어가는 과정에서 미토콘드리아는 자신의 구조와 세포 내 기능(에너지[ATP]의 생산, 세포사멸 조절, 다양한 세포내 대사[metabolism] 및 신호전달경로[signaling] 조절 등)을 매우 효율적으로 유지하는 방향으로 진화해 왔다. 즉, 스스로 지니고 있는 DNA(mitochondrial DNA)에는 극히 적은 수의 유전자만을 남겨두고, 자신의 구조와 기능 유지에 필수적인 대부분의 유전자를 숙주 세포(host cell)의 DNA로 하여금 발현시키는 시스템을 갖추게 된 것이다. 앞선 표현을 빌리자면 매우 ‘이기적’인 방식이지만, 결과적으로 이 ‘이기적’인 미토콘드리아의 선택으로 말미암아 현대의 진핵생물 역시 매우 복잡하고 세밀한 세포 조절 능력을 얻게 되었다.
미토콘드리아로의 RNA 이동
미토콘드리아는 진핵생물의 그것과는 다른 독립적인 단백질 합성 기구(protein synthesis machinery)를 통해 극히 제한적인 수의 단백질을 생산한다. 인간의 경우 이를 통해 13개의 유전자가 단백질로 번역되며, 이들은 모두 산화적 인산화(oxidative phosphorylation)를 담당하는 막 단백질(membrane protein)의 합성에 사용된다. 하지만 앞서 언급한 것처럼 이는 미토콘드리아의 다양한 세포 내 기능을 유지하는데, 무엇보다 미토콘드리아 자신의 활성과 삶을 영위하는데(mitochondrial maintenance) 턱없이 부족한 수의 단백질이다. 따라서 미토콘드리아는 자신이 필요로 하는 대부분의 단백질을 외부로부터 제공(outsource)받을 수밖에 없고, 세포 안에서 이를 공급해 줄 수 있는 것은 genomic DNA의 대부분을 차지하고 있는 세포 핵(nucleus)이 유일하다 (그림 1). 그동안 연구자들은 핵에서 유래한 단백질이 어떻게 특정한 세포내 소기관으로 운반되는지(mitochondrial protein import), 그리고 더 나아가 전구체(precursor)의 형태로 이동되는 단백질이 어떤 과정을 거쳐 성숙(matured)되고 특정한 위치(ochondrial location)로 재배치되는지에 관해 상당한 양의 지식을 축적해왔다.9,32,39
예상컨대 이와 같은 연구의 연장선에서 연구자들은 아마도 자연스레 또 다른 형태의 유전자 산물(gene product)인 RNA 역시 미토콘드리아로 운반될 가능성에 대한 의문을 품게 되었을 것이다. 사실 이러한 호기심에 대한 질문과 해답은 꽤 오래전(약 50년 전)부터 이미 시작되었는데, 가장 먼저 mRNA(messenger RNA)서열을 단백질로 해독(decode)하는 데 사용되는 tRNA(transfer RNA)가 세포질로부터 유리된 후 미토콘드리아로 이동된다는 사실이 원생동물(protozoa)인 Tetrahymena, 단세포 진핵생물인 효모(S. cerevisiae)에서 뿐만 아니라 식물과 포유류에서도 관찰된 바 있다.14,30,38,43,44 원생생물인 Trypanosoma brucei의 경우 미토콘드리아가 필요로 하는 모든 종류의 tRNA를 세포핵으로부터 공급받기도 하는데,21 결국 이러한 사례들로부터 나올 수 있는 첫 번째 질문이자 아직까지도 풀리지 않은 수수께끼는 바로 (단백질 운송과는 별개로 존재할 가능성이 매우 큰) 미토콘드리아로의 RNA 이동 경로일 것이다. 이에 대해서는 다음 장에서 조금 더 자세히 다루고자 한다.
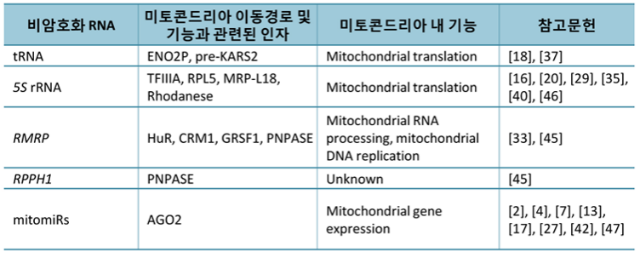
어쨌든 이 첫 번째 질문에 대한 답을 미처 마련하기도 전에, 연구자들은 더 큰 궁금증을 유발하는 결과들과 마주하게 된다. 전체 유전체에서 봤을 때에는 물론 극소수이긴 하지만, tRNA 뿐만 아니라 다양한 종류의 핵유래 비암호화 RNA(nuclear DNA-encoded noncoding RNA)들, 예를 들어 rRNA(ribosomal RNA), microRNA, long noncoding(lnc) RNA들 중 일부가 미토콘드리아로 이동된다는 실험적 증거들이 끊임없이 제시되었기 때문이다.26 이들이 시사하는 바는 크게 두 가지일 것이다. 첫째, 미토콘드리아로 이동되는 RNA들은 제각기 서로 다른 목적(혹은 용도)을 지니고 있다고 예상된다. 서로 다른 종류와 형태의 RNA들이 이동되는 데에는 저마다의 이유가 있을 것이기 때문이다. 둘째, 미토콘드리아로의 RNA 이동은 선택적으로 이루어진다. 그 선택성이 RNA 자체에서 기인한 (가령 RNA의 특이적인 염기서열로 인한)것인지 아니면 외부적인 요인(결합 단백질 혹은 또 다른 제3의 인자)에 의한 것인지, 아니면 둘 다인지는 아직 명확하지 않지만, 한 가지 분명한 사실은 모든 RNA가 미토콘드리아로 이동할 수 있는 것은 아니라는 점이다. 지금까지 알려진 바에 따르면 수백 개의 다양한 종류의 비암호화 RNA들이 핵에서 만들어진 후 세포질로 이동되며(mobilized), 자세히 알려지지 않은 매커니즘을 통해 미토콘드리아에 선택적으로 이동(imported)된다 (표 1).
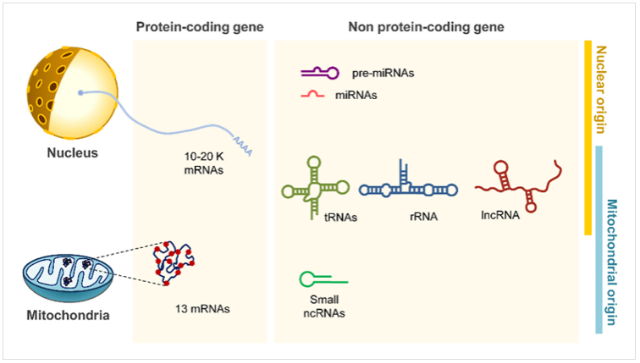
세포핵(nucleus)과 미토콘드리아(mitochondria)는 각각의 DNA가 지니고 있는 유전자로부터 단백질을
합성(from protein-coding gene)할 뿐만 아니라 다양한 종류의 비암호화 RNA(from non protein-coding gene)를 생산한다.
비암호화 RNA의 이동경로와 기능
앞서 언급한 것처럼 미토콘드리아는 host cell과 구별되는 유전자 발현 시스템을 갖고 있으며, 이는 원핵생물의 그것과 유사한 방식을 따라 먼저 (nucleoid 형태의) 미토콘드리아 DNA로부터 다시스트론성 전사체(polycistronic transcripts)로 전사되어 전구체(precursor)를 형성하고, 전사 후 가공(post-transcriptional processing)단계에서 개별적인 mRNA, tRNA, rRNA들로 나뉘게(cleaved) 된다. 최근 한 연구진에 의해 인간의 미토콘드리아 전사체(transcriptome)에 대한 매우 포괄적인(comprehensive) 연구가 수행된 바 있다.31 포괄적이라는 단어에서 유추해 볼 수 있는 것처럼, 이는 단지 미토콘드리아 내에 존재하는 전사물(transcripts)의 존재 여부나 그 양을 분석하는 데 그치지 않고, PARE(parallel analysis of RNA end)-seq 등을 통해 전사 후 프로세싱(혹은 성숙)되는 과정까지를 비교적 자세히 규명하였다. 또한 정확한 미토콘드리아 분획(mitochondrial fraction)에서의 전사체 분석을 위해 미토콘드리아 외부 막(outer membrane)이 제거된 미토플라스트(mitoplast)를 추출하고, 여기에 뉴클레아제(nuclease)를 처리하여 세포질을 비롯한 외부로부터의 오염(주로 세포핵 유래 전사물)을 무시할 수 있을 정도로 낮추었다. 이해를 돕기 위해 방법상 핵심적인 부분만을 간략히 설명했지만, 예전부터 이러한 방법은 미토콘드리아 내에 존재하는 RNA를 탐지(detection)하고 그 양적인 변화를 관찰하는데 있어서 보편적으로 사용되어왔다.29 이 연구결과에서 발견된 한 가지 흥미로운 사실은 (위에서 설명한 방법을 통해) 외부(세포질)로부터의 오염을 거의 없앴음에도 불구하고, 미토콘드리아 기질(mitochondrial matrix) 내부에 세포핵으로부터 유래한 전사물(nuclear DNA-encoded transcript)들이 발견된(전체의 약 18%에 해당) 것이다. 다시 말해, 미토콘드리아 외부로부터 유입되는 RNA들이 실제로 존재함을 보여주는 중요한 분자적 증거가 제시된 것이다.
비슷한 시기, 위와 같은 미토콘드리아 전사체에 대한 정보와 더불어 실제 특정 RNA(핵에서 유래한)가 포유동물 미토콘드리아의 외막과 내막(outer and inner membrane, OM and IM)을 모두 통과하여 기질로 이동하는 현상이 관찰되었다. In vitro와 in vivo 모두에서 실험적으로 증명된 바에 따르면, 미토콘드리아 막간 공간(intermembrane space, IMS)에 위치하고 있는 RNA 결합 단백질(RNA-binding protein)인 PNPASE(polynucleotide phosphorylase)는 세포질로부터 외막을 통해 유입된(미토콘드리아의 외막은 내막에 비해 비교적 느슨한 구조로 되어있다) 두 종류의 비암호화 RNA, RPPH1(ribonuclease P RNA component H1 혹은 H1 RNA)과 RMRP(RNA component of mitochondrial RNA processing endoribonuclease)에 결합하고, 이를 통해 이들 RNA의 내막 투과(internalization)를 유도한다. PNPASE 단백질이 각 RNA에 포함된 유사한 루프 구조(a loop structure)를 인식하고, 단백질이 가진 효소 활성(3' to 5' exoribonuclease activity)으로 인해 RNA의 가공(내부로 이동된 RNA는 길이가 짧아진다)이 이루어지는 등 세포 수준에서 관찰된 현상을 뒷받침해주는 분자 수준의 증거들도 함께 제시되었다 (그림 2).45 최근 필자를 포함한 연구진 역시 미토콘드리아로 이동되는 위의 두 가지 비암호화 RNA(RPPH1과 RMRP)에 관심을 갖고 연구를 수행한 바가 있다. 물론 앞선 연구와 완벽히 동일한 조건(가령 같은 종류의 세포를 사용)은 아니었지만, 둘 중 RMRP RNA만이 미토콘드리아에 존재한다는 사실(RPPH1의 경우 세포핵에서만 발현하는 RNA[negative control]에 비해 큰 발현 차이가 없었음)과 함께, 기질에서 RMRP와 결합하는 새로운 RNA 결합 단백질인 GRSF1을 발견할 수 있었다 (그림 2).33 GRSF1은 미토콘드리아 기질 내에서만 발현되기 때문에 PNPASE처럼 RNA가 미토콘드리아의 막을 통과하는 과정에 관여하여 이를 조율하는 역할을 한다고 보기는 어렵다. 하지만 최근 기질로 운반된 RNA의 특정 부위(위에서 제시된 loop sequence와 동일한)에 GRSF1이 정확히 결합한다는 것을 분자 수준에서 입증할 수 있었다 (unpublished data). 따라서, 물론 증명하는 것이 그리 쉽지만은 않겠지만, 내막(inner membrane)을 통과해 기질로 넘어오는 RNA에 결합하여 이를 넘겨받는(uptake) 과정에서 GRSF1이 관여할 가능성도 완전히 배재할 수는 없다. 어쨌든 GRSF1과의 상호작용(interaction)으로 RMRP RNA는 미토콘드리아의 생합성(biogenesis), 좀 더 정확히는 DNA 복제(replication)에서 중요한 역할을 담당할 것으로 예상되며, 이는 GRSF1이 기질 내 nucleoid근처에서 미토콘드리아 RNA들과 결합하여 일종의 과립(mitochondrial RNA granule, MRG)을 형성한다는 기존의 사실과도 잘 부합하는 결과라 할 수 있다.24
포유동물의 미토콘드리아 리보솜(mitochondrial ribosome)은 미토콘드리아 DNA에 의해 암호화되며, 원핵생물의 그것과 유사한 rRNA(12S 및 16S rRNA)를 포함하고 있다. 그런데 꽤 오래 전부터 연구자들은 미토콘드리아(앞서 설명한 방법을 통해 외부 오염 요인이 제거된)가 세포핵에서 유래한 5S rRNA(정확히는 그 핵심부위를 포함하는 일부)도 함께 지니고 있음을 알게 되었다.29,46 본래 세포질 내 리보솜의 대형 서브유닛(large subunit, LSU)을 구성하며 mRNA의 번역과정에서 구조적으로 중요한 역할을 담당한다고 알려진 5S rRNA는, 최근의 연구결과에 따르면, 미토콘드리아로 이동되는 또 하나의 중요한 비암호화 RNA이다.1,6 5S rRNA의 세포내 이동(세포핵에서 세포질을 거쳐 미토콘드리아 기질에 이르기까지)은 RNA의 특정 부위를 인식하는 서로 다른 RNA 결합 단백질들의 역할을 규명하는 과정에서 비교적 자세히 설명되었는데, 특히 미토콘드리아 효소인 Rhodanese(thiosulfate sulfurtransferase)가 세포질에서 기질로의 RNA 이동에 관여하는 일종의 ‘분자 컨베이어’(molecular conveyor)로 제시되기도 하였다 (그림 2).40 물론 아직까지 미토콘드리아 내에서 5S rRNA가 어떤 역할을 담당하는지는 분명하지 않다. 다만 미토콘드리아 리보솜의 정확한 구조가 최근 밝혀짐에 따라 그동안 꾸준히 제기되었던 바, 5S rRNA가 미토콘드리아 리보솜(mitoribosome)의 구성 요소일 가능성은 배재될 수 있었다.8,19,41 그럼에도 불구하고 미토콘드리아로 이동되는 5S rRNA는 이 세포소기관이 독립적으로 단백질을 합성하는 데, 더 나아가 미토콘드리아가 관여하는 세포의 기능을 유지하는 데 중요한 역할을 할 것으로 기대되고 있다.23
마지막으로 미토콘드리아로 이동하는 비암호화 RNA 중 매우 흥미로운 것 중 하나가 바로 microRNA일 것이다. 지금까지 알려진 바에 의하면 세포핵에서 만들어진 일부 microRNA들(수백여 종에 달한다)은 미토콘드리아로 이동되며, 특별히 ‘mitomiR’(mitochondrial microRNA)라는 용어로 구별되어 불리기도 한다.3 무엇보다 이들 mitomiR가 흥미롭게 여겨지는 이유는 기존에 너무나 잘 알려진 microRNA의 기능(세포질에서 mRNA를 타겟으로 한 전사 후 조절)과는 사뭇 다른 역할을 할 것으로 예상되기 때문이다. 최근 microRNA와 결합하는 AGO2 단백질이 미토콘드리아에서 발견되었고(다른 argonaute 단백질의 발현은 보고된 바가 없다), 이는 microRNA repressor complex(miRISC)를 구성하는 단백질로서는 유일하다 (그림 2).3,12,42 따라서 미토콘드리아에는 타겟 mRNA의 탈아데닐화(deadenylation)를 통한 분해는 물론 단백질로의 번역을 억제하는데 필수적인 역할(scafolding)을 담당하는 GW182 단백질이 결여되어 있으며, 최근 제시된 mitomiR의 역할은 일반적으로 알려진 세포질에서의 그것과 정반대(마우스 근육 분화 과정에서 miR-1은 특정 미토콘드리아 유전자[MT-ND1 및 MT-CO1]에 결합하여 단백질로의 번역을 촉진한다)인 경우도 있다.17,36,47 미토콘드리아 내부에서 발견되는 microRNA는 성숙된(mature) 형태와 전구체(pre-microRNA) 모두를 포함하고, 이는 비록 소수이긴 하지만 미토콘드리아 DNA로부터 만들어지는 짧은 길이의 비암호화 RNA(small noncoding RNA)를 포함한다.31 하지만 대부분 세포핵에서 유래했을 것으로 예상되는 mitomiR는 어떤 경로를 통해 미토콘드리아로 이동되는지에 대해서는 아직까지 거의 알려진 바가 없다.
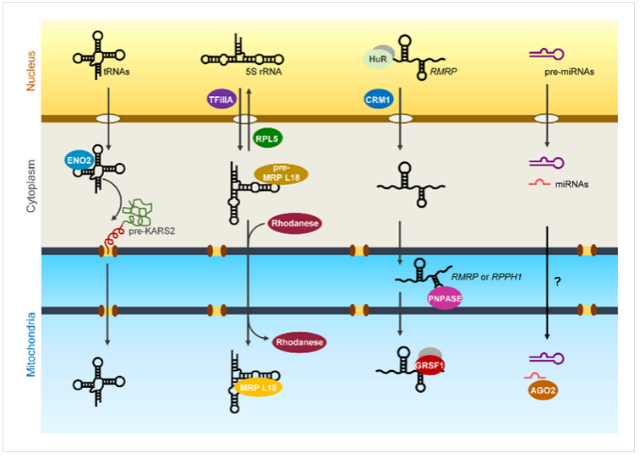
세포핵으로부터 유래하는 다양한 종류의 비암호화 RNA들은 각기 다른 이동경로
(예를 들면, 서로 다른 RNA 결합 단백질과의 상호작용)를 통해 핵으로부터 빠져나와(nuclear export)
미토콘드리아 안으로 이동한다(mitochondrial import) (Illustration modified from Kim et al., 2017).
결론
사실 앞서 예로 들었던 비암호화 RNA인 RMRP는 그것이 미토콘드리아 내부에 존재할 가능성은 물론이고, 미토콘드리아에서 RNA가 가지고 있을 고유한 기능에 대해서 꽤 오래전 이미 예견된바 있다.10,11 그 당시엔 현재와 같은 수준의 기술(순도 높은 미토콘드리아를 정제하고 RNA를 정밀하게 탐지하는 등의)이 존재하지 않았다는 사실을 감안한다면, 당시로서는 매우 독창적인 생각이었음에 틀림없다. 하지만 그래서 이후 많은 연구자들로부터 공격의 대상이 되기도 했고, 수많은 관련 증거들이 축적된 지금에 와서도 RMRP의 미토콘드리아 내 존재 여부는 여전히 논란의 대상이다. 물론 논란이 있다는 자체가 기존의 가설과 증거들을 모두 부정하는 것은 아닐 것이다. 다만 이를 입증하기 위해 사용되어 온 기술이 지닌 한계 역시 너무나 분명하기 때문에, RMRP를 포함하여 미토콘드리아로 이동할 것으로 예상되는 모든 비암호화 RNA들의 이동경로는, 아니 그들의 존재여부는 생명 현상을 이해하고자 하는 대부분의 연구에서 그러하듯 아직까지 대부분 ‘open question’으로 남아있다.
아직까지 그 분자 기전과 고유한 기능을 설명해 주는 증거는 부족하지만, 세포핵으로부터 만들어진 다양한 종류의 비암호화 RNA들이 미토콘드리아로 향하는 데에는 분명한 이유가, 혹은 (RNA를 행동의 주체로 여긴다면) 뚜렷한 목적이, 있을 것이다. 무엇보다 지난 수십 년 동안 과학자들이 밝혀낸 비암호화 RNA의 다양한 기능들을 떠올려 본다면, 비록 세포 내 제한된 공간이긴 하지만 독립적인 유전자 발현 시스템을 갖추고 세포의 생존에 필수적인 조절 기능을 담당하는 ‘미토콘드리아에 존재하는 그들’의 역할 역시 다양할 수 있을 것으로 예상된다.34 비록 이 글에서 상세히 다루진 못했지만, 서두에서 언급한 것처럼 ‘이들의 역할을 도울 수 있는’ 또 다른 존재들(예를 들면 미토콘드리아로 이동되는 수백 개의 RNA 결합 단백질)에 대한 연구는 미토콘드리아로의 RNA이동 현상을 설명하는 새로운 관점을 제시할 것으로 기대된다. 또한 기술적인 부분에 있어서, 앞서 언급된 실험 방법상의 한계를 극복하기 위해 최근 제시되고 있는 새로운 기술들, 예를 들면 제한된 공간(미토콘드리아 내부)에서 원하는 분자를 태깅하는 방법(예를 들어 proximity biotinylation 혹은 proximity-CLIP) 등을 활용한다면 보다 신빙성 있는 데이터를 얻을 수 있을 것으로 사료된다.5,22,25,28
기나긴 진핵생물의 진화 과정 중, 인간을 비롯한 고등한 생물일수록 훨씬 높은 비율로 비암호화 RNA를 생산하게 되었고, 이들 RNA를 활용하여 보다 세밀하고 역동적으로 세포의 기능을 조절하는 것이 가능하게 되었다. 역시나 진화 과정 속에서 진핵생물과 공존의 길을 걷게 된 미토콘드리아. 아직까지 의문투성이인 이 세포내소기관으로 이동하는 비암호화 RNA들은 세포 안에서 물리적으로 분리되어 존재하는 두 개의 서로 다른 게놈(genome)을 연결해 주는 또 다른 의미에서의 ‘메신저’(messenger) RNA가 아닐까? 미토콘드리아로 이동되는 ‘그녀석들’의 입장에서 바라본 필자의 관점이다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향

