기술동향
차세대 항체의약품: ‘높이 매달린 과일’의 추구
- 등록일2019-10-28
- 조회수9141
- 분류기술동향 > 레드바이오 > 의약기술
-
자료발간일
2019-10-17
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#antibodies#antibody drug#antibody mechanism of action#target exposure#bispecific antibody
- 첨부파일
차세대 항체의약품: ‘높이 매달린 과일’의 추구
< 목 차 >
1. 서론
2. 항체의 작용기작
2.1. 종양표적항체
2.1.1. T세포 의존적 이중특이성 항체(TDB)
2.1.2. 항체-약물 결합체(ADC)
2.1.3. 개선된 작용자 기능
2.1.4. 표적 조직에 대한 항체 선택성 향상
2.1.5. 암 면역 요법을 위한 면역 시스템 조절인자
2.2 항체 작용제
2.2.1. 이합체화를 통한 수용체 활성화
2.2.2. 클러스터링을 통한 수용체 활성화
3. 항체의 표적 노출 방법
3.1. 전신 노출 증가
3.1.1. 항체의 개발 가능성 및 용량
3.1.2. 유리한 약동학 특성을 갖는 항체의 개발
3.1.3. 항약물항체(ADA)의 효과
3.2. 작용부위로의 항체 직접 전달 방법
3.2.1. 안구 질환 치료를 위한 국소 항체 전달
3.2.2. 흡입성 항체에 대한 전망
3.2.3. 항체 경구 전달에 대한 전망
3.3. 항체 공학을 통한 약물 전달법 개발
3.3.1. 뇌 전달 목적의 항체 개발
3.3.2. 세포 내 표적 항체 개발
4. 결론
------------------------------------------------------------------
요약문
항체는 의약품 분야에서 가장 빠르게 성장하고 있으며 특히 종양학, 자가 면역 및 만성 염증 질환에서 인간 건강에 중요한 영향을 미친다. 인간 질병에서는 가장 잘 알려지고 다루기 쉬운 세포 표면이나 분비되는 표적들이 항체의약품 개발에 광범위하게 이용되고 있다. 이번 리뷰에 서는 새롭게 떠오르는 항체 작용 기작과 항체-약물 결합체, 이중특이성 항체 및 항체 공학과 같은 치료 범위를 넓히는 혁신적인 표적화 전략을 집중적으로 다룬다. 이러한 전략은 이전에 이해하기 어렵거나 약물화하기 어려웠던 표적들, 일명 ‘높이 매달린 과일’을 겨냥하는 것을 가 능하게 할 것이다.
1. 서론
1990년대 중반 이후, 항체는 임상적/상업적으로 성공한 의약품 분야로 꾸준히 성장해왔다. 2016년 기준 60개 이상의 항체 기반 약제가 치료용으로 승인되었고, 전 세계적으로 약 890억 달러 의 매출을 올리고 있다.
대부분의 항체의약품의 기본 포맷은 immunoglobulin G (IgG)이며, 약물이나 PEG를 포함하는 항체결합체나 항체 단편, 이중특이성 항체들이 개발/승인되었다 (그림 1). 항체의약품은 종양 치료, 만성 염증, 자가면역 질환의 치료에 많이 사용되고, 심혈관 질환, 전염성 및 안과 질환, 골다공증 및 이식 등의 분야에 일부 적용된다.
초기 승인된 많은 1세대 항체들이 대부분 다른 항체의약품이나 단백질 치료제와 치료 표적 을 공유하고 있기 때문에, 보다 개선되고 구별되는 2세대 항체 개발에 강한 동기부여를 일으켰다. 또한 블록버스터 항체의약품의 특허 만료에 따라 많은 바이오시밀러 항체의 개발이 이어지고 있다.
항체의약품 개발은 표적의 생화학적 특성, 항체의 작용기작의 선택, 적절한 표적노출법 등에 따라 큰 영향을 받는다. 질병 내 역할이 잘 알려진 분비단백질이나 막단백질이 광범위하게 적용 가 능한 ‘낮게 매달린 과일’로 항체 개발에 이용되고 있으나, 새로운 생물학적 발견과 더불어 도전적인 치료방법의 고안은, 지금까지 다루기 어려웠던 ‘높이 매달린 과일’을 치료 표적으로 삼을 수 있는 기 회를 제공할 것이다 (그림 2). 본 리뷰에서는 새로운 항체의 작용기작과 적용하기 어려운 부위의 항 체 전달방법에 대해 다룬다.
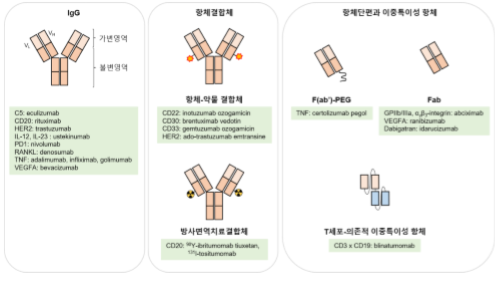
승인된 항체 의약품의 대부분은 immunoglobulin G (IgG) 구조를 가지며, 2016년 가장 많은 판매량을 기록했다. 이 외에 현재 시판된 항체 의약품은 항체결합체, 항체단편과 이중특이성 항체 구조를 갖는다. GPIIb/IIIa, glycoprotein IIb/IIIa; HER2, human epidermal growth factor receptor 2; IL-12, interleukin 12; PD1, programmed cell death protein 1; PEG, polyethylene glycol; RANKL, receptor activator of nuclear factor-κB ligand; TNF, tumor necrosis factor; VEGFA, vascular endothelial growth factor A.
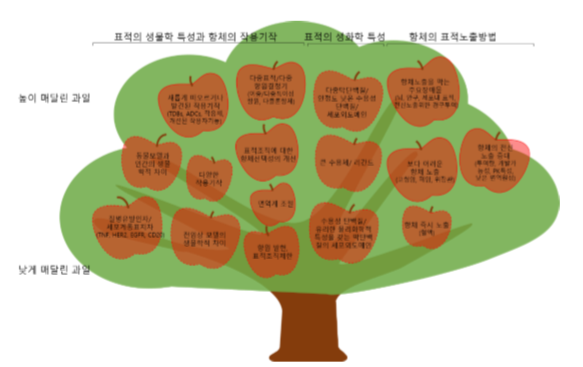
본 리뷰에서는 ‘높이 매달린 과일’로 일컬어지는 보다 도전적인 치료표적에 대하여 실선으로 표시된 분야의 항 체 개발에 대해 다룬다. ADCs, antibody–drug conjugates; EGFR, epidermal growth factor receptor; HER2, human epidermal growth factor receptor 2; TDBs, T cell-dependent bispecific antibodies; TNF, tumor necrosis factor.
2. 항체의 작용기작
항체의 작용기작(MoA)에는 수용체 차단, 표적세포 제거, 수용체 하향 조절 및 표적 세포의 신호전달유도 등이 포함된다. 항암 항체는 종양을 직간접적으로 표적화할 수 있으며, 기존의 특성을 개선하거나 새로운 기능을 부여함으로써 항체의 임상 잠재력을 향상시키기 위한 다양한 전략이 개 발되고 있다.
2.1. 종양표적항체
종양을 직접 표적으로 하는 방법에는 T세포-의존성 이중특이성 항체(TDB), 항체-약물 결합체 (ADC), 항체 효과기 기능의 개선이 있다. 이를 통해 항체의 항암 활성을 향상시키거나 적용하기 어 려웠던 표적을 대상으로 하거나, 면역계 조절을 통한 간접적 항암 작용이 가능하게 하는 등의 항체 개발이 가능할 것이다.
2.1.1. T세포 의존적 이중특이성 항체(TDB)
이중특이성 항체가 T세포를 통해 암세포를 제거하는 것이 1980년 중반 확인된 이후, 악성복 수치료제 catumaxomab (Removab)과 급성림프구성-백혈병 치료제 blinatumomab (Blincyto)의 승인을 통해 임상 유효성이 확인되었다. 이들의 성공은 현재 혈액암과 고형암에 대한 항체 개발로 이어지고 있다.
임상 단계의 TDB는 크기와 항원결합가에 따라 BiTE (bispecific T cell engager), DART (dual-affinity re-targeting), TandAbs (bispecific tandem diabodies), 이중특이성 IgG, CrossMab Fab-IgG 등 최소 6개의 분자구조에 해당된다. TDB 디자인에는 항원결정부위(epitope)와 항원과 CD3에 대한 친화 력(affinity), 성분 안정성과 같은 개발 가능성 측면이 고려되어야 한다.
TDB의 디자인은 암세포 제거능력, 체내 분포, 종양침투, 암세포 선택성, 면역원성, 약동학적 특성을 결정하며, 궁극적으로 임상적 효과와 안정성에 영향을 미친다. 예를 들어, 분자량이 작은 항 체인 BiTE는 표적과 T 세포의 근접성을 높이고 종양 침투가 쉬운 반면 빠르게 제거되므로, 지속적인 항체 주입이 필요하다. 그러나 이를 크기가 큰 Fc와 접합하면, 반감기가 늘어나 항체 투여기간을 증 가시킬 수 있다. 아직까지 특별히 선호되는 TDB 구조가 보고되지 않아, 이 구조들을 기반으로 한 다 양한 항체의약품이 개발될 것으로 기대된다. 임상에서 이상반응이 나타나거나 치료지수(Therapeutic index)가 낮게 나는 경우에는, 처방 정보에 신경독성 및 사이토카인 방출 증후군에 대해 경고하도록 되어있다. 이에 대하여 분할 복용 또는 스테로이드제 및 항-사이토카인 항체를 이용하거나, 나아가 종양 선택성을 향상시키도록 항체 를 조작하는 연구가 시도되고 있다.
신항원-주조직적합성복합체(MHC) 상호작용을 이용한 이중특이성 항체에 대한 연구도 진행 되고 있다. ImmTAC (immune-mobilizing monoclonal T cell receptor against cancer)은 MHC에 높은 친 화력과 선택성을 갖도록 조작된 TCR과 CD3 scFv가 연결된 이중특이성 항체로, 흑색종에서 IMCgp100를 표적으로 하며 현재 임상 1상/2상 진행 중이다. 대안적으로, 특정 펩타이드-MHC 복합 체에 특이적인 TCR 모방 항체가 사용될 수 있는데, 이것은 일반적인 종양 항원을 표적으로 하는 것 에 비하여 세포 내 항원에 대한 접근성과 종양 선택성을 증가시킬 수 있다. 그러나 종양세포의 항원 제시가 낮고, MHC 제한(MHC restriction), MHC 하향 조절(downregulation) 및 잠재적 교차반응에 대 한 위험 등의 단점 극복이 필요하다.
이밖에 NK 세포와 같은 다른 유형의 면역 세포를 이용하는 방법과 서로 다른 종양 표지 항 원을 동시에 인식하여 종양세포의 면역회피기작을 저해하는 동시에 종양 선택성을 높이는 이중특이 성 항체의 개발도 진행되고 있다.
2.1.2. 항체-약물 결합체(ADC)
1970년 항체에 독소를 부착하는 시도 이후 항체-약물 결합체의 지속적인 개발이 이어졌다. 최초 승인된 ADC는 급성 골수성백혈병 치료제인 gemtuzumab ozogamicin (Mylotarg)인데, 임상 3상 에서 부작용으로 인해 철수되었다가 최근 투여량 조정을 통해 재승인되었다. 이밖에 brentuximab vedotin (Adcetris)이 호지킨 림프종 치료제로, ado-trastuzumab emtansine (Kadcyla)이 HER2-양성 유 방암 치료제로 승인되었다.
ADC는 표적 항원 및 항원 결정부위, 항체, 약물, 링커, 약물 대 항체 비율(DAR, drug-to-antibody ratio) 등 다양한 변수들의 최적화가 요구되는 복잡한 의약품이다. 근 50여 년의 ADC에 대한 경험은 차세대 결합체의 개발과 표적 접근성 향상에 크게 기여해왔고, 현재 60개 이상 의 ADC에 대해 임상 개발이 진행 중이다.
항체-약물의 비율을 높이는 링커 설계와 약물의 부착 위치를 조정하여 치료지수를 높이고 생체 내 ADC의 안정성을 높이는 방법들이 개발되었다.
적절한 약물의 선택도 ADC의 치료 가능성을 높인다. 미세소관 저해제나 DNA 손상제제처럼 서로 다른 작용 기작을 갖는 대체 약제들로 확장되고 있고, 단일 세포독성을 갖는 약물치료보다 독 성과 저항성이 겹치지 않는 약물 조합을 통한 치료전략이 광범위하게 적용되고 있다. Brentuximab vedotin의 경우, 면역조절항체, 항-신생혈관항체, 표적화된 소분자 저해제와 세포독성 화학치료 요법 과의 조합을 통한 임상시험이 진행되고 있으며, dual-auristatin ADC는 서로 보완적인 두 개의 auristatin 약물을 ADC에 연결하여 생체 내 항암 효과를 증가시켰다.
ADC 내재화는 표적과 약물 관련 인자들에 영향을 받는다. 종양 세포의 비효율적 내재화를 극복하기 위해, 이중특이성 항체가 사용될 수 있다. MEDI4276으로 알려진 ADC는 두 개의 HER2 결 정부위를 표적으로 하며 미세소관억제제 tubulysin와 결합되어 HER2를 발현하는 종양모델에 뛰어난 효과를 보이고 있다. 또한 이중특이성 항체가 종양항원을 인식하는 동시에, 리소좀 마커인 CD63이 나 APLP2, 프로락틴 수용체를 인식하도록 만들면 단일 항체에 비해 세포 내재화를 증가시켜 더 높 은 생체 효능을 나타낼 수 있다.
이제 ADC 개념은 종양학을 넘어 전염병이나 면역억제 치료에도 적용되고 있다. 메티실린 내 성 황색포도상구균(MRSA)치료를 위한 항체-항생제 결합체가 개발되었고, 임상 1상에서 성공적인 결 과를 거뒀다. 또한 면역억제제로 CXCR4 표적 항체에 LCK 저해제인 dasatinib을 연결한 ADC가 개발되었다.
2.1.3. 개선된 작용자 기능
항체의약품은 항체의존성 세포 매개 세포 독성(ADCC), 항체 의존성 세포 매개성 식균 작용 (ADCP) 및 보체 의존성 세포 독성(CDC)와 같은 작용자기능(effector function)을 통해 표적 세포를 제 거하는 공통 기작을 갖는다. 항체의 Fc 부위 당화나 단백질 조작을 통해 ADCC를 증가시킨 항체들 (CCR4항체 mogamulizumab, CD20 항체 obinutuzumab)이 승인되었고, 이 외에도 탈푸코실화된 IL5Rα 항체인 benralizumab (Fasenra)를 비롯한 여러 다른 ADCC 강화 항체들과 FC 부위 조작을 통 해 ADCC와 ADCP를 증가시키는 항체의약품(CD19항체 MOR00208 (XmAb5574)이 임상 개발되고 있 다. CDC를 통해 표적세포를 제거하는 대표적인 약물은 ofatumumab (Arzerra)으로, 기존의 rituximab 에 내성이 생긴 종양세포주에 대해 보다 강력한 CDC 활성을 갖는 인간 항체에서 개발되었다. CDC 활성을 증가시키기 위해, 항체의 Fc부위와 보체 C1q의 결합을 증가시키고, 항체가 6량체(hexamer)를 만들도록 하는 단백질 공학이 적용되었다. 항체의 6량체화는 CDC를 향상시키는 새로운 접근법으로 서 임상 적용에 대해서는 추가적인 검증이 필요하다. 보다 나은 항체의약품을 만들기 위해, 항체 공 학을 이용하여 다양한 Fc 수용체에 대한 연구가 필요하며, 이를 통해 보다 개선된 작용자 기능이 다 른 면역-종양학 접근과 함께 상승효과를 낼 수 있는지 확인하는 것도 중요할 것이다.
2.1.4. 표적 조직에 대한 항체 선택성 향상
항체의약품의 치료 표적은 표적세포뿐 아니라 정상세포에서도 발현된다. 몇몇 ADC는 정상조 직에 작용함에 따른 이상반응으로 임상 도중 개발이 중단되기도 하였다. 따라서 항체의약품의 치료 표적 범위를 확장하기 위해서는 종양선택성을 증가시키는 것이 필요하다.
두 개의 종양 관련 항원을 표적으로 하는 이중특이성 항체를 이용하여 종양선택성을 향상시 킬 수 있다. 단, 항원의 발현 정도에 따라 항암 회피가 가능하고, 동반진단이 필요하며, 두 개 항원에 양성인 환자군으로 제한된다는 단점이 있다. 항체 전구약물, 일명 프로바디(probody)의 개발을 통해 표적 선택성을 향상시키는 방법도 있다. 프로바디는 항체 가변부위에 연결된 펩타이드가 단백질 분 해효소에 의해 분해되기 전까지 표적과의 결합을 약화시키는 기작을 이용한 것으로, 종양조직 특이 적인 항암효과를 나타낸다. 항-EGFR 프로바디는 모항체인 cetuximab과 비슷한 항암 효과와 더불어, 더 높은 안정성과 반감기를 나타냈고, 최근 CD166을 표적으로 하는 프로바디-약물 결합체의 임상 1 상이 시작되었다. 단, 프로바디-약물 결합체는 기존 ADC에 비해 정상세포에 대한 표적독성이 낮으나, ADC 대사나 약물 방출 등에 의한 비표적독성에는 영향을 주지 못할 가능성이 있다.
2.1.5. 암 면역 요법을 위한 면역 시스템 조절인자
면역관문억제제를 차단하는 항체의 승인은 암 치료에 대한 패러다임의 전환을 보여준다. 이 항체는 암세포를 직접 표적으로 삼지 않으며 항암 반응을 저해하는 경로를 억제한다. Ipilimumab (Yervoy)은 CTLA4결합을 통해 면역반응을 강화시켜 종양세포를 제거한다. Ipilimumab의 예는 항체를 이용한 면역관문 차단에 대한 강력한 임상적 검증을 보여주고 있다.
T 세포 기능을 조절하는 면역조절인자에 대한 항체도 개발되었다. 항-PD1 항체(nivolumab (Opdivo)와 pembrolizumab (Keytruda))와 항-PDL1 항체(atezolizumab (Tecentriq), avelumab (Bavencio), durvalumab (Imfinzi))가 광범위하고 다양한 종류의 암에 대해 승인되었다.
앞에 언급된 의약품의 예에서 볼 수 있듯이 암 면역치료에 대한 항체 개발에 갖는 기대치는 매우 높다. 항체 개발은 항체 투여량을 최적화시키는 데 그치지 않고, 다른 항체나 약물, 수술이나 방사선 요법과 같은 치료 방법들의 조합을 찾기 위한 노력으로 이어지고 있다. 면역관문의 양성/음 성 조절인자(림프구 활성화 유전자 3 (LAG3), A형 간염 바이러스 수용체 2 (HAVCR2), T 세포 수용체 (TIGIT), 유도성 T세포 조절자(ICOS), OX40, 4-1BB, VSIR 등)에 대한 항체들이 암에 대한 임상 개발에 도달했다.
많은 연구가 왜 소수의 환자만이 면역관문억제제에 대해 지속적인 반응을 보이는지, 저항성 은 어떻게 발생하고, 어떤 조합의 치료방법이 치료효과를 보이는지를 이해하는데 중점을 두고 있다. 많은 암이나, 환자, 환경적 요인들이 ‘암-면역 설정 지점(cancer-immune set point)’으로 일컬어지는 항암 면역 반응의 강도와 타이밍에 기여하는 것으로 보인다. 예를 들어, DNA 복구 유전자 결핍 (mismatch repair deficiency)은 더 많은 돌연변이에 의한 신생항원을 만들어낼 것이고, 면역관문차단 에 더 민감하게 반응할 것이므로, 고형암의 PD1 억제제가 항암효과를 나타낼 것으로 예상할 수 있 다. 최근 현미부수체 불안정성(microsatellite instability-high, MSI-H)이나 DNA 복구 유전자 결핍에 의 한 고형암의 치료제로 pembrolizumab과 nivolumab이 승인되었다.
2.2. 항체 작용제
수용체-리간드 결합 저해는 가장 넓은 범위에서 적용되는 항체 작용 기작이다. 좀 더 복잡한 작용제기작(agonism)은 오히려 표적 세포의 신호 활성을 촉진하기도 한다. 항체 작용제는 천연 리간 드의 세포 신호전달 특성을 모방하며, 높은 발현율과 열안정성/체내안정성, 증가된 반감기 등 천연 리간드에 비해 여러 이점을 갖는다. 또, 리간드 의약품에 대해 발생한 항-약물항체(anti-drug antibodies, ADAs)는 내인성 리간드를 제거하여 이상반응을 야기할 수 있어, 이에 대한 항체 작용제의 개발이 요구되고 있다.
2.2.1. 이합체화를 통한 수용체 활성화
대부분의 수용체는 리간드가 결합에 의한 이합체화를 통해 신호전달이 일어난다. 따라서 이 를 모방한 항체의 수용체 결합을 통해 신호를 활성화할 수 있다. 조혈인자에 대한 몇 가지 항체가 개발되었으나, 실질적인 활성을 나타내는 데 실패하였다. 이들 항체의 가변영역 거리에 따라 활성에 차이가 나타나는 결과는 이후 항체 작용제 개발에 항체의 구조와 유연성이 중요하다는 것을 강조한 다.
제2형 당뇨병과 비만 치료제로 FGF21 유도체가 큰 주목을 받고 있다. 최소 5개의 FGF21 개량버전이 초기 임상 진행되었으나, 단백질 분해에 취약하여 안정성이 낮고 쉽게 응집되어 생체 내에 서 빠르게 제거되는 단점이 확인되었다. 이와 같은 천연 리간드에서 발생할 수 있는 문제들과 발현 여부에 제한되는 활성의 문제를 피하기 위해 β-klotho 항체가 연구되고 있다. 또한 FGFR1과 β-klotho에 결합하여 이합체화를 유도하는 이중특이성 항체를 이용한 대안적 접근법도 제시되고 있다.
수용체 작용기능 이외에 다른 내인성 단백질의 활성을 모방하기 위해 이중특이성 항체가 쓰 이기도 한다. Emicizumab은 혈액응고인자 IXa와 X의 결합을 유도하여 혈액응고인자 VIII을 대체하며, 혈액응고인자 VIII 결핍으로 인한 혈우병 A의 치료제로 연구되고 있다. 기존 혈우병 치료제로 사용되 었던 재조합 VIII인자에 ADA가 유발되어 출혈 후유증이 나타난 반면, emicizumab은 임상 3상에서 ADA 유발 환자에서도 유의미한 출혈 감소를 보였고, 어떠한 ADA도 나타내지 않아, 최근 Hemlibra 로 승인되었다.
Fc 공학을 이용한 접근법도 제시되고 있다. 이 방법은 Fc 가변부위의 돌연변이(S267E, L328F) 를 통해 Fc 수용체와 B 세포 수용체의 결합력을 증가시키고 CD19+ B 세포의 음성조절신호를 유발한 다. XmAb5871로 알려진 이 항체는 전신성 홍반성 루프스 및 IgG4 관련 질환을 대상으로 현재 임상 2상 진행 중이며, 이와 유사하게 Fc 수용체와 막 IgE를 표적으로 하는 XmAb7195가 알러지와 천식 치료제로 임상 진행 중이다.
이밖에, 성장인자 수용체를 표적으로 하는 길항제 항체(1가 결합항체 또는 비정상적 항체)의 개발은 수용체의 이합체화를 방해하여 신호전달을 막아 세포의 증식을 저해할 수 있다.
2.2.2. 클러스터링을 통한 수용체 활성화
리간드-수용체의 복합체 클러스터링 형성을 통해 활성화되는 수용체 중 TNF 수용체(TNFRSF) 에 대한 항체 작용제 연구가 활발히 이루어지고 있다. 세포사멸수용체 DR4와 DR5, FAS, 림프독소 베 타수용체, OX40, 글루코코르티코이드-유도 TNFR 연관 단백질(GITR), CD27, 4-1BB, CD40 등에 대한 항 체 작용제가 보고되어 있으며, 대표적으로 세포사멸수용체 DR4 항체(mapatumumab)와 DR5 항체 (conatumumab, lexatumumab, tigatuzumab, drozitumab), 4-1BB 항체 작용제가 임상 2상에 진입하였 다. 이들 항체 작용제는 수용체의 발현 정도에 따라 효능 차이를 보이는데, 4-1BB 항체는 동일 세포 표면의 Fc 결합( cis co-engagement)을 유도하여 높은 효능을 보이는 반면, DR4와 DR5는 종양 미세 환경(tumor microenvironment)의 세포 간 FC 수용체 결합( trans co-engagement)을 필요로 해 효능이 낮은 편이다.
최근의 연구는 특정 FcγR의 생체 내 역할에 집중되고 있고, Fc 공학을 이용하여 최적화 가능 성을 보여준다. CD40 표적 항체 작용제는 억제성 수용체 FcγRIIB와의 cis / trans 결합을 통해 작용제 기능이 활성화되는데, Fc 조작을 통해 비 FcγR 보유 세포의 TNFR 활성화가 가능함을 확인했다.
작용제 기능과 활성은 항체의 결합력, 구조, 결정부위, 올리고머화 경향, 원자가 등에 의해 결정된다. 항-FAS 항체연구는 수용체의 해리 및 결합이 클러스터링과 활성화에 중요하다는 것을 보 여주며, 몇몇 항체들은 항체의 경첩부위, 항원결정부위, Fab 부위가 특정한 항원에 대한 활성을 결정 하는 데 중요하다는 것을 보여준다.
항체 작용제는 일부 항-CD20 항체를 제외하고는 임상 적용되는 사례가 적다. 그러나 Fc 수 용체 결합과 활성을 조절하는 기작에 대한 지속적인 연구는 보다 효과적인 항체의 임상개발에 도움 이 될 것이다. 또한, 천연 리간드의 생물학적 특성을 따르기 위해 신호전달과 세포에 미치는 영향에 대한 엄격한 특성 분석도 필요할 것이다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0003332.pdf
pdf_0003332.pdf