기술동향
First-in-human study 용량 설정에서 Drug metabolism / Pharmacokinetics (DMPK) 역할
- 등록일2021-01-12
- 조회수7102
- 분류기술동향 > 레드바이오 > 의약기술
First-in-human study 용량 설정에서 Drug metabolism / Pharmacokinetics (DMPK) 역할
서울대학교 약학대학 약제학 연구실 정석재
First-in-human (FIH) study 란 사람에서 신약의 체내동태 (pharmacokinetics)를 연구하고 잠정적인 유효농도(또는 용량)를 설정함으로써 향후 연구에서 신약의 적정 용량 (right dose) 을 결정하는 연구를 말한다. 보통 FIH study 용량은 1) NOAEL (no observed adverse effect level) 을 기반으로 하는 방법, 2) MABEL (minimal anticipated biological effect levels)을 기반으로 하는 방법, 3) 유사한 약물의 용량을 기반으로 하는 방법, 또는 4) 전임상시험에서 얻은 실험동물의 체내동태 결과로 계산하는 방법 등으로 결정한다. 이번 기고문에서는 주로 4)항의 체내동태를 이용한 결정 방법을 정리하여 다루려고 하지만, 약학자들이 친숙한 NOAEL 방법이 가지는 잠재적인 문제점에 대해서 잠시 언급하려고 한다.
보통 NOAEL 방법은 상당히 보수적인 방법으로 알려져 있어, 비교적 우수한 안정성을 가진다고 인식되어 왔다. 그런데, 용량 계산의 핵심이 되는 safety factor [동물에서 추정한 human equivalent dose (HED)를 나누어 maximum recommended starting dose (MRSD)를 계산하는데 사용하는 인자; 보통 10으로 설정] 가 타당한지에 대해 검토해야 할 필요가 있다고 생각한다. 문헌에 의하면 anti-CD28 monoclonal antibody 신약 물질인 TGN1412의 임상 1상 시험에서 cytokine storm 이 보고된 적이 있었다1). 이 임상시험에서는 safety factor를 매우 보수적인 값인 160으로 상정하여 계산했음에도 (NOAEL 50 mg/kg -> HED 16 mg/kg -> MRSD 0.1 mg/kg) 불구하고, 사람에서 심각한 부작용이 관찰되었다고 한다. 또, 만약 MABEL 법을 적용했다면 계산했다면 MRSD가 0.001 mg/kg에 해당한다고 하였다1). 따라서 NOAEL에서 설정한 safety factor는 별로 타당하지 않을 수 있으며 임의적일 수 있으므로 주의가 필요하다 라고 할 수 있다.
전임상시험에서 얻은 실험동물의 체내동태를 이용한 방법으로 용량을 계산하려면 아래 식 1을 사용한다.
용량 = 동물에서 관찰된 AUC x 사람에서의 클리어런스 (CL) ÷ 사람에서의 흡수율 (F) (식 1)
여기서 AUC란 혈중농도-시간 곡선의 면적으로 말하며, 클리어런스 (CL) 는 약물 소실과 관련된 체내동태 파라미터이다. 위 식은, 사람의 예상치가 적절하였을 경우, 계산된 용량을 사람에 투여했을 때 얻어진 AUC가 ‘동물에서 관찰된 AUC’ 와 같을 것이라는 의미이다. 따라서 사람에서의 CL 및 F 추정치는 용량 계산에서 매우 중요할 것이다.
사람에서의 CL를 추정하는 방법으로는 종간 스케일링 (이하 interspecies scaling), in vitro-in vivo extrapolation (이하 IVIVE) 및 computational approach (이하 in silico 법) 기법 등을 들 수 있다. Interspecies scaling은 간단한 allometry를 말하는 것으로 보통 physiological 파라미터 (예, CL) 가 종간의 체중(BW)에 간단한 지수함수적 관계가 있다고 본다 (식 2).
= × b (식 2)
실제 현장에서는 보통 4종 이상의 실험동물 종으로부터 얻은 CL 결과치를 가지고 회귀분석하여 (식 2)의 a와 b를 결정한다. 이렇게 얻어진 관계식에 사람의 평균 체중을 대입하면 사람의 CL 값을 얻을 수 있다. 여기에서 파생된 방법으로는 physiological 파라미터로서 비결합형에 대한 CL 또는 고유 CL를 쓰는 경우도 있다. 이러한 방법들은 보통 저분자량 약물에 대해서 비교적 양호한 예측력을 가진다고 하여, 신약개발시 빈용되는 방법이다. 그러나, 문헌에 의하면 interspecies scaling 법으로 사람의 반감기를 예측하였을 때 실측치에 4배 이상이 되는 약물이 전체의 30% 정도2)에 달한다고 하였고 본 연구실에서도 이 방법을 적용했을때 생리학적으로 불가능한 값이 산출되었던 경험도 있었다. 또, 문헌3)에서는 단백결합이 큰약물, 간대사가 큰 약물 및 능동수송의 대상이 되는 약물 등의 경우에는 적용하기 곤란하다고 알려져 있어, interspecies scaling 법이 적절하지 않을 수 있다는 점을 고려해야 한다. 이와 관련하여 적용이 어려운 경우인지 여부는 보통 전임상연구 단계에서 확보한 결과로부터 충분히 추론할 수 있을 것이다.
사람의 CL를 추정하는 또 다른 방법으로 IVIVE 기법을 들 수 있다. 이미 이 기법에 관한 좋은 리뷰나 논문들이 있으므로 [예, Ito and Houston, 20054)] 더 자세한 내용은 해당 논문들을 참고할 수 있을 것이다. IVIVE 방법의 핵심 아이디어는 간에서의 CL가 전신 클리어런스의 대부분을 차지할 것이라는 점과 간에서의 CL는 동태학 이론상 고유 CL로부터 계산할 수 있다는 것이다. 이러한 핵심 아이디어는 이미 학부 수준의 생물약제학 및 체내동태학에서 많이 다루어진 내용이므로 여기서는 따로 언급하지는 않는다. 실제 현장에서는 in vitro에서 계산한 고유 CL로부터 in vivo 고유 CL를 환산하기 위해서는 소위 ‘physiologically based scaling factor’ 가 필요한데 사람의 경우에는 약 856 mg/체중 kg 의 정도의 값을 쓰는 것이 보통이다.
다만, physiologically based scaling factor는 종마다 다르고 (예, rat의 경우 약 1580 mg/체중 kg) 더 자세하게는 사용한 간 마이크로좀의 회수율에 따라 달라진다. 실제로는 batch 마다 다른 값을 쓰는 경우도 있고 또 다른 경우에는 실험실의 프로토콜에서 검증한 값을 상수처럼 쓰기도 하므로 일률적이지는 않다. 그런데, 문헌에 따르면 scaling factor를 적용하였을 때 계산치의 underestimation 이 보고되어4) 실험동물에서 써서 정한 ‘drug specific scaling factor (DSF)’를 추가적으로 적용하기도 한다 (식 3):
= CLint,animal,vitro/Clint,animal,vivo (식 3)
위 식에서 CLint,animal,vivo란 어떤 실험동물을 가지고 in vivo에서 계산한 고유 CL를, CLint,animal,vitro란 그 동물종의 간 마이크로좀 (in vitro) 으로 구한 고유 CL를 말한다. 즉, 이 scaling factor는 한 동물종 in vivo 실험과 in vitro 실험 간의 차이점을 보정치라고 볼 수 있고, 일반적으로 실험동물에서 정한 보정치가 사람에서도 유효하다고 보고 있다. 이 DSF는 보통 크지 않아야 하는데 만약 값이 매우 클 경우 (예, 10 이상) 혹시 사용한 in vitro 실험계가 잘 작동하는지, 추가적인 동태학적 과정 (예, 능동 수동) 은 개재되어 있지 않은지 등을 검증해야 한다. 만약 실험계 자체에 문제가 없을 경우, physiologically based scaling factor와 DSF 보정하면 보통 매우 우수한 상관관계 및 예측성을 보이며 (계산치가 실측치 2배 이상인 경우의 비율이 현저히 감소) 특히 앞서 말한 CL 예측의 underestimation 문제도 현저히 개선된다고 하므로 이 방법은 향후 FIH 용량 설정에 적용하는 것을 충분히 고려할 만하다고 생각된다.
사람의 CL 예측에서 비교적 최신의 기법으로는 인공지능을 이용하는 in silico 방법을 들 수 있다. 이미 이전 전문가 기고에서 인공지능과 신약개발에 관한 내용이 다루어 졌으므로 여기서는 CL 예측 분야에 국한하여 다루려고 한다. 약 10 년 전 연구에서 사람 CL를 in silico 방법으로 예측하였을 때 실측치와 예측치 간의 차이가 너무 커서 도저히 실용적이라고 볼 수 없었던 (예, 예측치가 실측치의 100 배를 벋어 나는 경우 있었음) 반면, 최근에는 예측치가 실측치의 2배 이내에 들어간 화합물의 숫자가 70% 이상이었다는 고무적인 보고5)가 있었다. 사람의 CL를 인공지능 모델로 예측하는 능력이 잘 재현된다는 전제로 이러한 computational approach는 신약개발연구에 대대적인 변화를 초래할 수도 있을 것이다.
실제로 1990 년대에서 2000년 사이에 개발되었던 소위 ‘in vitro drug metabolism /pharmacokinetics (DMPK) 기술’ (예, 단층세포막을 이용한 흡수율 추정, 간 마이크로좀을 이용한 대사 안정성 연구 등) 은 신약개발연구에 도입되어 현재 활발히 적용되고 있는 점을 고려하면, 이 in silico 기법도 향후 신약 개발에 다양하게 적용될 수도 있다고 짐작할 만하다. 다만, 약과학의 발달로 DMPK 분야의 스크리닝 요구 사항이 점점 더 어렵고 복잡해지고 있어 in silico 스크리닝 기법 만으로 현장의 요구를 충족할 수 있을지는 좀 더 두고 봐야 한다. 예를 들면 신약개발에서 후보물질이 주요 약물수송체의 기질 또는 저해제로 작동하는지를 스크리닝하거나 비선형 대사 과정이 개재되어 있을 경우 동태학 파라미터를 예측할 필요가 있는데, 현재 수준의 computational pharmacokinetics의 능력으로는 이러한 요구사항을 충족할 수 없다. 필자는 in silico 기법이 in vitro 기법과 동시에 사용되는 형태로 발전하지 않을까 예상하고 있다.
사람에서의 CL 예측은 비교적 다양한 방법이 공존하여 사용되는 반면, 사람에서의 흡수율 (F) 예측은 비교적 간단, 명료하다고 할 수 있다. 즉, 2000년 이전의 in vitro DMPK 연구의 결과로 사람에서 F를 예측하는 유효한 in vitro 연구 시스템이 도출되어 사용되고 있었는데, 대표적인 것들로는 대장 상피세포에서 유래한 Caco-2 세포단층막을 이용한 방법, 개의 신장 세포에서 유래한 MDCK 세포단층막을 이용한 방법 또는 인공지질막을 이용한 PAMPA 방법 등을 들 수 있다.
이들 실험계는 모두 약물의 in vitro permeability 와 사람의 F간의 우수한 상관관계가 보고되어 수차례 검증되었다. 따라서 사람의 F 추정하려면 먼저 물질의 in vitro permeability를 측정하고 permeability – 사람 흡수율을 상관 관계식으로부터 사람의 F을 산출하면 된다. 다만, 앞서 말한 우수한 상관 관계란 주로 확산에 의해 흡수되는 물질 들에 대하여 수립된 것이므로 만약 장관 흡수 과정에 약물 수송계로 흡수되는 물질이라면 예측한 흡수율이 현저히 다를 수 있다. 이런 경우에서는 실험동물에서 비선형 흡수과정을 평가하여 사람으로 외삽하는 기법을 쓰는 등 복잡한 과정을 거쳐야 한다. 최근 신약개발 연구에서는 주요 약물수송체에 대하여 후보물질이 수송체의 기질이 되는지를 사전에 스크리닝하고 있는 추세이므로, 언급한 permeability 스크리닝 계에서 예측한 흡수율에 문제가있을지 없을지는 비교적 용이하게 추론할 수 있다.
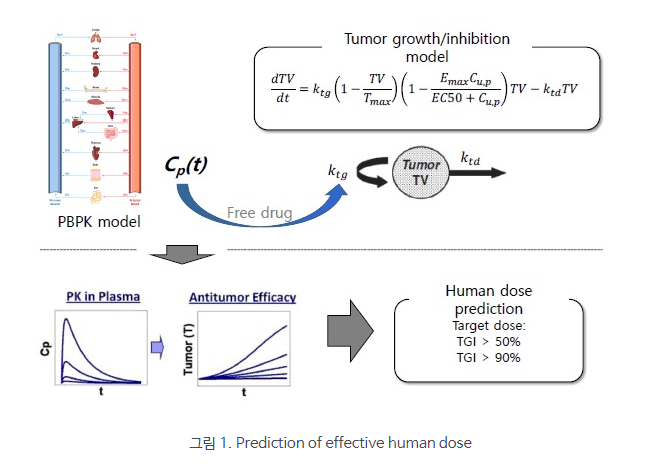
본 기고문에서는 DMPK 기법에 근거하여 FIH 용량을 설정하는 방법 중 사람의 CL와 F를 추정하는 여러가지 방법을 소개하고자 하였다. 따라서, 더 자세한 내용에 대해서는 과감히 생략할 수 밖에 없었던 점에 관한 이해를 부탁드린다. 마지막으로 최근의 관련 연구동향에 대해서 언급하자면 생물약제학 연구의 발달로 약물수송체가 체내동태에서 중요한 역할을 차지하는 것이 알려지게 되었고, 사람 CL와 F를 잘 예측하기 위해서는 더 복잡한 동태학 모델을 사용해야만 하게 되었다. 이에 따라 점차적으로 physiologically based pharmacokinetics (PBPK) 기반으로 하는 simulation 연구로 용량을 설정하는 추세가 두드러지게 되었다. 이러한 연구 추세의 예로서 보인 그림 1은 본 연구실에서 PBPK 모델과 indirect effect 모델을 연결하여 약리효과를 simulation 한 연구의 모식도를 보인 것이다. 이런 연구에서는 주어진 용량에서 특정 수준의 약리효과가 지속되는 시간을 계산하거나 원하는 약리 효과가 유지되는 용량을 추정하는 등 좀 더 미세하고 정확한 예측/추정이 가능해진다. 향후에는 이러한 연구 방향으로의 변화가 더 명확해질 것으로 예상된다.
인용논문
Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. Suntharalingam G, Perry MP, Ward S, Brett SJ, Castello-Cortes A, Brunner MD, Panoskaltsis N. N. Eng. J. Med., 255: 1018-1028, 2006.
Prediction of human pharmacokinetics from preclinical information: Comparative accuracy of quantitative prediction approaches. Hosea NA, Collard WT, Cole SC, Maurer TS, Fang RX, Jones H, Kakar SM, Nakai Y, Smith BJ, Webster R, Beaumont K. J. Clin. Pharmacol., 49: 513-333, 2009.
To scale or not to scale: the principles of dose extrapolation. Sharma V, McNeill JH. Br. J. Pharmacol., 157: 907-921, 2009.
Prediction of human drug clearance from in vitro and preclinical data using physiologically based and empirical approaches. Ito K, Houston JB. Pharm. Res., 22: 103-112, 2005.
Direct comparison of total clearance prediction: Computational machine learning model versus bottomup approach using in vitro assay. Kosugi Y, Hosea N. Mol. Pharmaceut., 17: 2299-2309, 2020.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.

