기술동향
RAS 표적화 치료법: 불가능에서 가능으로?
- 등록일2021-01-19
- 조회수6068
- 분류기술동향 > 레드바이오 > 의약기술
-
자료발간일
2021-01-14
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#RAS#신약개발#공유 억제제
- 첨부파일
RAS 표적화 치료법: 불가능에서 가능으로?
요약문
10년 전만 해도 RAS를 표적으로 하는 치료제는 ‘발굴 불가능(Undruggable)'으로 여겨졌다. 최근 비소세포성 폐암(non-small-cell lung cancer)에서 가장 많이 나타나는 돌연변이 RAS 대립유전자인 KRASG12C 특이적 공유 억제제의 개발로 RAS-유발 암의 치료 전략을 논의할 수 있게 되었다. RAS 돌연변이의 생화학적 특성과 발생 조직은 치료 효과에 영향을 미친다. 현재, 대립유전자 특이적 억제제로 돌연변이 RAS를 직접 억제하는 것이 가장 좋은 치료 방법이다. 또한 이런 RAS 억제제, 면역 체크포인트 억제제 또는 T세포 표적화 등을 RAS 활성화/이펙터(effector) 경로 표적화와 병용하여 RAS-돌연변이 종양을 치료할 수 있다. 이 리뷰에서는 이와 같은 돌연변이 RAS 단백질의 표적화 치료법 및 병용 전략을 다룬다.
목 차
1. 서론
2. RAS 돌연변이와 스플라이스 변이체(Splice variants)
3. 돌연변이 RAS의 생화학적 특성
4. RAS 직접 표적화 방법
4.1. KRAS-G12C 공유 억제제
4.2. 다른 돌연변이-특이적 방법
4.3. RAS–이펙터 상호작용 억제제
5. RAS 간접 표적화 방법
5.1. 뉴클레오티드(GDP-GTP) 교환 억제제
5.1.1. SOS 억제제
5.1.2. SHP2 억제제
5.2. RAS 프로세싱(processing) 억제제
5.3. RAS 다량체화와 이펙터 결합
5.4. RAS 경로 표적화
5.4.1. 합성 치사 스크리닝(Synthetic lethal screens)
5.4.2. EGFR 계열
5.4.3. MAPK 경로: RAF 억제제
5.4.4. MAPK 경로: MEK 억제제
5.4.5. MAPK 경로: ERK 억제제
5.4.6. PI3K 경로 억제제
6. 새로운 치료법
6.1. Small interfering RNA (siRNA) 치료법
6.2. 자가포식(Autophagy)
6.3. 면역치료
6.3.1. 면역 체크포인트 억제제
6.3.2. 입양 면역 치료
6.3.3. 암 백신
7. 결론
1. 서론
RAS (KRAS, NRAS 및 HRAS)는 암에서 가장 많이 돌연변이가 일어나는 유전자군으로 그중에서도 KRAS 돌연변이는 폐암, 대장암 및 췌장암의 원인이다. 최근 FDA가 대립유전자 특이적 공유 억제제인 AMG 510을 패스트트랙(Fast Track)으로 지정함에 따라 돌연변이 KRAS 선택적 치료법의 임상 승인이 가시화되고 있다. AMG 510이 비소세포성 폐암에 가장 많이 발견되는 RAS 돌연변이인 KRAS-G12C에 결합하여, KRAS-G12C를 성공적으로 억제함으로써 다양한 돌연변이 RAS 대립유전자 특이적 표적화 가능성을 엿볼 수 있게 되었다.
정상 세포에서 RAS는 표피 성장인자 수용체(epidermal growth factor receptor; 이하 EGFR) 계열을 비롯한 성장인자 수용체의 세포막 내부 하위에서 활성화된다 (그림 1). RAS는 스위치 역할을 하는 신호전달 GTPase로서 GTP-결합의 활성 상태와 GDP-결합의 비활성 상태를 오간다. RAS 단백질은 내재적 GTP 가수분해 및 뉴클레오티드(이 리뷰에서는 RAS에 결합하는 GDP와 GTP를 가리킴) 교환 능력을 가진다. 그러나, 세포 내 신호전달에서 RAS 단백질의 활성은 주로 GTP 결합을 촉매하는 구아닌 교환인자(guanine exchange factors; 이하 GEF)에 의한 활성화와 GTP 가수분해를 증가시키는 GTPase 활성화 단백질(GTPase-activating proteins; 이하 GAP)에 의한 비활성화로 조절된다. GTP-결합 RAS는 마이토젠-활성 단백질 키나아제(mitogen-activated protein kinase;이하 MAPK)와 포스파티딜이노시톨 3-키나아제(phosphatidylinositol 3-kinase; 이하 PI3K) 경로를 포함한 여러 하위 이펙터(effector) 경로와 직접 상호작용하며 해당 경로를 활성화한다.
일반적으로 RAS 돌연변이는 GAP가 필요하지 않은, 활성 GTP-결합 상태의 RAS로 ‘고정’시킨다. 이를 통해 구아닌 교환 주기를 방해하여(RAS의 비활성화가 일어나지 않으므로) 종양 세포 성장에 필요한 하위 신호전달 경로를 활성화한다.
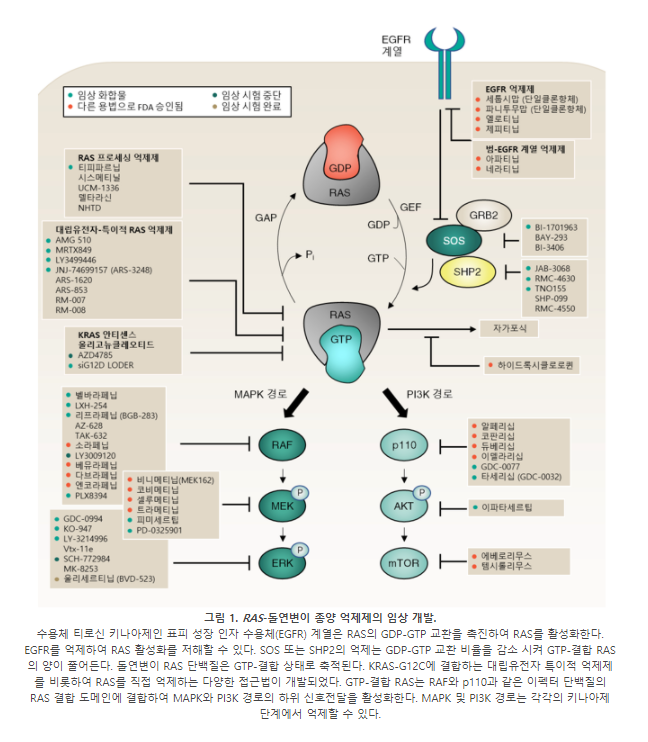
이 리뷰에서는 돌연변이 RAS 단백질을 표적으로 하는 치료법의 최근 발전을 설명하고, RAS 억제의 임상적 효과를 증가시킬 수 있는 병용법을 다룬다 (그림 1). RAS 이소체(isoforms)에 따른 유병률과 생화학적 특성의 차이를 설명하고, KRAS-G12C를 표적으로 하는 치료법과 Son of Sevenless homologue 1 (이하 SOS1), SHP2 (PTPN11) 및 RAS 막 결합을 차단하는 억제제를 중심으로 RAS를 직간접적으로 억제할 수 있는 전략을 다루고자 한다. 또한 RAS와 연관된 MAPK 및 PI3K 경로를 표적으로 하는 억제제를 알아보고, 마지막으로 RAS-돌연변이성 종양을 치료하기 위한 새로운 치료 전략을 논의할 것이다.
2. RAS 돌연변이와 스플라이스 변이체(Splice variants)
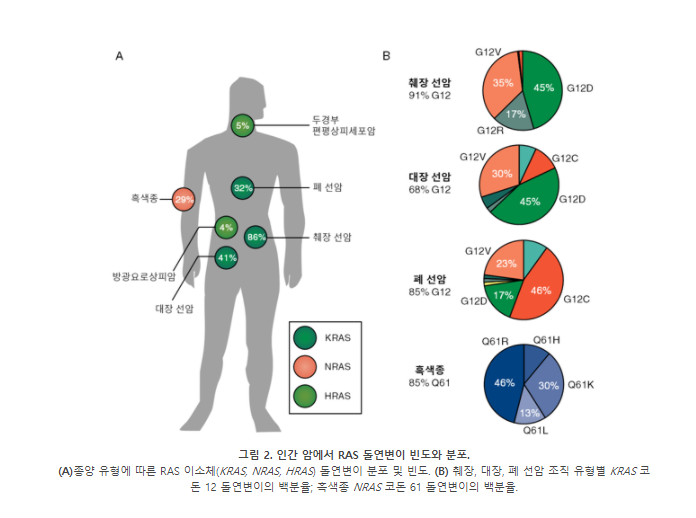
RAS 돌연변이는 대장암, 췌장 선암(pancreatic ductal adenocarcinoma; PDAC), 폐 선암(lung adenocarcinoma; LUAD; 비소세포성 폐암의 하위 유형), 흑색종, 특정 혈액암 등 수 많은 암의 유전적 요인이다. 종양은 RAS 돌연변이로 인해 발병하지만, 돌연변이가 일어나는 RAS 이소체(KRAS, NRAS, HRAS), 코돈(codon), 돌연변이 빈도는 조직에 따라 다르다 (그림 2). 예를 들어, 폐 선암(32%), 췌장 선암(86%) 및 대장 선암(41%)의 많은 비율은 주로 KRAS 코돈 12의 돌연변이에 의해 일어난다 (그림 2). 반면 흑색종의 29%는 NRAS의 돌연변이에 의해 유발되며, KRAS와 달리 NRAS는 주로 코돈 61에 돌연변이가 발생한다 (그림 2).
HRAS 돌연변이는 KRAS나 NRAS의 돌연변이보다 발생 빈도가 낮지만, 일부 두경부 편평상피세포암(head and neck squamous cell carcinoma; HNSCC; 5%) 및 방광암(6%)이 HRAS 코돈 12 또는 61의 돌연변이에 의해 발생한다 (그림 2A). 유전적 조작 쥐 모델 (genetically engineered mouse models; 이하 GEMM)을 통해 환자 종양에서 관찰된 이소체와 코돈 돌연변이 선호도를 연구할 수 있었다. 결장 상피 세포(colonic epithelial cell)에서 KrasG12D 발현은 세포의 과다증식을 초래했지만, Nras G12D의 발현은 세포 증식에 영향이 없었다. 멜라닌 세포(melanocytes)에서는 Nras G12D가 아닌 Nras Q61R의 발현이 흑색종을 유발했다. 따라서 RAS-유발 암을 표적으로 할 때에는 특정 이소체 및 코돈 돌연변이를 염두에 두어야 한다.
KRAS 유전자는 서로 다른 엑손 4를 포함하는 두 개의 스플라이스 변이체를 암호화하여 KRAS4A와 KRAS4B를 생성한다. KRAS4A는 C 말단(C terminus)에 추가로 22~23개의 아미노산이 있어 번역 후 변형(post-translational modification; 이하 PTM)과 세포막 위치가 다르다. KRAS4B는 모든 인간 암에서 발현되고 또한 과발현되어 오랫동안 주요 이소체로 간주되었다. 그러나, 최근에 KRAS4A가 암 세포주에서 널리 발현되고 대장 종양에서는 KRAS4B와 동등한 수준으로 발현되는 것으로 밝혀졌다. GEMM은 KRAS4A가 없어도 생존 가능하다; 엑손 4A를 유전적으로 제거하여도 배아는 생존했지만, Kras가 없을 경우 배아는 죽게 된다. 최근 Kras4B 또한 없어도 쥐 생존에 문제가 없는 것으로 나타났는데, 발달 과정에서는 두 이소체가 중복적인 기능을 수행하기 때문에 가능한 것이었다. 그러나 Kras4A 또는 Kras4B의 결실은 폐 종양 형성에 대한 내성을 초래했다. 즉, 종양 생성에는 두 가지 이소체가 모두 필요한 것으로 보인다. 또한 이 두 가지 이소체는 종양 미세환경에서 각각 특정한 역할을 수행할 수 있다. KRAS4A 발현은 저산소증과 같은 스트레스에 대한 적응성을 증가시키고, KRAS4B는 줄기세포 및 전구세포에서 발현된다. 이런 최근 연구 결과로 종양 형성에서 KRAS4A의 역할이 새롭게 조명되었다.
3. 돌연변이 RAS의 생화학적 특성
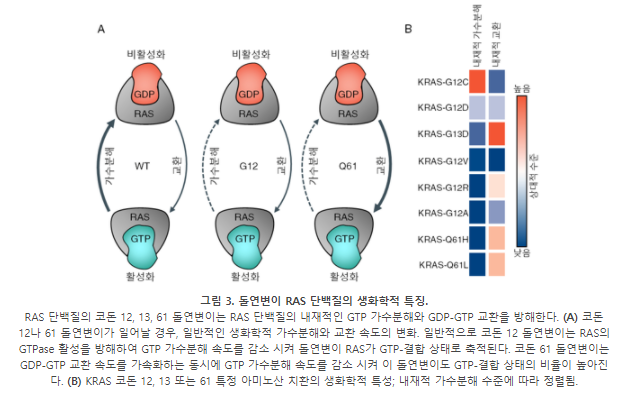
RAS와 같은 Small GTPase는 GDP-결합 비활성 상태와 GTP-결합 활성 상태를 순환한다 (그림 3). SOS 또는 Ras guanyl nucleotide-release protein (RasGRP)과 같은 GEF는 RAS의 GDP를 GTP로 바꾸는 과정을 촉진한다. Neurofibromin (NF1), p120GAP를 비롯한 GAP는 GTP 가수분해를 매개하여 RAS를 비활성 GDP-결합 상태로 되돌린다. RAS의 코돈 12, 13 및 61에 일어난 돌연변이는 GAP에 의한 GTP 가수분해를 방해하여 돌연변이 RAS가 지속적으로 GTP-결합 상태로 축적된다 (그림 3). 이렇게 축적된 GTP-결합 RAS는 하위 경로(특히 MAPK 및 PI3K 경로)를 활성화하여 세포 증식을 촉진한다.
RAS 돌연변이마다 내재된 GTPase 활성도와 GDP-GTP 교환 속도는 다를 수 있다. 예를 들어, 코돈 12, 13 및 61 돌연변이는 일반적으로 p120GAP에 의한 가수분해 속도를 감소시킨다. KRAS-G12C 역시 p120GAP에 의한 가수분해 속도는 감소하지만, 내재된 GTPase 활성은 WT (wild-type)와 거의 비슷하다. 실제로 KRAS-G12C의 이러한 고유한 생화학적 특성은 GDP-결합 KRAS-G12C의 공유적 억제제를 사용하여 KRAS-G12C를 표적화하기 위해 활용되었다. 반면 KRAS-G13D는 WT RAS에 비해 내재적 교환 활성도가 증가하여, GDP-결합 상태로 머무는 시간이 짧아진다 (그림 3). 코돈 13 돌연변이 KRAS는 부분적으로 NF1 GAP-매개 가수분해에 반응하지만, 코돈 12나 61 돌연변이 KRAS는 NF1에 영향을 받지 않는다. 흥미로운 점은, KRAS의 코돈 13 돌연변이는 빈번하게 NF1 돌연변이와 함께 보고된다는 것이다. 이와 같은 RAS 돌연변이의 생화학적 특성 차이를 이해하는 것이 대립유전자 특이적 억제제가 RAS의 어떤 결합 상태를 표적으로 삼는 것이 적합할지 결정하는 데 도움이 된다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보
지식
동향


 pdf_0003682.pdf
pdf_0003682.pdf