기술동향
노바백스社, 재조합단백질 기반 코로나19 백신개발 현황
- 등록일2021-01-21
- 조회수6182
- 분류기술동향 > 기타 > 기타
-
자료발간일
2021-01-21
-
출처
생명공학정책연구센터
- 원문링크
-
키워드
#노바백스사#재조합단백질#코로나19 백신개발
- 첨부파일
노바백스社, 재조합단백질 기반 코로나19 백신개발 현황
※ 청년의사(‘20.09.03) https://www.docdocdoc.co.kr/news/articleView.html?idxno=2002491,
동아사이언스(‘20.12.29) http://dongascience.donga.com/news.php?idx=42764,
뉴욕타임스(‘20.12.31) https://www.nytimes.com/interactive/2020/health/novavax-covid-19-vaccine.html 등
동아사이언스(‘20.12.29) http://dongascience.donga.com/news.php?idx=42764,
뉴욕타임스(‘20.12.31) https://www.nytimes.com/interactive/2020/health/novavax-covid-19-vaccine.html 등
< 노바백스 코로나19 백신 ‘NVX-CoV2373’ 개요 >
ㅇ (백신 플랫폼) 안전성이 높은 ‘재조합 단백질’ 기술 기반의 백신 후보로, 재조합 기술로 변형시킨 코로나19 스파이크 단백질을 곤충세포에서 발현시킨 후 나노입자 형태로 백신 후보물질 제작
- 백신 후보물질과 함께 자사가 개발한 면역증강제 ‘Matrix-M’을 보조요법으로 사용해 중화항체 형성 유도
※ 면역증강제로서 식물성 화합물인 사포닌(saponin) 성분이 보충되었으며, 다른 코로나19 백신에서 알레르기 반응에 대한 우려가 제기된 폴리에틸렌글리콜(PEG)은 불포함
※ 재조합 단백질 백신은 단백질 서브유닛 백신, 합성항원 백신이라고도 하며, 바이러스 외형을 이루는 단백질을 만들어 투여하므로 안전하지만, 바이러스 자체로 만든 백신 대비 면역반응 자극 효과가 떨어져 면역증강제를 함께 투여하는 경우 다수
[참고] 노바백스 백신 개발 원리
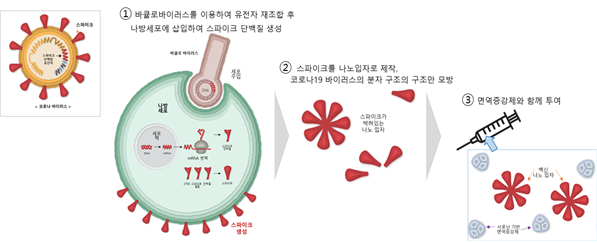
출처 : 뉴욕타임스, How the Novavax Vaccine Works, 2020.12.31., 생명공학정책연구센터 재가공
ㅇ (접종횟수/저장온도) 21일 간격으로 2회 접종, 냉장 2~8도에서 최대 3개월 저장 및 유통 가능
ㅇ (자금지원) 미국 정부로부터 16억 달러, CEPI로부터 약 3억 8,800만 달러의 R&D 비용을 지원받아 개발 추진
ㅇ (공급계약) 미국 1억 회, 영국 6천만 회, 캐나다 7천 6백만 회, 호주 4천만 회분 등 다수 국가에서의 공급 계약 체결
※ 국내에서는 SK바이오사이언스와 위탁개발생산(CDMO) 계약 체결(‘20.813)
< 임상시험 추진현황 >
ㅇ (임상 1상) 호주, 미국에서 건강한 18∼59세 임상참여자 131명 대상, 두 가지 용량(5ug, 25ug)에 대한 효능 및 안전성 평가에서 심각한 부작용 없이 효능 검증 완료(‘20.9.2)
- 83명의 참가자는 백신 후보와 함께 ‘Matrix-M’ 보조제 투여, 25명은 백신 후보만 투여, 23명에게는 위약을 백신과 함께 투여
- 'Matrix-M'를 병용한 'NVX-CoV2373' 5μg 2회 접종은 대부분의 증상이 있는 코로나19 환자의 회복기 혈청에서 나타나는 항 스파이크 면역글로불린 및 중화항체 반응을 초과하는 효과 유도
관련논문 : Phase 1–2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine(NEJM, ‘20.9.2)
ㅇ (임상 2상) 남아프리카공화국에서 HIV 감염자 240명 포함 4천 명 이상의 참여자를 대상으로 임상 2b상 시험 진행 중(’20.8~)
※ 그 외 호주에서도 임상 2상 진행 중
ㅇ (임상 3상) 재조합 단백질 기반 백신 후보 중 가장 빠른 속도로 영국에서 임상 3상 시험 진입(9.24), 이 후 미국, 멕시코에서 순차적으로 3상 시작(12.28)
- 영국에서 18∼84세 5천명을 대상으로 임상 3상을 시작하였으며, 이 후 글로벌 기준에 맞게 1만 5천명으로 확대 재설계 후 진행 중
※ 영국 임상은 유럽의약품청의 권유로 주요 효능평가 지표를 단일 지표로 변경, 신뢰 구간의 하한 값을 타 제약사 수준으로 조정, 임상 참여자 확대
※ 총 1만 5천명 피험자 등록 완료(11.30), 25% 이상의 참여자가 65세 이상으로 기저질환을 앓고 있는 사람이 많은 비중 차지
※ 영국 임상시험 중간결과는 2021년 1분기 초에 제공될 예정
- 미국에서의 임상시험은 백신 제조 규모 증대 등의 문제로 두 차례 연기되었으나, 최근 미국 108개 지역, 멕시코 7개 지역에 있는 18세 이상 3만 명을 대상으로 임상 3상 시작(12.28)
※ 미국 노스캐롤라이나에 위치한 후지필름 산하 다이오신스 바이오테크놀로지의 제조시설에서 생산된 임상시험용 백신을 FDA로부터 승인받는 기간이 오래 소요되어 임상 연기
※ 미국 CDC 권고에 따라 흑인 참가자 최소 15%, 히스패닉 10~20%, 인디언 원주민 1~2% 등 소수 인종 참가 지원을 받을 예정
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 20210114_BioIN_코로나19 모니터링_노바백스 재조합단백질 기반 ...
20210114_BioIN_코로나19 모니터링_노바백스 재조합단백질 기반 ...