기술동향
세포 신호전달 조절 인공 후성유전조절 효소 플랫폼로서의 CRISPR-Cas 시스템
- 등록일2021-03-11
- 조회수4825
- 분류기술동향 > 플랫폼바이오 > 바이오융합기술
-
자료발간일
2021-03-08
-
출처
한국분자세포학회
- 원문링크
-
키워드
#바이오기술#세포 신호전달#CRISPR-Cas 시스템
세포 신호전달 조절 인공 후성유전조절 효소 플랫폼로서의 CRISPR-Cas 시스템
◈서론
후성유전은 DNA 염기서열의 변화 없이, DNA, RNA, 단백질 등 단백질 생성 정보 전달 인자들의 변형을 통해 유전자발현을 조절하는 상태, 또는 이러한 유전자 기능의 변화가 유전되는 현상을 말한다. 후성유전학은 생활조건, 생활 방식, 유전자 발현 및 건강 사이의 상호 작용을 포함하며 그 효과는 미래 세대에 유전 될 수 있다고 알려져 있으며, 부의 되물림역시도 이러한 후성유전학으로 설명 가능하다는 흥미로운 연구 결과들이 보고 되고 있다. 유전자치료 분야에서 혁명적인 변화를 일으키고 있는 CRISPR-Cas 시스템은 유전체 편집 이외에도 이러한 후성유전의 인위적 조절을 위한 플랫폼으로서의 연구 역시 활발히 진행되고 있다. 본 기고문에서는 세포 신호전달 조절 플랫폼, 특히 인공 후성유전 조절 효소로서의 CRISPR-Cas 시스템의 활용 및 현 연구 현황에 대해 알아보고자 한다.
◈본론
세포 신호전달 조절 플랫폼으로서의 CRISPR-Cas 시스템
현재까지 보고된 신호전달 조절 플랫폼으로서의 CRISPR-Cas 시스템의 활용은 2가지로 구분할 수 있다. 첫번째는 신호전달에 핵심역할을 지닌 유전자의 발현을 강화 또는 억제하여 조절함으로써 신호전달을 켜고, 끄는 (on/off) 방법이다. 두번째는 세포 내에 자연적으로 존재하는 신호전달의 기전을 강탈 (hijacking) 하여 인위적인 (artificial) 유전자의 발현을 유도하는 방법이다.
첫번째 방법은 catalytically inactive Cas9 (dCas9)에 전사조절인자를 결합하여 유전자의 발현을 강화 또는 억제하는 방법으로써, 대표적인 전사조절인자는 VPR (VP64, P65, and Rta)[1] 그리고 Kruppel-associated Box (KRAB)[2]가 널리 활용되고 있으며, 각각 activator와 repressor로 작용하여 유전자의 promoter를 통해 목표하는 유전자의 발현을 상승 (CRISPRa) 또는 억제 (CRISPRi) 시킬 수 있다. KRAB은 유전자 promoter 부근의 histone H3-acetylation을 감소시키고, H3 lysine 9 trimethylation (H3K9me3)을 증가시킴으로써 histone modification과 같은 후성조절인자의 조절을 통해 유전자의 발현 억제를 유도한다. VPR은 VP64, P65 그리고 Rta, 세개의 전사촉진체 (transactivator)가 결합된 전사조절 인자로써 활발한 유전자의 발현을 유도한다. 이와 같은 dCas-전사조절인자 활용의 대표적인 예시로는 CRISPRa를 통한 역분화줄기세포 (iPSC) 의 생성이 있다[3, 4]. CRISPRa를 활용하여 역분화줄기세포의 생성에 필요한 2개 (OCT4, SOX2)[3] 또는 4개 (OCT4, SOX2, KLF4, MYC와 LIN28A)[4] 유전자의 발현을 상승 시킴으로써 기존에 바이러스 통한 유전자의 발현 또는 세포 외부에서 전달되는 단백질이나 mRNA에 의한 유전자의 도입 없이도 역분화줄기세포의 생성에 필요한 신호전달을 성공적으로 유도할 수 있었다. 더욱이 세포 내에서 4개 이상의 타겟 유전자 발현을 동시에 유도할 수 있다는 장점을 통해 CRISPR-Cas를 활용한 세포내 신호전달 조절 플랫폼의 이점을 확인할 수 있다.
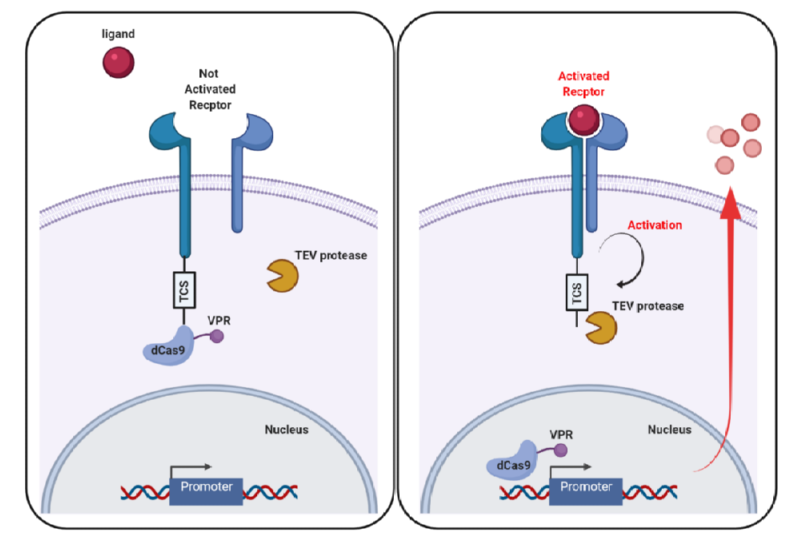
그림 1. CRISPR-Cas와 세포내 신호전달 조절 모식도
두번째 방법은 세포 내에 자연적으로 존재하는 신호전달 기전의 핵심 인자 (key transactivation factor)를 강탈 (hijack)함으로써 자연적인 신호전달의 방향을 변화시켜 세포에 존재하지 않는 신호전달을 생성해주거나 또는 기존과는 다른 유전자의 발현을 유도할 수 있다 (그림 1). 이와 같은 방법으로 제시된 CRISPR-Cas 시스템으로는 GEARs[5], dCas9-SynRs[6] 그리고 MESA[7]가 보고 된 바 있다. Generalized Engineered Activation Regulator (GEARs)는 MS2 박테리오파지 (bacteriophage) 단백질 (MCP)와 결합할 수 있는 MS2 coat protein-binding loop RNA 서열 (MS2)을 sgRNA에 삽입시킴으로써, MCP 단백질과 MS2 RNA-loop 사이의 상호작용을 활용하였다. 신호전달 핵심 인자 (transactivation domain)에 MCP를 결합시키고, 목표하는 유전자의 프로모터 (promoter)에 위치한 dCas9-sgRNA-MS2에 핵심 인자가 결합하여 유전자의 발현을 촉진시킨다. 이를 통해 기존 Ca2+ 이온의 세포내 농도 변화로 인한 nuclear factor of activated T-cells (NFAT)의 핵 내로의 이동 및 인슐린 promoter의 활성화 기전을 원래의 신호전달 기전과는 전혀 다른 IL-12의 발현 기전으로 변경할 수 있었으며, 더욱이 TGFβ 자극에 의해 기존에는 면역억제효과 (immunosuppressive)에 기여하는 신호전달 기전을 강탈하여, IL-12의 발현을 유도 시킴으로써 기존 신호전달 기전과는 반대로 면역작용효과 (immunostimmulatory effect)를 나타낼 수 있었다. 그리고 다른 신호전달 조절 방법인 modular extracellular sensor architecture (MESA)와 dCas9-synRs의 연구에서는 VEGFAR 또는 GPCR과 같은 수용체 (receptor) 단백질과 dCas9-VP64 단백질 사이를 TEV protease cleavage site (TCS)로 연결시키고, VEGFA, lysophosphatidic acid (LPA) 또는 glucose와 같은 리간드 (ligand)의 자극 후 수용체 활성화 및 TEV protease 활성화를 통해 TCS를 절단함으로써 분리된 dCas9- VP64가 핵 내로 이동하여 IL-2, TNFα, insulin과 같은 목표 유전자의 발현을 유도할 수 있음을 확인하였다.
...................(계속)
☞ 자세한 내용은 첨부파일을 이용하시기 바랍니다.
관련정보
지식
- BioINpro [KRIBB 워킹그룹] 기후변화 시대를 대비하는 식물 바이오기술 2025-01-15
- BioINwatch 미국, ‘신흥 바이오기술에 관한 국가안보위원회’ 중간보고서 발표 2024-06-11
- BioINpro [New GPT 시대의 바이오기술] 경제안보 관점에서의 바이오 분야 글로벌 공급망 리스크 분석 및 시사점 2023-10-12
- BioINpro [New GPT 시대의 바이오기술] 과학기술 위크시그널과 바이오 미래유망기술 2023-10-12
- BioINpro [New GPT 시대의 바이오기술] 기술다양성과 바이오기업의 수익성 간 관계 2023-10-12
동향

