기술동향
유도만능줄기세포 기반 뇌 오가노이드를 이용한 질환 모델링 연구
- 등록일2021-03-12
- 조회수8186
- 분류기술동향 > 플랫폼바이오 > 바이오융합기술
-
자료발간일
2021-03-12
-
출처
한국분자세포생물학회
- 원문링크
-
키워드
#줄기세포#오가노이드
유도만능줄기세포 기반 뇌 오가노이드를 이용한 질환 모델링 연구
◈ 서론
뇌-신경 질환의 근본적인 메커니즘을 이해하는 것은 치료제 개발에 있어서 가장 중요한 문제이다. 사람의 뇌는 다양한 기능을 가진 세포와 이들간의 복잡한 network에 의하여 구성되어 있으며, 환경, 유전형 등 여러 요인들이 복잡하게 작용하여 뇌-신경질환이 발생하는 것으로 알려져 있다. 최근 급속도로 발전하고 있는 뇌-신경계의 다양한 연구에도 불구하고 아직까지 많은 뇌-신경 질환치료제의 개발에 어려움을 겪고 있으며, 이는 복잡한 뇌-신경 네트워크의 이해를 위한 다양한 접근법이 필요하다고 볼 수 있다 [1-2].
이러한 시도로 진행된 여러 genome-wide association studies (GWAS)연구는 뇌-신경 질환에 영향을 미치는 다양한 유전적인 변이를 보고 하였다. GWAS 데이터를 기반으로 한 질병 모델링은 유전 변이와 뇌 질환 사이의 상관 관계를 비교적 정밀하게 제시할 수 있었으며, 최근 뇌 질환의 메커니즘을 이해하는 필수적인 기술로 자리 잡았다 [3-4].
이러한 시도와 더불어 최근 뇌-신경 질환 연구의 새로운 질환 모델로 환자 특이적인 유도만능줄기세포 (induced pluripotent stem cells, iPSCs)를 기반으로 하는 2D 뉴런 분화 및 뇌 오가노이드가 주목받고 있다. 일반적으로 질환 동물 모델은 유전적 돌연변이에 의해 유발되는 뇌-신경질환의 모델에 주로 사용되었으나, 설치류의 경우 인간과 다른 뇌-신경 네트위크 구조 및 발달 과정 등에 의하여 정확한 인간의 뇌 질환 표현형의 재현에 어려움이 보고 되고 있다 [5]. 또한 실제 환자의 조직 등의 시료를 사용하는 경우에도 환자 조직의 가용성, 조작의 어려움, 윤리적인 문제들이 제시되고 있다 [6].
이러한 문제점을 해결하기 위하여 환자의 iPSC를 기반으로 하는 2D 뉴런 분화 및 뇌 오가노이드가 그 대안으로 여겨지고 있으며 광범위한 연구가 진행되고 있다. 이번 리뷰에서는 여러 유전성 뇌-신경질환의 모델링을 위하여 사용되고 있는 뇌 오가노이드에 대한 여러 접근법에 대하여 다루도록 한다.
인간 iPSC를 사용한 뉴런 분화에 대한 첫 번째 연구는 2001년 Thomson 그룹에서 진행되었다 [7]. 해당 연구에서는 iPSC로부터 제작된 embryonic body (EB)에 fibroblast growth factor 2 (FGF-2)처리시 neural-tube를 형성하고 있는 neural rosette가 생성되는 것을 관찰하였다.
이후 여러 연구를 통하여 이러한 rosette가 ventricular radial glial cell, intermediate progenitor 및 outer radial glial cell등으로 둘러싸인 epithelial의 구조를 형성할 수 있는 것을 보여 주었으며, 이러한 구조는 인간의 뇌에서 볼 수 있는 ventricular zone (VZ) 및 subventricular zone (SVZ)과 유사함을 확인하였다 [8-9]. 이러한 분화 프로토콜은 점차 세분화되어 세로토닌 뉴런, 도파민 성 뉴런, 운동 뉴런, GABA 성 뉴런, 감각 뉴런 및 microglia 등의 특정 세포로 분화되는 프로토콜들이 확립되었다.
이와 같은 2D 배양 기반의 다양한 분화 기술은 기존의 뇌-신경질환의 메커니즘을 이해하는데 많은 기여를 했지만, 인간 뇌의 복잡성을 파악하는 데는 한계가 있었다.
특히 2D 기반의 배양기술은 뇌의 특정 영역만을 재현할 수 있으며, 이는 다양한 신경세포들의 네트위크를 파악하기에는 어려움이 있었다. 무엇보다 2D 배양을 위해서는 인위적인 세포 외 기질 (extra cell matrix, ECM)을 코팅할 필요가 있었으며, 이에 따른 세포와 ECM간의 상호작용은 실제 조직에서 보여주는 세포-세포 상호작용과는 일부 상이한 특성을 보이고 있다.
이러한 점을 극복하기 위하여 intestinal (내배엽) 및 kidney (중배엽) 오가노이드등의 기존에 개발된 분화 기술을 참조하여 뇌 오가노이드 기술이 개발되었다. 단지 내배엽/중배엽의 오가노이드와는 다르게 뇌 (외배엽)오가노이드는 성장신호인자(growth factor)를 제거로 부터 시작됨이 알려졌다.
일반적으로 뇌 오가노이드 분화는 패턴화 방식에 따라 두가지 접근법을 보인다. 먼저 외부의 조절 인자를 최소화 하는 방법으로 이를 통하여 self-guided 오가노이드 형태를 제작하는 방법이다. 다른 방법으로는 외인성 페터닝 방법으로 BMP, FGF, Nodal 및 Sonic Hedgehog등의 외인성 인자들을 추가하여 원하는 특정 영역의 오가노이드를 제작하는 방식이다 [10]. Self-guided 오가노이드의 경우는 Knoblich 그룹에서 처음 시도되었으며, 3D neuroepithelial spheroids를 matrigel에 embedded시킨후 hypoxia 및 spinning 환경에서 제작하는 방식으로 실제 인간 뇌의 발달 과정을 모방하였다 [11]. 외인성 페터닝 방법은 Sasai그룹 및 Pasca그룹에서 처음 시도되었으며, 다양한 외인성 인자를 사용하여 원하는 뇌 영역을 제작하는 방법이다 [12-13]. 이와 같은 뇌 오가노이드 기술은 최근 환자특이적인 iPSC와 접목되어 down 증후군, Rett 증후군 등의 다양한 뇌-신경계 질환에 적용되고 있다 (그림 1). 또한 최근에는 유전자가위 기술을 이용하여 좀 더 정밀한 질환 모델링이 가능해지고 있으며, 기존에 밝혀지지 않았던 다양한 치료 타겟을 제시할 것으로 기대되고 있다.
◈ 뇌 오가노이드의 한계와 가능성
뇌 오가노이드 기술은 기존의 2D 배양 및 동물모델에서 제공할 수 없었던 혁신적인 접근 방식을 제공하지만 극복해야 할 몇 가지 한계점이 존재한다. 첫째, 실제 인간 뇌의 복잡성과 재현성을 모두 만족하는 뇌 오가노이드를 제작하기 어려운 점이다. 일반적으로 복잡성을 최대한 구현하기 위해서는 다양한 방식의 외부인자를 기반으로 하는 외인성 페터닝 방식이 적용되고 있으나, 이는 필연적으로 배치간의 큰 변동성을 유발한다 [14]. 이와는 반대로 특정 부위만을 모방하는 뇌 오가노이드의 경우 배치간의 높은 재현성을 보여주지만, 뇌의 복잡한 영역들을 적절하게 표현할 수 없었다 [15].
다른 한계는 뇌 오가노이드의 크기가 커짐으로써 발생할 수 있는 불충분한 산소 및 영양소 공급이다. 현재 개발된 대부분의 프로토콜의 경우 일반적인 확산에 의한 산소 및 영양소 공급 방법을 사용하고 있으며, 이는 뇌 오가노이드 중앙 부분에 충분한 공급이 어려워 조직의 괴사를 유발하는 것으로 알려져 있다. 최근에는 이러한 문제를 해결하기 위하여 혈관 등의 다른 세포와의 결합을 유도하는 프로토콜이 개발되고 있다 [16].
◈ 결론
뇌 오가노이드 기술의 개발은 in vitro 시스템에서 인간 뇌의 발달 과정과 뇌-신경 질환에 대한 병인을 관찰할 수 있는 새로운 기회를 제공하였다. 최초의 뇌 오가노이드가 개발된 후 매우 짧은 시간에 광범위한 연구가 진행되고 있으며, 뇌-신경 질환 연구에 핵심 기술로 자리잡고 있다. 아직은 몇 가지 기술적인 한계로 인하여 모든 질환에 적용될 수 없으나, 나노 기술, 생체 재료 등의 다양한 방식과의 접목을 통하여 이러한 문제점을 해결하기 위한 연구들이 진행되고 있다. 멀지 않은 미래에 뇌 오가노이드 기술이 기존의 시스템을 통하여 확인하지 못하였던 뇌-신경 질환의 메커니즘을 규명하고 치료 타겟을 제시할 수 있을 것으로 기대한다.
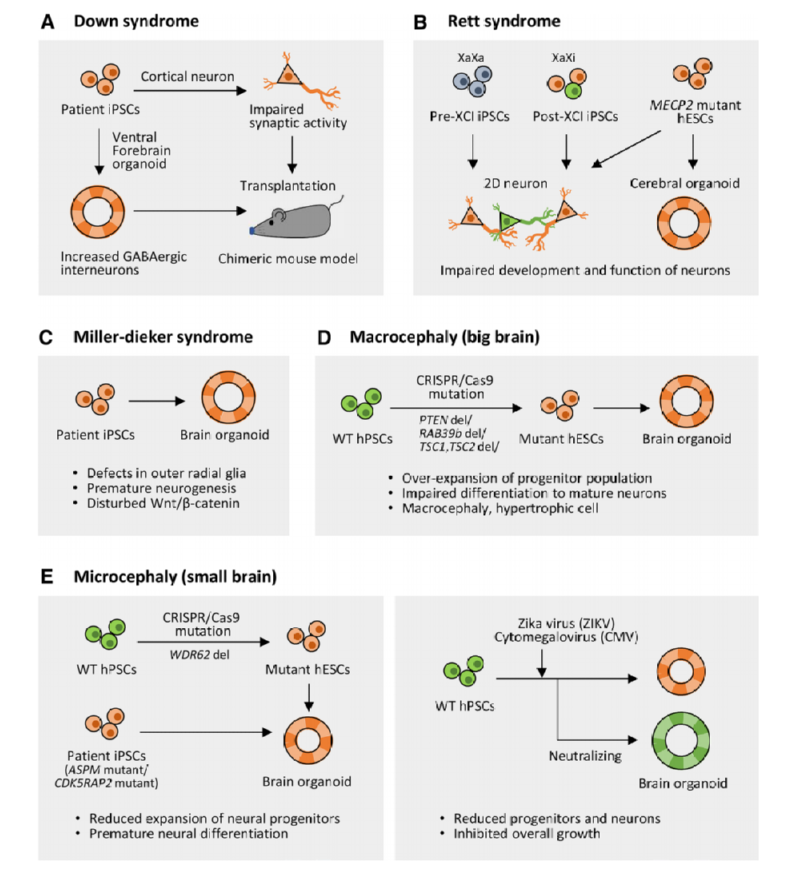
그림1. 다양한 뇌-신경질환의 뇌 오가노이드를 이용한 모델링
◈ 참고문헌
1Geschwind DH, Flint J (2015) Genetics and genomics of psychiatric disease. Science 349:1489-1494. https://doi.org/10.1126/science.aaa8954
2Llinares-Benadero C, Borrell V (2019) Deconstructing cortical folding: genetic, cellular and mechanical determinants. Nature Reviews Neuroscience 20:161-176. https://doi.org/10.1038/s41583-018-0112-2
3Sullivan PF, Daly MJ, O’Donovan M (2012) Genetic architectures of psychiatric disorders: the emerging picture and its implications. Nat Rev Genet 13:537-551. https://doi.org/10.1038/nrg3240
4Grove J, et al. (2019) Identification of common genetic risk variants for autism spectrum disorder. Nat Genet 51:431-444. https://doi.org/10.1038/s41588-019-0344-8
5Rosenthal N, Brown S (2007) The mouse ascending: perspectives for human-disease models. Nat Cell Biol 9:993-999. https://doi.org/10.1038/ncb437
6Quadrato G, Brown J, Arlotta P (2016) The promises and challenges of human brain organoids as models of neuropsychiatric disease. Nature Medicine 22:1220-1228. https://doi.org/10.1038/nm.4214
7Zhang S-C, Wernig M, Duncan ID, Brüstle O, Thomson JA (2001) In vitro differentiation of transplantable neural precursors from human embryonic stem cells. Nat Biotechnol 19:1129-1133. https://doi.org/10.1038/nbt1201-1129
8Shi Y, Kirwan P, Smith J, Robinson HPC, Livesey FJ (2012b) Human cerebral cortex development from pluripotent stem cells to functional excitatory synapses. Nature Neuroscience 15:477-486. https://doi.org/10.1038/nn.3041
9Edri R, Yaffe Y, Ziller MJ, Mutukula N, Volkman R, David E, Jacob-Hirsch J, Malcov H, Levy C, Rechavi G, Gat-Viks I, Meissner A, Elkabetz Y (2015) Analysing human neural stem cell ontogeny by consecutive isolation of Notch active neural progenitors. Nat Commun 6:6500. https://doi.org/10.1038/ncomms7500
10Clevers H (2016) Modeling Development and Disease with Organoids. Cell 165:1586-1597. https://doi.org/10.1016/j.cell.2016.05.082
11Lancaster MA, Knoblich JA (2014) Generation of cerebral organoids from human pluripotent stem cells. Nat Protoc 9:2329-2340. https://doi.org/10.1038/nprot.2014.158
12Kadoshima T, Sakaguchi H, Nakano T, Soen M, Ando S, Eiraku M, Sasai Y (2013) Self-organization of axial polarity, inside-out layer pattern, and species-specific progenitor dynamics in human ES cell-derived neocortex. PNAS 110:20284-20289. https://doi.org/10.1073/pnas.1315710110
13Paşca AM, Sloan SA, Clarke LE, Tian Y, Makinson CD, Huber N, Kim CH, Park J-Y, O’Rourke NA, Nguyen KD, Smith SJ, Huguenard JR, Geschwind DH, Barres BA, Paşca SP (2015) Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nature Methods 12:671–678. https://doi.org/10.1038/nmeth.3415
14Lancaster MA, Renner M, Martin C-A, Wenzel D, Bicknell LS, Hurles ME, Homfray T, Penninger JM, Jackson AP, Knoblich JA (2013) Cerebral organoids model human brain development and microcephaly. Nature 501:373-379. https://doi.org/10.1038/nature12517
15Velasco S, Kedaigle AJ, Simmons SK, Nash A, Rocha M, Quadrato G, Paulsen B, Nguyen L, Adiconis X, Regev A, Levin JZ, Arlotta P (2019) Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature 570:523. https://doi.org/10.1038/s41586-019-1289-x
16van Duinen V, Trietsch SJ, Joore J, Vulto P, Hankemeier T (2015) Microfluidic 3D cell culture: from tools to tissue models. Current Opinion in Biotechnology 35:118-126. https://doi.org/10.1016/j.copbio.2015.05.002
저자약력
2001-2005성균관대학교 약학대학, 학사
2005-2007성균관대학교 약학대학, 석사
2007-2011성균관대학교 약학대학, 박사
2012-2018Stanford University School of Medicine, Post-doc/연구교수
2018-현재성균관대학교 약학대학, 조교수
2020-현재Imnewrun Biosciences Inc, 부사장/팀리더
☞ 자세한 내용은 내용바로가기 을 이용하시기 바랍니다.
관련정보
지식
동향

