기술동향
표적 치료제의 약물 내성의 발현 형태와 그 특징 등에 관한 동향
- 등록일2021-04-15
- 조회수4877
- 분류기술동향
-
자료발간일
2021-04-13
-
출처
생물학연구정보센터(BRIC)
- 원문링크
- 첨부파일
표적 치료제의 약물 내성의 발현 형태와 그 특징 등에 관한 동향
◈요약문
암은 생활 양식의 변화, 생활 환경의 변화 등으로 인하여 지속적으로 사망률이 증가하는 질병이다. 전 세계적으로 높은 사망 원인 중 하나이며 우리나라에서는 전체 사망 원인의 1위를 차지하는 질병이다. 고전적인 암 치료 요법들인 수술요법, 화학항암요법, 방사선요법에서 탈피한 새로운 치료 요법인 표적 치료제는 항암 치료의 새로운 패러다임이다. 뚜렷한 치료 효과를 보이는 표적 치료제도 그 한계점이 존재하며 가장 큰 난관은 약물 내성이 나타난다는 것이다. 본 글에서는 표적 치료제에서 나타나는 약물 내성의 발현 형태와 그 특징에 대한 연구 동향에 대해 논하고자 한다.
◈목차
1. 서론
2. 본론
2.1. 약물 내성의 형태
2.1.1. 고유 내성(intrinsic resistance)과 획득 내성(acquired resistance)
2.2. 고유 내성 기전
2.2.1. 생존을 위한 대안적 경로의 활성화
2.2.2. 후성적 변이에 의한 DTP
2.2.3. 종양 미세 환경의 대사 변화에 의한 DTP
2.3. 획득 내성 기전
2.3.1. 획득 내성의 표적 의존적 변이
2.3.2. 획득 내성의 표적 독립적 변이
3. 결론
4. 참고문헌
◈본문
1. 서론
인간은 각양각색의 삶을 살고 있지만, 죽음의 원인은 몇 가지로 축소되어 나타난다. 2019년 사망 통계에 따르면 총 사망자 수는 29만 5,100명이었으며, 인구 10만 명당 사망자 수를 산술적으로 계산하는 조사망률은 574.8명이었다. 그 원인을 보면 암, 심장 질환, 폐렴, 뇌혈관 질환, 자살, 당뇨, 알츠하이머병, 간 질환, 만성하기도 질환, 고혈압성 질환 순으로 많았고, 전체 사망자의 27.5%가 암으로 사망하여 암 사망률은 인구 10만 명당 158.2명으로 통계 되어 지속적 증가 추세를 보였다 [1]. 암으로 인한 사망은 국내뿐만 아니라 세계적으로도 높은 비율을 차지하고 있어, 암 연구에 대한 수요는 지속적으로 증가하고 있으며, 치료제 개발을 위한 제약 회사들의 관심도 높아지고 있다.
현재까지의 항암치료법으로는 수술요법, 화학항암요법, 방사선요법 등이 사용되어 왔으나, 이들은 모두 임상적인 한계점이 존재한다. 수술요법의 경우는 전이성 암을 가진 환자에게는 적용이 어려우며, 방사선요법은 암 조직뿐만 아니라, 주변 조직에도 손상을 주어 조직 회복에 어려움이 있고, 화학항암요법의 경우는 정상세포에도 영향을 주는 시스템적 독성이 있어 여러 가지 부작용을 동반하여 환자에게 많은 고통을 주게 되어 삶의 질을 떨어뜨리는 한계점을 가지고 있다 [2, 3].
2002년 웨인스타인 박사에 의해 “Oncogene addiction”이라는 현상이 보고되었다. 이는 암세포는 생존을 위해서 특정한 단백질 변이에 매우 지나친 의존성을 보인다는 결과였다. 이런 암세포의 의존성은 해당 단백질의 저해제에 의해 매우 취약함을 보였고, 이런 치료를 “표적 치료”라 불렀다. 이후 표적 치료제라는 암 치료의 새로운 패러다임이 등장했다. 유전체 염기서열 분석 기법의 발전이 밑바탕이 되어 다양한 암 종에서의 진단, 분류와 치료에 있어 기존의 방식을 탈피한 새로운 방식으로 전환되었고, 이런 결과로 다양한 표적들이 발견되어 표적 치료제의 시대를 열었다.
표적 치료제의 표적은 기본적으로 암세포의 생존, 생장 그리고 전이 등에 주요 역할을 하는 것으로 알려진 단백질 또는 특정 신호 전달계의 주요 역할 단백질이다. 표적 치료제는 형태적인 면에서 저분자 인산화효소 저해제(small molecule kinase inhibitor), 단일 클론 항체(monoclonal antibody), 면역치료 암 백신(Immune-therapeutic cancer vaccine)과 유전자 치료(Gene therapy)로 분류할 수 있다. 현재 환자에게 쓰이는 표적 치료제의 작용 부위로 분류하면, Receptor tyrosine kinase (RTK) inhibitors, Non-receptor tyrosine kinase (NRTK) inhibitors, Serine/threonine kinase and lipid kinase inhibitors, Hedgehog inhibitors, Proteasome inhibitors, apoptosis inducers, Epigenetic modulators 그리고 Metabolic modulators 등이 존재한다. 최근 미국 식품의약청에 50여 가지가 넘는 저분자 인산화효소 저해제와 10여 가지의 단일클론항체가 등록되어 사용되고 있으며, 많은 제약 회사들이 표적 치료제 개발을 지속하고 있다 [4, 5]. 암이라는 질병에 대한 연구 및 치료제의 수요로 인해 항암 치료의 새로운 패러다임인 표적 치료제가 개발되었으나, 약물 내성이라는 큰 장애물이 존재하고 있다. 저자는 이 리포트에서 항암 치료의 큰 장애물인 약물 내성의 발현 형태와 특징을 다루고자 한다.
2. 본론
2.1. 약물 내성의 형태
2.1.1. 고유 내성(intrinsic resistance)과 획득 내성(acquired resistance)
비소세포성 폐암에서 상피세포 성장인자 수용체(Epithermal growth factor receptor (EGFR))의 활성 돌연변이인 Exon 21 L858R과 Exon 19 deletion의 발견은 유전체 분석기술 기반의 정밀 표적 치료제의 시대를 열었다. 이 EGFR 활성 돌연변이를 표적 하는 표적 치료제는 1세대 erlotinib과 gefitinib, 2세대 afatinib, 3세대 osimertinib 등으로 발전해 왔으며, 화학항암요법과 비교하였을 때 개선된 효과와 무진행 생존율(progression-free survival (PFS))을 보였다 [6]. 더구나 전이성 암에서도 최초로 발생된 암에서 나타내는 유전형과 유사한 유전형을 나타내어 같은 표적 치료제에도 뚜렷한 반응을 보임으로써, 표적 치료제의 항암치료의 새로운 패러다임임을 나타내었다. 하지만, 표적 치료제 역시 한계점을 가지고 있음이 곧 발표되었다. 표적치료제는 해당 표적 단백질의 발현 정도나 돌연변이 유무에 따라 사용을 할 수 있는 가부가 결정된다는 점과 이들의 사용은 초기의 뚜렷한 효과를 보임에도 불구하고 시간이 지나게 되면 약물 내성을 보인다는 공통된 한계점을 보여 약물 내성이 나타난 환자는 결국 치료 실패와 죽음이라는 결과를 나타내었다.
약물 내성 연구의 성과로 암은 약물 처치의 초기에 나타나는 고유 내성(intrinsic resistance)과 후기에 나타나는 획득 내성(acquired resistance)으로 나뉠 수 있다. 이는 임상에서 나타나는 암의 약물 반응에 따른 분류 및 평가 기준에 의해 나뉜 것으로 고유 내성은 약물 처치에 따라 암의 크기가 감소하는 반응을 보여야 할 암이 반응을 보이지 않음을 나타낸다. 이 현상은 호스트의 암 내에서 암 이질성(heterogeneity) 또는 서로 다른 부위에서의 암 이질성으로 인하여 나타나는 것으로 생각되어진다. 표적 치료제의 특성상 하나의 표적에만 영향을 주게 되므로 암 내에 표적이 아닌 유전체의 이상이 고유 내성을 일으킬 수 있다. 반면에 획득 내성을 이해하기 위한 연구들은 임상적으로 암의 상태가 진행성 질환(progressive disease) 상태인 암이 새로운 전이 병변을 나타내거나, 기존에 반응을 보였던 변병에서 다시 증식이 일어나는 약물 처치의 후기 단계의 조직에서 일어나는 분자적 내성 기전에 초점을 맞추고 있다 [7]. 여러 내성 기전 연구를 통하여 암은 다양한 분자적 내성 기전을 통해 표적 치료제에 적응을 할 수 있음을 알게 되었다.
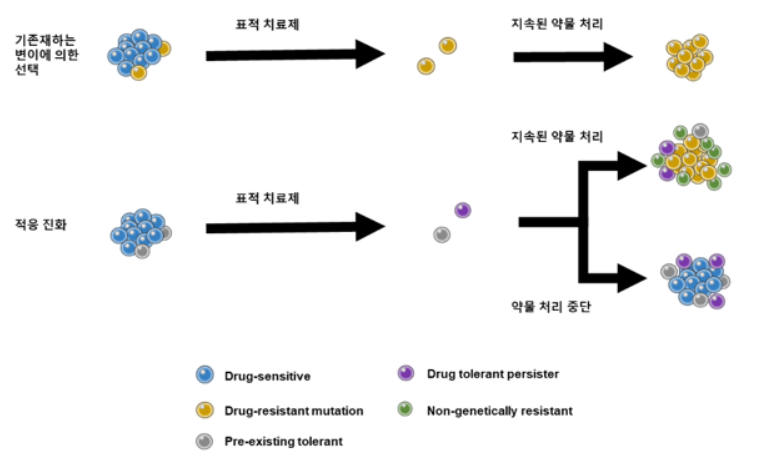
2.2. 고유 내성 기전
임상에서 발생하는 최소 잔류 질환(minimal residual disease (MRD))에 대한 연구와 치료 전략의 목적은 암의 지속성과 진행성을 제거하기 위함이다. MRD는 세포가 살아갈 수 없는 약물 환경에서 생존하기 위해 무활동 상태를 유지하거나, 약물에 의해 세포 사멸을 회피할 수 있는 생존을 위한 신호전달계를 활성화 시키는 등의 지속적인 생존 능력을 가지고 있다. 2010년 샤마(Sharma) 박사는 인체 내에 존재하는 암세포의 0.3~5%는 초기 약물 처리에 의해 살아 남고 이는 암세포의 가역적 적응에 의해 일어나며, 이를 “drug-tolerant persister (DTP)”라고 명명하였다 [8]. 이 DTP의 경우 암의 이질성으로 인해 존재 할 수 있다고 알려져 있으며, 약물에 의해 발생하는 세포 사멸을 이끄는 신호에 대해 휴면 상태를 유지하며 이를 극복한다. 이런 휴면 상태를 암세포가 약물 내성을 가질 수 있는 영구적, 유전적 변이를 획득하기 전까지 유지를 한다.
고유 내성이라는 개념이 확립된 지가 오래되지 않았고, 연구 결과들의 축적이 미비한 상태이나 여러 연구자들에 의해 몇 가지 고유 내성의 기전들이 알려졌다.
2.2.1. 생존을 위한 대안적 경로의 활성화
유방암에서의 연구 결과에서는 HER2 표적 치료제인 lapatinib 처리에 의해 발생하는 DTP의 발생이 세포 내 존재하는 항산화 기전의 한 축인 Glutathione peroxidase 4 (GPX4)의 활성 증가가 원인이 될 수 있음을 밝혔으며, 이는 GPX4를 저해함으로써 DTP가 사라지는 것으로 확인되어 GPX4가 DTP 발생에 주요 역할을 할 수 있음을 알렸다 [9]. 비소세포성 폐암에서 EGFR 저해제에 의해 발생 할 수 있는 DTP는 Aurora kinase A (AURKA)의 활성 증가가 원인이 될 수 있음을 발표했다 [10]. 또 다른 연구자는 피부암에서 BRAF/MEK 저해제의 처리가 “retinoid X receptor-γ (RXRG)”라는 전사조절인자를 활성화 시키고 그 하위 유전자들의 전사를 유도하여 암세포가 생존할 수 있음을 밝혔다 [11]. 이들의 결과들은 암세포의 일부에서 발생하는 생존 단백질의 활성화가 고유 내성을 유발함을 말한다.
2.2.2. 후성적 변이에 의한 DTP
약물 처리 초기에 나타나는 DTP는 약물 처리를 중단하고 어느 정도의 기간이 흐른 뒤에 같은 약물을 처리할 경우 첨과 같은 약물 반응도를 나타내어 가역성을 가지고 있다고 말한다. 이런 DTP의 가역성에는 후성적 기전이 원인이라고 밝혔내었다. 인슐린유사성장인자-1 수용체(IGF-1R)의 신호전달계의 활성은 EGFR 저해제의 저항성 발달을 위해 필요한 것으로 보고되었다 [8]. 증가된 IGF-1R의 인산화가 DTP 세포 내에서 확인되었으며, IGF-1R의 저해제와 EGFR 저해제의 병용요법에 의해 DTP의 형성이 저해됨을 확인했다. 또, 이런 IGF-1R을 매개로 나타나는 DTP는 리신 특이적 디메틸화 효소(Lysine Demethylase 5A, KDM5A)의 활성을 필요로 하고 이는 히스톤 디메틸화 효소(histone deacetylase, HDAC)와 연계가 되어 있어, HDAC 저해제의 처리에 의해서 DTP의 형성이 저해됨을 밝혔다 [8]. 또 다른 연구진에서도 비소세포성 폐암에서 나타나는 DTP의 히스톤(Histone) 3번의 리신(Lysine) 9과 27 (H3K9 and H3K27)의 메틸화에 의한 크로마틴의 응집을 확인하고 이를 저해할 수 있는 histone deacetylase (HDAC) 저해제에 처리에 의해 DTP가 사라짐을 확인하였다 [12].
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0003760.pdf
pdf_0003760.pdf