기술동향
γc 패밀리 사이토카인: 치료적 분지를 위한 기초 생물학
- 등록일2021-05-12
- 조회수4675
- 분류기술동향 > 플랫폼바이오 > 바이오융합기술
-
자료발간일
2021-05-11
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#사이토카인#수용체 #면역반응#유전자치료
- 첨부파일
γc 패밀리 사이토카인: 치료적 분지를 위한 기초 생물학
◈ 요약문
γc 패밀리 사이토카인은 해당 사이토카인의 수용체를 구성하는데 있어 γc 단백질을 공통적으로 사용하는 사이토카인들을 말하며 IL-2, IL-4, IL-7, IL-9, IL-15, IL-21 등이 이에 속한다. γc 패밀리 사이토카인은 선천 및 후천 면역 반응을 조절하는데 주요한 역할을 하며, 다양한 질병 유발과 관련이 있어 해당 질병의 치료법 개발에 중요한 타깃으로 연구되고 있다. 본 리뷰에서는 γc 패밀리 사이토카인의 발견에 대한 역사 및 현재까지 밝혀진 기초적인 지식과 γc 패밀리 사이토카인과 그 수용체를 이용한 종양, 자가 면역질환, 알러지 등의 질병들의 치료법 개발에 어떠한 발전이 이루어졌는지 정리하였다.
키워드: γc 패밀리 사이토카인, 수용체, 면역반응, 유전자 치료, γc family cytokine, Receptor, Immune response, Gene therapy
본 자료는 The γc Family of Cytokines: Basic Biology to Therapeutic Ramifications. immunity 50(4), 832-850 (2019). 의 논문을 한글로 번역, 요약한 자료입니다.
◈ 목차
1. 들어가는 말
2. γc 패밀리 사이토카인의 발견과 개요
3. IL-2Rγ (γc)와 X-연관 중증 복합 면역 결핍증과의 관련성과 IL-4, IL-7, IL-9, IL-15, IL-21의 수용체에서 γc 발견
4. JAK1과 JAK3는 각각 IL-2Rβ와 γc에 결합하고 JAK3 결핍과 IL-7R 결핍이 SCID를 유발함
5. XSCID 치료를 위한 유전자 치료법
6. γc 패밀리 사이토카인 수용체의 구조와 기타 후속 신호 기전
7. γc 패밀리 사이토카인에 대한 새로운 관점
8. γc 패밀리 사이토카인의 발현 조절
9. γc 패밀리 사이토카인 수용체의 발현 조절
10. 진화적인 고려사항
11. γc 패밀리 사이토카인과 정밀한 사이토카인 신호의 조절
12. γc 패밀리 사이토카인과 질병 치료
13. JAK 억제제
14. 결론
◈ 본문
1. 들어가는 말
IL-2, IL-4, IL-7, IL-9, IL-15, IL-21는 공통 사이토카인 수용체 γ 사슬 패밀리(Common cytokine receptor γc family)로 면역반응에서 다양한 역할을 담당하고 있다. “γc” 라고 불리는 단백질이 이들 사이토카인의 수용체에 공통적으로 존재하기 때문에 그룹 이름이 붙여졌는데 세포 기능 및 다른 사이토카인의 작용을 조절하며 다양한 질병에서 임상적으로 기능할 수 있는 가능성을 가지고 있다. 1976년 IL-2가 처음 발견된 이래도 이 패밀리의 사이토카인에 대한 많은 연구가 이루어져 왔다. 본 리뷰에서는 지난 40년 동안 이루어진 발전을 되짚어 보고 앞으로의 도전 과제에 대해 논의하며 미래를 예측해보는 보려고 한다.
2. γc 패밀리 사이토카인의 발견과 개요
사이토카인은 세포에서 분비되어 타깃 세포에 존재하는 수용체를 통해 작용하는 물질들로 면역 반응에서 주요한 역할을 하고 있다. 이 리뷰는 type I four alpha-helical bundle 사이토카인들 중 공통 사이토카인 수용체 γ 사슬 패밀리 사이토카인으로 알려져 있는 IL-2, 4, 7, 9, 15, 21에 대해 주제로 하고 있다. 그림 1에서는 γc 패밀리 사이토카인(IL-2, 4, 7, 9, 15, 21)과 관련된 주요한 발견을 연대기로 보여주고 있다.
IL-2는 1976년 이 패밀리에서 가장 처음 발견된 사이토카인으로 T 세포의 성장 인자로 발견되었다. 이후 IL-2가 광범위한 역할을 한다는 것이 발견되었는데, NK 세포와 cytotoxic T 세포의 세포 융해 작용을 촉진하고 세포의 상태에 따라서 생존을 조절하며, B 세포의 면역 글로불린 생산을 증가시키고 TH1, TH2, TH9 세포의 분화는 촉진하고 TH17 세포의 분화는 억제하는 효과를 가지고 있다는 것이 여러 연구를 통해 확인되었다.
특히, IL-2는 Treg 세포의 발생과 증식을 유발한다. IL-2의 수용체를 구성 요소 중 하나인 IL-2Rα는 세포질내 부분이 단지 13개의 아미노산으로만 구성되어 있어 이것은 세포질 내로 신호 전달을 담당하는 부분이 수용체 내에 따로 존재해야 한다는 것을 의미한다. IL-2Rα는 IL-2와 낮은 결합력(Kd ~10^-8 M)을 가지고 있었으나, 다른 세포들에서 중간 결합력과 높은 결합력을 가진 수용체가 발견됨에 따라 이러한 발견을 바탕으로 IL-2Rβ와 IL-2Rγ가 발견되었다. IL-2Rα는 낮은 결합력의 수용체를 구성하고, IL-2Rβ와 IL-2Rγ는 중간 결합력의 수용체를 형성하며, 세 가지 단백질이 모두 합쳐질 경우 높은 결합력의 수용체를 형성하게 된다는 것이 알려지게 되었다.
IL-4는 B 세포 분화와 IgG1과 IgE를 증가시키는 면역 글로불린의 class switch를 유도하며, TH9 세포의 분화를 촉진하고, 연충 감염 시 몸을 보호하는 역할을 하고 있다. IL-4는 IL-13과 기능적으로 많이 유사한데, 최근 Treg의 발생과 항상성 조절 및 회복 기전에도 역할을 하는 것으로 알려져 있다. IL-7은 흉선의 수질에서 T 세포의 발생에 필수적인 요소로 발견되었으며, IL-15과 함께 CD8+ 기억 T 세포와 CD4+ 기억 세포를 조절한다. 마우스에서는 pre-B 세포의 성장 인자로 중요한 역할을 하지만, 사람에서는 IL-7이 없더라도, 정상적인 B 세포의 발생에 문제가 없다.
이외에도 Treg 세포의 발생에서도 역할을 할 수 있다고 생각되고 있다. IL-9은 후기 T 세포의 성장 인자로 발견되었으며, 비만 세포의 성장 인자로써도 작용한다. TH9 세포의 분화는 IL-2는 물론 IL-1, IL-4, IL-25, IL-33, type I 인터페론에 의해 촉진 되고, IL-23, IL-27에 의해서 억제된다. 상황에 따라서 IL-6, IL-10, IL-21은 TH9 세포의 분화를 촉진시킬 수도 억제 시킬 수 도 있다.
IL-9는 항암 효과와 goblet 세포의 점액 생산 촉진, 알러지성 염증을 유발, 염증성 창자병인 inflammatory bowel dis-ease의 발생을 촉진하는 것으로 알려져 있으며 IL-9+ T 세포의 경우 질병의 중등도와 연관되어 있다. IL-15은 NK 세포의 발생을 유도하는 주요한 인자로 기억 CD8+ T 세포의 항상성을 조절하는 역할을 한다. IL-2처럼 IL-15은 NK 세포와 CD8+ T의 세포 융해 작용을 증가시키지만, IL-2와는 달리 AICD (activation-induced cell death)을 유발하지는 않는다.
IL-15이 Treg의 발생 과정에 역할을 한다는 보고가 있으나, IL-2가 Treg의 발생, 생존, 유지에 비교적 더 중요한 인자로 알려져 있다. IL-21은 특별한 기능을 가진 요소로 발견되기 보다는 IL-2Rβ와 가장 유사한 orphan type I 사이토카인 수용체의 리간드로써 발견이 되었다. T 세포가 항원에 의해 자극을 받으면 IL-21이 생산이 되는데 TH17, NKT, TFH (Follicular helper T cell, 여포 보조 T 세포) 세포가 가장 중요한 생산자로 알려져 있고 T, B 세포를 포함하여 B10 세포, NK 세포, 수지상세포, 대식세포, 비만세포, 상피세포에 작용한다.
IL-21가 IL-7 또는 IL-15과 함께 작용할 경우, CD8+ T 세포의 증식을 유도하고 CD8+ T 세포의 기억 형성과 TFH 세포의 분화, TH17 세포의 분화를 유도하는 반면, TH9 세포와 Treg 세포의 분화는 억제하는 것으로 알려져 있어 IL-2와 대조적인 역할을 많이 한다. IL-4 처럼 IL-21은 IgG1의 생산을 촉진하지만, IL-4와는 다르게 IgE의 생산은 억제하는 기능을 가지고 있다.
IL-21 신호기전을 담당하는 STAT3의 기능에 장애가 있는 Job 신드롬(AD-HIES, autosomal dominant hyper-IgE syndrome)에서 IgE가 증가된다. IL-21은 B 세포의 형질세포 발생을 유도하며 불완전하게 활성화된 B 세포의 자멸을 촉진하기 때문에 자가 면역 질환을 억제하는 역할을 하기도 한다. 사람의 GWAS (Genome-wide association studies)를 보면 동물 모델에서도 IL-21은 다양한 자기 면역질환의 유발과 관련이 있으며 Type I 당뇨병과 전신홍반루푸스, 실험적인 알러지성 포도막염 등을 보면 IL-21이 항체 또는 T 세포에 의해 매개되는 자가 면역 질병에 관여한다는 것을 말해주고 있다.
3. IL-2Rγ (γc)와 X-연관 중증 복합 면역 결핍증과의 관련성과 IL-4, IL-7, IL-9, IL-15, IL-21의 수용체에서 γc 발견
XSCID는 T 세포와 NK 세포가 심각하게 감소하고, B 세포는 수는 정상이나 기능적으로는 이상이 있는 면역 결핍 질병이다. IL2RG의 이상이 XSCID에서 확인된 것은 사이토카인 신호기전 이상으로 인한 질병 발생을 이해하는 과학적인 발전은 물론 분자적 진단법과 질병에 대한 성공적인 유전자 치료법에 대한 길을 터주었다. 동시에 이 발견은 새로운 난제를 제기하였는데, IL-2, IL2ra, IL2rb가 결손된 마우스나 IL-2 생산에 이상이 있는 사람들의 경우에도 정상적인 T 세포 발생이 이루어지기 때문에, IL-2 신호전달 기전의 불활성화가 XSCID의 원인을 모두 설명해주지는 못한다는 것이었다. γc 가 IL-2 수용체 외에 XSCID 유발에 관련되어 있는 다른 사이토카인 수용체들에도 공통적으로 사용될 수 있다는 것이 제안되었고 이후 얼마 되지 않아 IL-7, IL-4가 IL-2Rγ를 공유하고 있다는 것이 확인되어 공통 사이토카인 수용체 γ 사슬(γc)로 다시 명명이 되었다. 이후 IL-9, IL-15, IL-21의 수용체에서도 그 존재가 확인되었다.
4. JAK1과 JAK3는 각각 IL-2Rβ와 γc에 결합하고 JAK3 결핍과 IL-7R 결핍이 SCID를 유발함
이후 γc 패밀리 사이토카인의 신호가 세포막에서 세포질 내로 어떤 기전을 통해 전달이 되고 유전자를 조절하는지에 대한 과정이 연구되었다. 인터페론 연구를 통한 JAK-STAT 패러다임이 만들어져 γc 사이토카인 수용체의 신호기전 연구가 발전될 수 있었다.
JAK1은 IL-2Rβ와 결합하고 JAK3는 γc와 결합한다. JAK3는 γc의 하부 신호 단계이기 때문에 JAK3 유전자가 돌연변이가 되면 XSCID와 유사한 질병이 발생하는데, 이러한 JAK3의 돌연변이 연구를 통해 JAK가 사이토카인 신호기전에서 주요한 역할을 한다는 것을 처음으로 확인할 수 있었다. IL7 또는 IL7R 돌연변이가 T 세포에 선택적으로 SCID를 이론적으로 유발시킬 수 있을 것으로 생각되지만 IL7R이 결핍된 사람의 SCID가 발견되었지만, IL7 결핍 SCID 환자는 아직 확인된 바가 없다.
5. XSCID 치료를 위한 유전자 치료법
IL2RG를 타깃으로 하여 XSCID에 대한 유전자 치료가 시도되었다. Il2rg 결핍 마우스 이용한 실험을 통해 가능성을 검증하였으며 이후 최초의 성공적인 XSCID에 대한 유전자 치료가 시행되었다. IL2Rγ cDNA를 발현하는 레트로 바이러스를 주입하여 면역 반응을 증가시키는 것에서는 성공하였으나, 급성 림프구성 백혈병이 발생하는 경우가 있어 다른 대체 방법을 개발해야 한다는 필요성을 제시해 주었다. JAK3 결핍 또는 IL7R 결핍성 SCID에 대한 유전자 치료법이 발전되어야 할 분야로 생각되며 최근의 유전자 편집 기술과 같은 다른 기법들도 연구되어야 할 주제이다.
6. γc 패밀리 사이토카인 수용체의 구조와 기타 후속 신호 기전
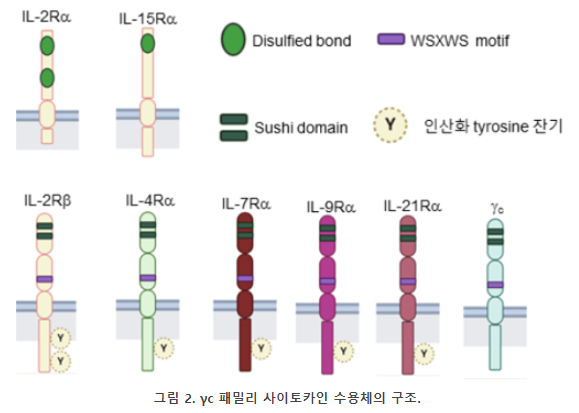
IL-2Rβ, IL-4Rα, IL-7Rα, IL-9Rα, IL-21R, γc는 모두 type I 사이토카인 수용체로 이황화 결합(Disulfide bond)을 통해 전반적인 구조가 형성되며 보존된 WSXWS motif를 가지고 있다. IL-2Rα와 IL-15Rα는 type I 사이토카인 수용체가 아닌 sushi domain을 가지고 있는 단백질이다 (그림 2). IL-2는 세 종류의 수용체를 가지고 있으며 각각 약한, 중간, 강한 결합력으로 IL-2와 결합한다. IL-4의 수용체에는 두 가지 타입이 있는데 T 세포에 있는 type I IL-4R은 IL-4Rα와 γc로 구성되어 있고 B 세포와 비림프구성 세포에 있는 type II IL-4 수용체는 IL-4Ra와 IL-13Ra1으로 구성되어 있다. 이 중 Type II 수용체는 IL-13에 반응하여 신호를 전달한다. IL-7, IL-9, IL-15, IL-21 수용체는 각각 IL-7Rα, IL-9Rα, IL-15Rα, IL-21R이 γc와 결합하여 만들어진다. IL-15은 trans의 형태로 신호를 전달하는데 IL-15은 IL-15Rα에 결합하여 있는 세포에서 IL-2Rβ와 γc를 발현하는 다른 세포로 신호가 전달된다. IL-2도 trans 형태로 신호가 전달 될 수 있으나 주로 cis 형태로 신호가 전달된다.
IL-2가 처음 IL-2Rα와 빠른 on- and off- 결합 속도를 통해 상호작용을 하면 IL-2가 IL-2Rα와 결합하게 되어 IL-2의 구조 변화가 일어나 IL-2Rβ와 결합하게 되고 마지막으로 γc와 결합하게 된다. 낮은 결합력을 가지고 수용체끼리 세포막 근처에서 결합하고는 있지만, 리간드에 안정적이고 강하게 결합한다. JAK1은 IL-2Rβ, IL-4Rα, IL-7Rα, IL-9Rα, IL-21R와 직접적으로 결합하여 있고 JAK3는 γc와 결합한다. IL-2, IL-7, IL-9, IL-15은 주로 STAT5A와 STAT5B를 활성화하고 IL-4는 주로 STAT6를 IL-21은 주로 STAT3를 활성화 시킨다 (그림 3, https://marlin-prod.literatumonline.com/cms/attachment/68f1eb1f-a782-4a84-bb2f-777bc7b14c82/gr3.jpg). 이러한 STAT 단백질의 차이가 사이토카인의 특이성을 부분적으로 설명해 준다. IL-2 신호 기전은 90% 정도가 JAK 의존적이지만 MAP kinase와 PI3 kinase도 신호 기전에 작용을 하며 IL-7은 PI3-kinase를 IL-4는 adaptor molecule IRS2의 인산화를 통해 하위 신호 기전으로 연결된다.
γc 패밀리 사이토카인들 끼리도 잠재적인 경쟁자로 작용할 수 있는데 제한적인 γc를 수용체의 요소로 활용해야 하기 때문에 서로 반대되는 기능을 하거나, 서로를 억제하는 경우가 있을 수 있다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보
동향
- 제도동향 미국 FDA, '산업계를 위한 키메릭 항원 수용체 T 세포치료제 개발 시 고려사항' 가이던스 2024-11-05
- 기술동향 GLP-1 수용체 작용제: 당뇨병 치료에서 체중 감량 치료제로의 진화 2024-10-08
- 기술동향 고형암 표적 CAR-T 치료제 개발 동향 2021-11-09
- 기술동향 인체전립선암세포주 이용 안드로겐 수용체 agonist/antagonist 판별시험법(OECD project 4.99) 국제검증연구보고서 2019-11-27
- 기술동향 고아 핵수용체 RORα의 조건부 결손 마우스를 이용한 연구 동향 2018-03-06


 pdf_0003777.pdf
pdf_0003777.pdf