기술동향
포스트 팬데믹 美 국가 기술 개발 로드맵 - (2) 미국 의료제조업 및 유통망 개선
- 등록일2021-05-21
- 조회수4871
- 분류기술동향 > 종합 > 종합
-
자료발간일
2021-05-13
-
출처
한국산업기술진흥원
- 원문링크
-
키워드
#포스트 팬데믹#미국기술#미국 기술로드맵
- 첨부파일
포스트 팬데믹 美 국가 기술 개발 로드맵 - (2) 미국 의료제조업 및 유통망 개선
Ⅰ. 의료 제조 분야 개선
1. 최적화된 의료 제조 생태계
□ 팬데믹 기간 동안 백신, 의약품, 개인보호장비 및 의료기기의 급격한 수요 증가로 인해 미국 의료 제조업의 능력과 생산량 확장이 크게 요구되었음
□ 이번 팬데믹으로 배운 모범 사례와 경험을 적용하여 인프라와 지원 기술 개선을 통해 의료 용품에 대한 급증하는 수요를 충족하기 위해 운영 및 생산을 신속하게 확장 할 수 있어야 함
ㅇ 빠른 시간 내에 효과적인 생산 프로세스 구축
ㅇ 수요 변화에 따른 신속한 생산 확장 또는 축소
ㅇ 제품 안전, 품질 및 신뢰성 보장
<최적화된 의료제조 생태계 개요>
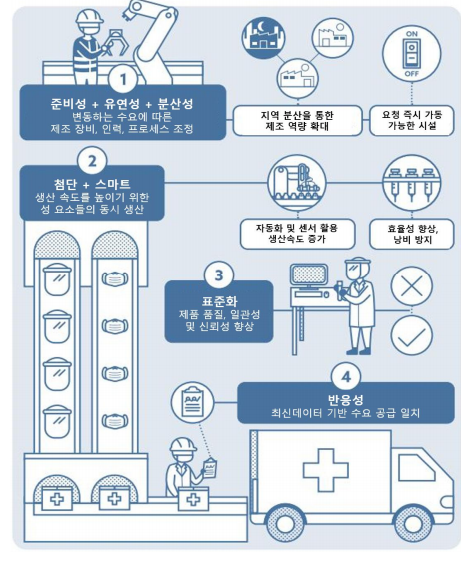
□ 최적화된 제조 생태계의 주요 특징
ㅇ 첨단화: 제조업체는 새로운 기술과 혁신적이고 간소화된 프로세스를 적용하여 새로운 치료제 및 제품의 생산과 가용성을 가속화
ㅇ 스마트: 자동화 및 디지털 인라인 모니터링과 같은 기능을 통해 실시간으로 문제를 감지 및 수정하여 효율성을 향상
ㅇ 유연성: 시설의 용도를 신속하게 변경하여 필요한 새로운 제품 생산 가능
ㅇ 반응성: 데이터에 의한 생산량 조정을 통해 수요와 공급의 일치
ㅇ 준비성: 위기 시 긴급 인력과 같은 대책은 제조업체가 갑작스러운 수요 급증에 대비하는 데 도움
ㅇ 표준화: 제조 자동화 플랫폼의 표준화된 설계, 제어 소프트웨어 및 프로세스를 사용하여 속도를 높이고 실시간 협업 촉진
ㅇ 분산성: 분산화 된 각 생산 시설에서 지역 요구 사항에 따른 대응
2. 현재의 과제
□ 백신 제조 능력 개발 및 확장에 대한 시장 불확실성은 기존 업체들의 백신 개발을 주저하게 하며, 또한 새로운 업체의 시장 진입을 어렵게 함
ㅇ 백신 제조는 종종 수익성이 없기 때문에, 제약 회사가 새로운 전염병 백신 개발에 대한 투자하는 것은 매우 도전적임
ㅇ 현재 미국 내 백신 제조 기업은 1970년대 20여 곳에서 현재 5개 업체에 불과함
ㅇ 많은 수요를 맞추기 위해 제조업체는 위험성을 갖고 백신을 생산해야하며, 해당 개발 백신이 실패 할 수 있으므로 제조업체는 수익성이 없는 초기 용량과 제품 개발에 상당한 노력을 기울이게 됨
ㅇ 과거의 전염병(예: SARS, Zika)은 백신 개발 완료 전 종료되어 제조업체의 재정적 손실뿐만 아니라 개발 리소스를 오프라인으로 전환하는 기회비용을 발생시킴
- 다른 백신 개발 프로그램에 차질을 빚을 수 있으며, 회사 경쟁 우위에 장기적 인 악영향을 미칠 수 있음
ㅇ 대부분의 면역생물학 및 재생의학은 주로 만성 질환 연구에 투자가 이루어지므로, 이러한 투자가 전염병 관련 연구로 진행될지 불분명
□ 팬데믹 기간 동안 필요한 제품을 만들기 위해 기존 생산라인의 전환 및 확장 비용의 대비 수익을 얻지 못할 경우, 업체들의 팬데믹 사태 해결을 위한 협력 노력이낮아질 수 있음
ㅇ 예를 들어, 팬데믹이 끝날 때 사라질 가능성이 높은 시장 요구에 의한 제조 능력 개조 및 투자는 사업적 가치가 낮음
ㅇ 제조업체는 다른 중요 백신(예: 홍역)의 생산을 저해하지 않으면서 새로운 전염병 백신 개발에 집중하기 위해 할당된 인력 및 지원 자원을 조정해야함
ㅇ 非 의료제조업체가 개인보호장비(PPE) 제조를 위해 생산 라인을 변경하는 것은 전체 사업 계획 큰 차질을 빚음
□ 현재 제조시스템 및 프로세스의 한계는 중요한 제품 생산 확장을 지연시킴
ㅇ 생산 확장을 위한 기술이전(즉, 개발에서 생산으로 기술 이동)은 일반적으로 18-30개월 정도가 소요됨
- 많은 소규모 개발자들의 경우 기술 이전에 경험이 없기 때문에 추가적 위험이 발생할 수 있으며 생산 일정이 더 지연됨
ㅇ 테스트 키트 제조업체는 동일한 규모의 판독기와 같은 보조 장비의 생산 확장 또한 고려해야 함
ㅇ 일반적으로 백신 개발의 최종 단계는 소규모 전문 회사에서 임상시험 후, 대량 생산을 위해 대기업이 인수함
- 백신 중 일부는 새로운 백신 플랫폼을 기반으로 하므로 확장을 위한 새로운 프로세스가 요구됨
□ 제조업체는 첨단제조기술을 기존 프로세스에 빠르게 통합하지 못할 수 있으며, 유용성이 제한된 제품의 성급한 확장이 진행될 수 있음
ㅇ 개인보호장비를 개발하려는 非 의료제조업체는 의료용으로 사용되는 멸균용품 혹은 멸균 공정에 대한 접근성이 낮음
ㅇ 현재의 3D 프린팅 센터는 생산 규모를 맞춰 제조하는 것보다 개념증명 설계 시연을 위해 설계된 경우가 많음
ㅇ 제조업체는 서두르게 되면서 필요한 용량에 맞게 공장을 확장 할 수 있는지의 충분한 검토 없이 공장을 구매 혹은 건설 할 수 있음
□ 많은 제조업체, 특히 필요에 따라 제조 제품을 전환하는 제조업체 관련 규정 및 요구 사항에 대한 이해가 부족함
ㅇ 긴급사용승인(EUA) 허가에 의해 제조되는 제품에 대한 제조업체의 책임이 명확하지 않음
ㅇ 자체 테스트 키트를 제조 할 수 있는 병원 또는 연구 센터에 연결된 실험실은 FDA로부터 긴급사용허가(EUA)를 받아야하기 때문에 키트 및 테스트 샘플 생산 능력이 저하됨
ㅇ 제조를 다른 시설로 이전 하는 경우, 제품 응용프로그램에 추가 데이터가 필요
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보


 (GT주간브리프-워싱턴) 포스트 팬데믹 美 국가 기술 개발 로드맵 ...
(GT주간브리프-워싱턴) 포스트 팬데믹 美 국가 기술 개발 로드맵 ...