기술동향
조직 투명화 기술을 이용한 개개세포수준 뇌 네트워크 매핑
- 등록일2021-07-06
- 조회수4003
- 분류기술동향 > 플랫폼바이오 > 바이오융합기술
-
자료발간일
2021-06-25
-
출처
한국분자세포생물학회
- 원문링크
-
키워드
#조직투명화#개개세포수준#뇌네트워크
조직 투명화 기술을 이용한 개개세포수준 뇌 네트워크 매핑
◈본문
서론
조직 투명화 기술은 기관이나 두꺼운 조직의 세포구조 및 분자발현을 3차원으로 볼 수 있게 하는 기술이다. 2016년 3월 본지에 한차례 소개된 바 있는 이 기술은, 최근의 3차원 이미징 및 AI를 이용한 이미지 분석기술의 발달과 결합하여, 다양한 모델 시스템(동물, 식물, 오가노이드)과 조직(다양한 기관, 암 조직)의 3차원 분석을 가능하게 함으로써, 다양한 생물학 분야의 발전에 기여하여 왔다. 특히 불투명한 포유류의 뇌에 적용되어 개개세포수준 뇌 네트워크 매핑(Single-cell brain network mapping)을 가능하게 함으로써, 뇌 기능의 기작에 대한 아주 깊은 이해를 제공할 것으로 기대되어 왔다. 이 글에서는 개개세포수준 뇌 네트워크 매핑의 중요성과 기술적 난점들을 소개하고, 조직 투명화 기술이 이를 어떻게 해결할 수 있는지에 소개하고자 한다.
개개세포수준 뇌 네트워크 매핑의 중요성
뇌는 수많은 세포 및 세포 간 연결로 구성되어있다. 이때 세포 간 연결의 수가 세포들의 수보다 훨씬 많으므로, 뇌의 기능은 많은 부분 세포 간 연결에서 창발되며, 따라서 뇌의 기능과 질병의 완전한 이해를 위해서는 뇌세포 간 연결을 매핑해야한다는 주장이 제기되었고(Alivisatos et al., 2012), 이는 미국의 Brain Initiative 와 유럽의 Blue Brain Project 를 포함한 다양한 국가 규모 프로젝트들의 론칭을 이끌어 내었다. 뇌매핑은 대표적으로 뇌 부위 수준, 세포 타입 수준, 개개세포 수준에서 이루어질 수 있는데, 뇌 세포 각각이 하나의 정보처리 유닛이며, 같은 부위에 있는 같은 타입의 세포라 하더라도 그 연결 및 기능이 다양할 수 있다는 점을 고려할 때, 개개세포수준 뇌 네트워크 매핑은 뇌의 신비에 가장 가까이 다가갈 수 있는 뇌매핑 방법으로 여겨진다.
개개세포수준 뇌 네트워크 매핑의 어려움
하지만 개개세포수준 뇌 네트워크 매핑은 많은 기술적 난제를 가진다. 대표적으로 개개신경세포연결의 시각화는, 연결에 사용되는 개별 시냅스를 시각화하고, 각 시냅스에 연결된 축삭과 수상돌기를 3차원으로 재건하는 프로세스를 필요로 한다. 그런데 시냅스와 축삭 및 수상돌기는, 작은 것은 지름이 몇십 나노미터 정도로 굉장히 작기때문에 매우 높은 해상도의 이미징을 필요로 하며, 따라서 전자현미경이 주로 이용되어 왔다.
최초의 개개세포수준 신경 네트워크 매핑은 예쁜꼬마선충(C. elegans)에서 이루어졌다(White et al., 1986). 1mm 정도 길이의 이 동물은 302개의 신경세포와 7000여개의 세포 간 연결을 가지는데, 조직을 아주 얇게 자르고, 자른 절편을 전자현미경으로 이미징한 뒤, 각 이미지를 이어 붙여서 3차원 네트워크를 복원 및 정량하는 방식(‘Sectioning and reconstruction 방법’)을 사용하여,. 10년이 넘는 노력 끝에 C. elegans 의 개개세포수준 신경 네트워크 맵을 완성할 수 있었다. 이후 좀 더 고등한 생물의 뇌를 매핑하기 위한 다양한 시도들이 이루어지고 있으며(Winnubst et al., 2019; Zheng et al., 2018), 다양한 Sectioning and reconstruction 방법들이 개발되어 왔다(Hayworth et al., 2020; Kasthuri et al., 2015).
그러나 궁극적으로 우리가 알고자 하는 포유류의 뇌, 나아가 인간의 뇌 네트워크를 매핑하기에 Sectioning and reconstruction 방법은 근본적 한계를 지닌다. 우선 해당 방법은 매핑 시 높은 에러율을 보인다. 조직을 자를 때 세포구조가 왜곡되는데, 이는 신경회로를 매핑하는 과정에서 피할 수 없는 에러를 야기한다. 그런데 뇌 네트워크 매핑에서 에러는 굉장히 치명적이다. 예를 들어, 한 신경세포의 축삭돌기 전체 중 단 한 부분을 다른 신경세포의 축삭돌기와 착각할 경우, 해당 신경 네트워크는 완전히 다른 네트워크로 잘못 판단될 수 있다.
이러한 에러의 해결을 위해 지난 수십 년 동안 세포구조 왜곡을 줄이는 새로운 sectioning 기술들이 개발되고, 인공지능을 이용한 이미지 분석법이 개발되어 왔다. 하지만 여전히 2021년 현재에도 뇌 네트워크매핑의 에러는 인간에 의해 수정되어야 하며(DeWeerdt, 2019), 이것이 302개의 신경세포를 가진 예쁜꼬마선충의 경우에는 가능했으나, 그보다 훨씬 많은 신경세포를 가지고(생쥐 뇌: 7천만 개; 인간 뇌: 1천억 개) 복잡한 뇌 네트워크를 가진 포유류의 뇌에서는 불가능할 것으로 여겨진다. 이 외에도 sectioning and reconstruction 방법은 조직내 분자가 소실되며, 조직을 자르고 3차원으로 재구성하는 과정에 많은 노력과 자원이 소모된다는 단점이 있다.
그림 1. CRISPR-Cas와 세포내 신호전달 조절 모식도
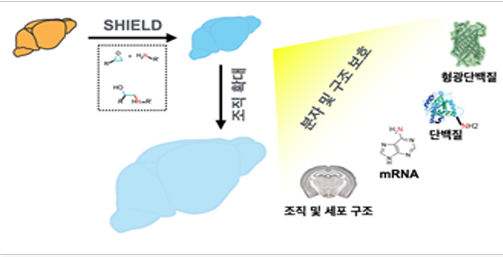
그림 1. SHIELD. SHIELD는 투명화 시 다양한 분자와 조직 및 세포 구조를 보존하고, 필요에 따라 조직을 물리적으로 확대 가능하게 함으로써 3차원 초고해상도 이미징을 가능하게 한다.
조직 투명화 기술 기반 뇌 네트워크 매핑
조직 투명화 기술은 지질 제거 및 굴절률 균질화를 통해 조직을 투명화함으로써, 두꺼운 조직이나 기관 전체를 sectioning 하지 않고 3차원 이미지를 얻을 수 있게 한다. 따라서 조직 sectioning시 발생되는 세포구조의 왜곡이 없기에, 조직 투명화 기술은 개개세포수준 뇌 네트워크 매핑을 포유류의 뇌에서 달성할 수 있는 새로운 접근법으로 주목받아 왔다. 하지만 조직 투명화 기술이 개개세포수준 뇌 네트워크 매핑에 적용되기 위해서는 역시 극복해야할 몇가지 난제들이 존재한다.
첫 번째 난제는 조직 투명화 과정이 세포 구조 및 분자의 변성을 야기한다는 점이다. 뇌 회로 매핑은, 신경세포의 구조에 더하여, 세포의 기능에 중요한 몇몇 핵심 분자(단백질, RNA)들의 보존 및 시각화를 필요로 한다. 그런데 뇌 매핑을 위한 조직 투명화는 지질 제거 과정을 필요로 하고(지질제거를 필요로 하지 않는 조직 투명화 기술들도 있으나, 조직의 투명도가 제한되므로 뇌 네트워크 매핑에는 사용이 힘듦), 이 지질 제거 과정에 쓰이는 세제들은 조직 내 세포 구조와 분자의 변성을 야기하므로, 믿을만한 개개세포수준 뇌 네트워크 매핑을 불가능하게 한다.
두 번째 난제는 투명화된 두꺼운 뇌 조직을 뇌 네트워크 매핑을 위해 충분한 고해상도로 이미징하는 것이 불가능하다는 점이다. 두꺼운 조직의 3차원 시각화는 긴 working distance의 대물렌즈를 사용한 이미징을 필요로 하는데, working distance는 해상도에 반비례하므로, 시냅스를 시각화할 정도의 고해상도 이미징은 몇~몇백 마이크론 정도의 얇은 조직 절편에서만 수행되어왔다.
최근 이러한 난제들을 극복하고, 조직 투명화 기술을 이용한 뇌 회로 매핑을 가능하게 하고자 하는 시도가 있었다. SHIELD라는 조직 투명화 기술은 폴리에폭시(polyepoxy)를 사용해 조직 내 분자들을 보호하고 분자들끼리의 네트워크를 형성함으로써, 다양한 분자들과 세포구조를 보존하면서 조직을 투명화 시킬 수 있다(Park et al., 2019)(그림 1; ref). 또한 SHIELD에 사용된 분자 간 네트워크는 물리적으로 확대될 수 있는데, 이는 working distance가 길지만 해상도가 낮은 대물렌즈들을 사용한 고해상도 이미징을 가능하게 함으로써, 뇌 네트워크 매핑에 필요한 3차원 고해상도 이미징을 가능하게 한다.
SHIELD의 이러한 특징은 생쥐 뇌 기저핵(Basal ganglia)의 개개세포수준 뇌 네트워크 매핑을 가능하게 하였다. 기저핵 중 Globus pallidus externa 에 있는 Parvalbumin+ 세포들(GPe-PV+)은 파킨슨병의 발현 및 치료에 중요한 신경세포로 생각되어 왔으며(Mastro et al., 2017), 다양한 다른 기저핵 부위들에 연결되어있는 것으로 알려져 왔다(Lilascharoen et al., 2021). GPe-PV+세포가 어떻게 파킨슨병의 발현에 기여하는지 알기 위해서는 해당 세포와 다른 세포들 간 연결을 아는 것이 필수적이지만, 개개 GPe-PV+ 세포가 어떠한 연결을 어떠한 세포와 이루는지는 기술적 한계로 밝혀지지 않아왔다.
SHIELD는 한 조직으로부터 mRNA, 단백질, 형광단백질 등 주요 분자들의 발현 정보를, 조직확대를 이용해 3차원 고해상도로 시각화함으로써, GPe-PV+ 신경세포의 개개세포수준 매핑을 달성하고, 해당 세포의 정량적 다이어그램의 완성을 가능하게 하였다(그림 2). 또한, 이 매핑을 통해 기존에 알려지지 않았던 새로운 신경회로 motif를 발견함으로써, 개개세포수준 뇌회로매핑의 필요성을 역설하였다.
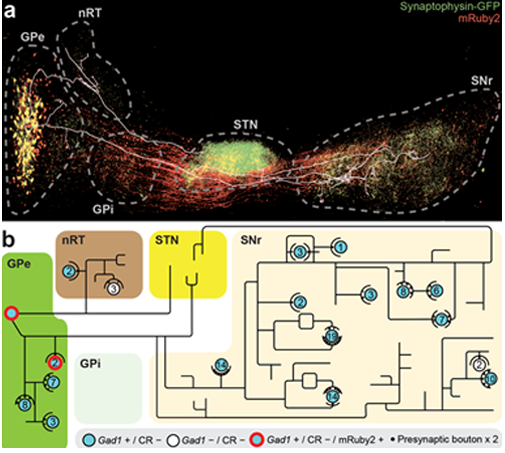
그림 2. SHIELD를 이용한 개개세포수준 뇌 네트워크 매핑. a) GPe-PV+ 신경회로의 3차원 이미지 및 3차원 재구성 된 개별 세포(하얀색 trace). b) 재구성된 GPe-PV+ 세포의 연결 다이어그램.
인공 후성유전조절 효소를 통한 DNA Methylation 또는 Histone Modification
인공 후성유전 조절 효소(CRISPR Epigenome Editors)는 크게 DNA de/methylation 또는 histone modification을 통하여 유전자발현을 조절 한다. 이들 시스템은 모두 DNA methylation과 histone modification의 분자생물학적 지식을 기반으로 site-specific한 정교한 유전자 발현 조절을 위하여, DNA methylation 또는 histone modification 조절에 관여하는 효소의 catalytic domain을 CRISPR 시스템에 도입함으로서 프로그램이 가능한 유전자 발현 툴을 디자인한다.
초창기의 프로그램 가능한 DNA methylation editors는 ZFN 또는 TALEN에 기반했다. 하지만 CRISPR 시스템의 도입으로 DNA methylation editor는 비용과 대용량 분석에 있어 기존 대비 기술적 우위를 가지게 된다. DNA methylation 조절을 위한 Epigenome Editors는 DNMT나 TET를 활용한 연구보고가 활발하게 보고 되었다(White et al., 1986).
DNMTs는 cytosine에 methyl group을 추가하여 유전자 발현을 억제 시키는 후성유전조절 효소이다. 따라서 DNMTs catalytic domains은 dCas9에 융합되어 프로그래밍 가능한 유전자 발현 억제가 가능한 인공 후성유전 조절 효소가 될 수 있는 것이다. 이와는 반대로, TET는 dCas9에 융합하여 원하는 유전자의 발현 조절을 위한 demethylation을 수행하고 이를 통하여 크로마틴의 decondensation을 통하여 전사인자들의 recruiting이 가능하게 한다.
실제로 dCas-TET 시스템을 통하여 renal fibrosis의 감소를 보인 연구결과가 보고 되어 CRISPR Epigenome Editors의 프로그램 가능한 인공후성유전조절 효소로서의 가능성을 확인하였다(Winnubst et al., 2019).
유전자의 발현 조절에 있어 히스톤 상태의 변화는 DNA methylation 상태 변화와 더불어 매우 중요한 후성유전 조절에 해당한다. DNA methylation 조절 효소와 마찬가지로 histone methylation에 관여하는 EZH2(HMT), PRDM9(HMT), LSD1(HDM) 또는 p300(HAT) 같은 효소의 catalytic domain이 dCas9에 융합된 인공 후성유전조절 효소의 연구가 보고 되고있다(Zheng et al., 2018).
EZH2는 H3K27 trimethylation에 관여, 유전자 발현을 억제한다. LSD1은 demethylase로서 H3K4me1/2와 H3K9me2로부터 methyl group을 제거하여 유전자 발현을 조절하는 것으로 알려져 있다. 또한 p300은 H3K27을 acetylation, PRDM9은 H3K4 methylation을 통하여 유전자의 발현을 강화하는 역할을 한다.
특히 DNA methyltransferase(DNAMT3A-dCas9)과 histone methyltransferase(EZH2-dCas9)을 동시에 활용하면 long-term 후성유전조절 기억이 가능하여, 이를 통한 질병 치료의 가능성 역시 보고되었다(Zheng et al., 2018). 이렇듯 다양한 후성유전조절 효소의 본 기능을 토대로 인공 후성유전조절 효소의 암, 염증 조절 유전자의 발현 억제에 관한 연구 등이 진행되어 본 기술의 활용에 대한 영감을 주고 있다.
맺음말
자연계에 존재하는 가장 복잡한 시스템인 인간의 뇌에 대한 관심은 나날이 증가해가고 있다. 필자가 소개한 SHIELD와 같은 조직 투명화 기술은 포유류 뇌의 개개세포수준 매핑을 가능하게 함으로써, 뇌 기능에 대한 새로운 차원의 이해를 제공할 것으로 기대된다. 또한 SHIELD를 통해 발견 될 새로운 신경회로 motif들은, 뇌를 회로 motif들의 조합으로 환원시킴으로써 뇌의 정보처리과정에 대한 이해를 용이하게 할 뿐만 아니라, 인공지능에 적용되어 뇌와 같이 유연하고 빠르게 학습할 수 있는 새로운 인공지능의 개발을 촉진할 것이다.
또한 치매와 같은 뇌 질병을 생성하는 뇌 회로를 밝힘으로써, 더 효과적이고 부작용이 적은 뇌 질환 치료법의 개발을 가속화 할 것으로 기대된다. 한편 조직 투명화 기술은 뇌 이외의 기관 혹은 조직에 폭넓게 적용되어, 생명 시스템을 전체적인 시각에서 바라보게 하고, 세포 간 상호작용이 어떻게 생명 시스템의 기능을 만들어내는지에 대한 근본적인 해답을 제공할 것이다.
필자는 처음 뇌조직을 염색하였을 때, 뇌 조직이 빈 공간이 하나도 없이 뇌회로연결로 꽉 차있음을 깨닫고 감탄한 적이 있다. 앞으로 인간이 뇌의 신비를 어디까지 밝혀낼 수 있을지 사뭇 궁금해진다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보

