기술동향
췌장암의 대사 의존성과 이를 공략하는 항암 전략
- 등록일2021-07-07
- 조회수4809
- 분류기술동향 > 레드바이오 > 의약기술
-
자료발간일
2021-07-01
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#췌장암#대사의존성#항암전략
- 첨부파일
췌장암의 대사 의존성과 이를 공략하는 항암 전략
◈목차
1. 서론
2. 유전자 변이와 대사(Genetic alterations and metabolism)
3. 에너지로 사용되는 영양분(Fuel source utilization)
3.1. 포도당(Glucose)
3.2. 글루타민(Glutamine)
4. 리소좀을 활용한 영양분 획득(Lysosomal nutrient scavenging)
4.1. 췌장암 세포에서 자가소화 기전의 필요성
4.2. 췌장암에서 대사적 역할 외의 자가소화 기전의 역할
4.2.1. 마크로피노사이토시스(Macropinocytosis)
5. 암-주변 기질 간 상호작용(Tumour–stroma crosstalk)
6. 췌장암의 대사적 취약점을 공략하기(Targeting metabolic liabilities)
6.1. 리소좀 대사 공략(Targeting lysosomal scavenging in pancreatic cancers)
6.2. 글루타민 대사 공략(Targeting glutamine metabolism in pancreatic cancers)
6.3. 미토콘드리아 대사 공략(Targeting mitochondrial metabolism in PDAC)
6.4. 시스테인의 역할(The role of cysteine in pancreatic cancers)
6.5. 대사적 취약점을 찾아내기 위한 유전체 검색 법
7. 결론
◈요약문
췌장암(Pancreatic ductal adenocarcinoma, PDAC)은 5년 후 생존율이 10% 미만일 정도로 매우 악성인 암 종이다. 췌장암은 섬유화 및 세포외기질이 과도하게 축적된 췌장암 특이적 종양 미세환경을 가지는데 이러한 췌장암 특이적 종양 미세환경을 “섬유결합조직(desmoplasia)”이라고 한다. 이러한 특징은 종양미세환경으로 하여금 높은 간질액압, 혈관의 붕괴, 영양소와 산소의 결핍을 나타나게 한다.
이와 같은 췌장암 특이적 종양미세환경은 다른 암들과 차별되는 췌장암 특이적 암 생물학 특징을 유도하며 치료적 저항성을 가지게끔 한다. 췌장암은 이같이 세포의 성장에 해가 되는 환경에서 살아남기 위해, 다른 암세포와 차별되는 자가소화 기전(autophagy) 및 macropinocytosis와 같은 대사 과정을 발전시켰다. 본 리뷰 논문에서 저자들은 췌장암 특이적 종양미세환경에서 살아남기 위해 췌장암 세포가 사용하는 대사적 경로를 살펴보았다.
췌장암이 살아남기 위해, 척박한 종양미세환경에서 어떻게 대사를 변형하였는지 이해함으로써, 연구자들은 향후 새로운 치료적 접근법을 발견할 수 있을 것이다.
키워드: Pancreatic cancer, metabolism, tumor microenvironment, autophagy, macropinocytosis
분야: Cancer Biology/Oncology
◈본문
1. 서론
췌장암은 5년 생존율이 10% 미만일 정도로 매우 치명적인 질병이다. 이렇게 예후가 좋지 않은 이유는 췌장암의 경우, 조기 진단 방법이 딱히 존재하지 않으며, 암 자체가 치료적 저항성을 갖기 때문이다. 지난 수 십 년간 진행된 많은 연구를 통해 췌장암의 발생과 진행과 연관된 유전적 변화들이 규명되었다. 췌장암 환자의 90% 이상에서 발암 유전자(oncogene)로 잘 알려진 KRAS의 돌연변이가 발견되며, TP53, SMAD4, CDKN2A와 같은 암 억제 유전자(tumor suppressor genes)가 망가져 있는 것이 관찰되었다.
KRAS의 경우 췌장암 발생 단계 중 조기에 나타나며, TP53 유전자가 망가지는 사건은 췌장암 발생 후기에 나타난다. 여기에 더해 GNAS, RNF43, KDM6A, BRAF와 같은 유전의 돌연변이가 췌장암 환자에서 자주 나타난다. 이런 유전자들이 췌장암의 발생 및 진행에 어떤 영향을 미치는지 유전자 변형 마우스와 인간으로부터 유래한 세포 모델에서 검증되었다. 이러한 노력에도 불구하고 아직 췌장암을 치료하는 단계까지 발전하지는 못했다.
췌장암은 특징적인 암 미세환경(tumor microenvironment, TME)을 가진다. 췌장암 미세환경에는 collagen이나 hyaluronic acid와 같은 세포 외 기질이 가득 차 있는 섬유성 기질인 desmoplasia 가 많이 존재한다. 실제로 인간이나 동물에서 발생한 췌장암을 살펴보면 암 덩어리 중 암세포는 상대적으로 적은 부피를 차지하지만, desmoplasia와 같은 구조가 암 덩어리의 상당 부분을 차지하고 있는 것을 확인할 수 있다.
또한, 이러한 암 미세환경에는 암-연관 섬유 아세포로 알려져 있는 CAFs (cancer-associated fibroblasts), 면역세포, 혈관내피세포, 신경세포들이 한데 어우러져 존재한다. 암 미세환경의 복잡한 기질 구조는 암 덩어리 안에 혈관 구조가 적절히 발생하는 것을 방해하고, 그 결과, 산소가 부족하게 되는 hypoxia (저산소) 환경이 나타나게 된다.
실제로 췌장암은 인간 암 덩어리 중 가장 산소 농도가 낮은 암 덩어리로 알려져 있다. 기술적인 이유로 암 미세환경에 존재하는 대사체(metabolites)의 농도를 정확히 측정하는 것은 어렵지만, 췌장암 내부는 혈관 부족과 여러 세포들 간에 영양분 섭취 경쟁으로 인해 영양분 부족 현상이 나타나게 된다. 실제로 여러 연구들에서 암 조직 그 자체나, 종양-간질액 대사체를 분석해 본 결과 영양분 결핍이 있다는 것이 보고되었다.
췌장암 세포는 이렇게 영양분이 부족한 환경에서 살아남고 증식하기 위해서 암 세포 내의 대사과정을 재조정(reprogram) 할 수 있다. 어떻게 췌장암 세포가 대사 과정을 조절하는지 이해한다면, 췌장암을 치료하는 과정에 분명 도움이 될 수 있을 것이다. 본 리뷰 논문에서, 저자들은 췌장암에서 나타나는 3가지 주요 대사 과정을 살펴보았다. 간략히 설명하면, 첫째, 췌장암 세포에서 나타나는 연료로서 탄소 대사, 둘째, 영양분 획득 대사, 셋째, 췌장암 세포와 암 미세환경과 대사 상호작용이다. 끝으로 저자들은 현재까지 췌장암 치료 가능성이 규명된 대사 타겟과 이를 공략한 전략들을 정리하였다.
2. 유전자 변이와 대사(Genetic alterations and metabolism)
암 세포는 그 특징으로써, 변형된 세포 대사가 나타난다. 실제로 끊임없는 세포 분열을 위해 암세포는 많은 대사체, 영양분을 필요로 한다. 많은 연구들을 통해 췌장암과 그 밖의 다른 질환들에서 암 유발 돌연변이들이 세포 대사를 변형시킨다는 것이 밝혀졌다. 췌장암에서는 암 유발 돌연변이인 KRAS와 연관되어, 증가된 포도당 섭취와 이를 이용한 세포 내 합성 증가, 글루타민 대사를 통해 활성 산소(reactive oxygen species, ROS) 수준을 통제하는 대사 변화가 나타난다.
또 영양분 부족에 대응하기 위해 췌장암 세포의 KRAS 암 유발 돌연변이는 대사적 획득 과정을 활성화 시키는 것으로 여겨진다. 최근에는 KRAS 암 유발 돌연변이가 췌장암 세포로 하여금 면역세포로부터 분비되는 cytokine에 반응하여 대사적 변화가 일어나게끔 유도한다는 사실도 밝혀졌다.
KRAS 암 유발 돌연변이 외에도, 다른 유전자에서도 돌연변이가 발견되며, 이들의 증폭 또는 상실이 췌장암 세포의 대사에 영향을 미친다는 것이 보고되었다. 이렇게 돌연변이가 생기는 유전자로써 GNAS, TP53, PTEN, MYC이 있다. GNAS를 활성화 시키는 돌연변이는 암세포로 하여금 지방 산화 대사를 증가 시켜 췌장암을 악화시킨다. MYC 전사 인자는 췌장암을 포함해서 많은 암 종에서 대사를 조절하는 주요 조절자로 알려져 있다.
다양한 연구들에서 MYC이 췌장암과 연관하여 외부 혹은 내부인자들과 연관되어 중요한 조절자라는 것이 알려졌다. 또, 암 억제자로써, TP53 단백질은 췌장암이 진행되며 돌연변이가 나타나는 중요 유전자이다. 이러한 TP53은 자가포식(autophagy)와 관련된 유전자를 발현시키거나, TIGAR (TP53-induced glycolysis and apoptosis regulator)를 발현 시켜 활성 산소종(ROS)을 조절하는 대사적 역할을 한다.
TP53에 돌연변이가 있는 췌장암 마우스 실험에서, 돌연변이가 없는 wild-type TP53을 발현시킨 경우, “alpha-ketoglutarate”라는 대사체가 췌장암에 축적되고, 이로 인해 유전체 구조적으로 유전자 발현이 용이해지는 변화가 유도되어 결과적으로 암의 진행이 억제되었다는 보고가 있다. 마지막으로, 암 억제 유전자인 PTEN은 PI3K-ATK 신호전달 경로를 억제함으로써, 이 신호전달 경로를 조절한다. PI3K-AKT 신호전달 경로는 포도당 대사, 산화-환원 조절 및 지질 합성 대사와 밀접하게 연관되어 있다.
PTEN 유전자는 종종 췌장암에서 그 발현이 억제되어 있고, 이는 PI3K-AKT 신호 전달 경로가 과도하게 활성화 되며, KRAS 돌연변이와 함께 췌장암을 악화시키는 것으로 알려져 있다. 정리해보면, 암 유발 돌연변이로서 KRAS 돌연변이는 다른 유전자 돌연변이 또는 이들 유전자의 변화와 함께 췌장암의 대사를 변형시키는 주요 대사 조절자로 작용한다.
3. 에너지로 사용되는 영양분(Fuel source utilization)
3.1. 포도당(Glucose)
포도당(glucose)은 세포의 주요 에너지원이다. “해당 과정”이라 불리는 포도당 대사 과정에서 하나의 포도당은 대사되어 ATP를 생산하며 2개의 pyruvate로 전환된다. 이후 pyruvate는 미토콘드리아로 들어가 tricarboxylic acid (TCA) cycle을 돌리는 연료로 사용되든지 아니면, 세포질에서 lactate로 전환되게 된다.
실제로 1920년대 Warburg라는 연구자는 암세포가 산소가 있는 조건임에도 불구하고 포도당 대사 결과 생성되는 많은 양의 pyruvate가 미토콘드리아 대사가 아닌 세포질에서 대사되어 lactate로 바뀐다는 사실을 발견하였다. 또 중요한 것은 포도당이 해당 과정을 거치면서 다른 생합성 경로에 사용되는 대사체를 만들어 내게 된다는 것이다. 예를 들어, 포도당을 사용하는 pentose phosphate pathway의 경우 생합성 보조 인자로 사용되는 NADPH를 생산해 내게 되며 동시에 DNA 합성에 관여하는 “ribose”라는 물질을 생합성 한다.
Hexosamine 생합성 경로는 포도당을 사용하며 “uridine diphosphate N- acetyl glucosamine (UDP- GlcNAc)”라는 대사체를 만들어내는데, 해당 대사체는 단백질의 당화(glycosylation)에 중요 기질로써 사용된다. 또, 해당 과정 중 생성되는 대사체 중 일부는 세린-글리신-일탄소 대사 과정으로 전환되어 사용되는데, 이 대사 과정은 뉴클레오타이드 생합성과 세포 내 메틸화 반응, 지질 생합성이 지속적으로 유지되게끔 한다.
이같이 포도당 대사는 세포 내에서 다양한 대사 경로에 기여하므로 KRAS, MYC과 같은 암 유발 유전자가 활성화 되었을 때 포도당 사용을 증가시킴으로써, 암 성장이 촉진되는 것은 어찌 보면 당연한 현상이라고 할 수 있다. 실제로 KRAS (G12D) 돌연변이를 사용하여 쥐에서 췌장암을 유도한 결과, 췌장암 세포에서 포도당 수송체인 GLUT1과 해당 과정 관련 유전자들의 발현이 증가되어 결과적으로 포도당 사용이 증가된 것이 보고되었다.
또, KRAS (G12D)의 경우 포도당이 비 산화적 pentose phosphate 대사 경로로 많이 사용되게끔 하였으며, 이 대사를 조절하는 효소를 억제하였을 경우, 세포 또는 동물 모델에서 췌장암의 성장이 억제되었다. 이후 연구들에 따르면 KRAS에 의한 대사 조정은 RAF-MEK-ERK 신호 전달 경로와 맞물려 MYC 유전자 발현을 증가시켰다.
실제로 췌장암 세포에서 MEK 신호 전달 경로를 억제하는 경우, MYC 유전자 발현이 감소하고, pentose phosphate 대사 경로를 담당하는 효소인 ribose-5-phosphate isomerase의 발현이 감소하는 결과를 나타냈다. KRAS는 유전자 발현 변화로서 대사를 조절하는 것뿐만 아니라, 직접 대사에 관여하는 대사 효소와 물리적으로 상호작용 하기도 한다.
KRAS의 아형인 KRAS 4A의 경우 해당 과정 담당 효소인 hexokinase 1과 결합함으로써 췌장암 세포에서 해당 과정을 증가시킨다. 이러한 결과들은 암 유발 돌연변이로서 KRAS가 췌장암에서 포도당의 사용을 증가 시켜 암 성장을 촉진한다고 할 수 있다 (그림 1).
3.2. 글루타민(Glutamine)
미토콘드리아는 세포의 에너지를 공급하는 주요 세포 내 소기관일 뿐만 아니라, 세포의 성장과 항상성 유지에도 매우 중요한 소기관이다. 이를 위해 미토콘드리아는 다양한 대사 효소, 대사체 저장고로서 세포 내 다른 소기관들과 차별되는 대사적 역할을 하게 된다. 대부분의 대사체들이 확산으로 미토콘드리아 막을 통과할 수 없기 때문에, 미토콘드리아 내 생화학 반응은 세포질에서 일어나는 생화학 반응과 구분되어 일어나게 된다. 실제 미토콘드리아는 그 안에서만 일어나는 고유 반응인 TCA 회로와 산화적 인산화(oxidative phosphorylation, OXPHOS) 반응을 담당하고 있다.
TCA cycle로 유입되는 대사체 중 가장 많은 부분을 차지하는 대사체는 pyruvate이다. Pyruvate 외에 지방산이나 글루타민과 같은 아미노산 역시 TCA cycle의 재료로 사용된다. 이와 관련하여 많은 연구자들이 췌장암뿐만 아니라, 다양한 암세포에서 미토콘드리아 대사가 중요하다고 보고하였다.
글루타민은 비필수 아미노산이자 인간 혈장에 가장 많이 존재하는 아미노산으로서 세포 대사에 다양한 역할을 하고 있다. 글루타민의 탄소는 TCA 회로에 사용되는 중요한 전구체이다. 글루타민의 첫 번째 대사과정에서 글루타민은 glutaminase 효소에 의해 글루타메이트(glutamate)로 전환된다. 일반적으로 글루타민으로부터 만들어진 글루타메이트는 “glutamate dehydrogenase (GLUD1)”이라는 효소에 의해 alpha-ketoglutarate로 전환된다. 그 후 alpha-ketoglutarate는 TCA 회로로 들어가 ATP와 NADH, FADH2를 만들어 내며 대사적으로 활성화된다.
글루타민은 TCA 회로에 사용되는 것뿐만 아니라, 다른 세포 내 생합성 경로에도 대사적으로 기여한다. 예를 들어, 글루타민의 아민기는 다른 아미노산이나 hexosamine을 합성하는데 사용될 뿐만 아니라, pyrimidine 이나 purine 과 같은 뉴클레오타이드를 합성하는데 사용된다. 또 글루타민은 세포의 산화-환원 평형을 유지하는데 중요한 조효소인 NADPH 나 글루타치온(glutathione) 생성에 사용된다. 이같이 세포 대사에서 글루타민이 가지는 대사적 중요성을 고려한다면, 글루타민이 암세포의 성장과 생존에 미치는 영향에 관해 그토록 많은 연구가 이뤄진 것은 그리 놀라운 일이 아니다.
췌장암 세포에서 글루타민은 조금 다른 방식으로 산화-환원 평형을 유지하는데 중요하다. 글루타민은 췌장암 세포의 미토콘드리아에서 글루타메이트, alpha-ketoglutarate로 전환되고, aspartate aminotransferase (GOT2)에 의해 아스파테이트(aspartate)로 바뀌게 된다. 이후 세포질로 이동되고 pyruvate를 합성하며 “NADPH”라는 환원력을 제공할 수 있는 조효소를 만들어내게 된다.
이 과정을 억제하는 것은 결과적으로 췌장암의 성장을 억제하는데 효과적임이 밝혀졌다. 이 연구에서 중요한 것은 췌장암 세포가 전통적 글루타민 대사 효소인 GLUD1를 의지하는 것이 아니라, 글루타민의 아민 대사를 담당하는 GOT1과 GOT2에 의존적이라는 것이다. 같은 맥락에서, 또 다른 연구 그룹에서는 “UCP2”라고 하는 transporter가 글루타메이트로부터 유래한 아스파테이트를 미토콘드리아에서 세포질로 내보내는데, 이를 막는 것이 췌장암 성장을 억제하는데 중요함을 보고하였다.
2019년에는 glutamate ammonia ligase (glutamine synthetase) 효소가 glutamine이 결핍된 암 미세환경에서 췌장암 세포에 필수적임을 보고하였다. 실제로 glutamate ammonia ligase의 발현을 감소시킨 동물 모델에서 췌장암은 암의 성장을 지연시켰다. 또, SLC1A5 유전자로부터 발생하는 “SLC1A5_var”라는 전사 변이체는 미토콘드리아 글루타민 수송체로서 췌장암의 글루타민 대사에 중요함이 밝혀졌다 (그림 1).
이 전사 변이체는 HIF-2a에 의해 발현이 조절되며 과발현된 경우, 미토콘드리아 호흡과 글루타치온 합성이 증가하며 항암제 저항성이 증가함이 보고되었다. 또, SLC1A5_var 전사 변이체의 발현을 억제하는 경우, 동물 모델에서 암의 성장이 억제되는 것이 관찰되었다. 요약하면, 글루타민은 췌장암 대사에 있어 다양한 역할을 함으로써 암 대사를 유지시키고 이를 공략하는 것은 효과적인 치료 전략이 될 수 있다. 하지만, 암의 성장을 지속시키는데 글루타민이 필요하다는 것과는 반대로, 글루타민을 결핍시키는 것이 췌장암의 전이를 증가시킨다는 보고도 있다.
실제로 글루타민 결핍은 췌장암 세포로 하여금 ATF4 와 MEK-ERK 신호전달 경로를 활성화 시키며 상피-간엽 전이(epithelial-to-mesenchymal transition)을 증가시킨다. 그러므로, 췌장암의 성장 그리고 전이에 관하여 글루타민 대사를 공략함에 있어서는 그 전략을 구분하여 적용할 필요가 있다.
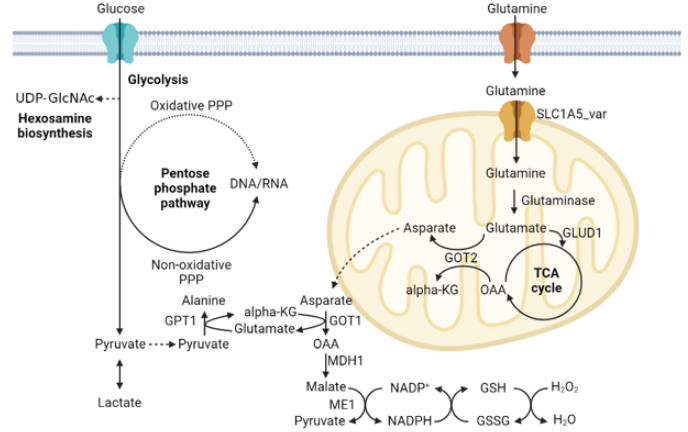
그림 1. 췌장암 특이적인 포도당 및 글루타민 대사
암 유발 KRAS 돌연변이는 췌장암 세포로 하여금 포도당 섭취와 해당 과정을 증가시킨다. 또, 포도당 대사 산물은 pentose phosphate pathway와 hexosamine 생합성 경로로 유입된다. 결과적으로, 이러한 대사적 변화는 세포 분열에 필요한 DNA 및 RNA와 같은 뉴클레오타이드 합성을 유지시킨다. 한편, 글루타민은 췌장암 세포의 미토콘드리아로 유입되어 아스파테이트로 전환되고, 아스파테이트는 다시 세포질로 나와 대사되어 NADPH 를 생합성 한다. NADPH는 세포의 산화-환원 평형 유지에 핵심적인 글루타치온(GSH)를 합성하는데 사용된다.
4. 리소좀을 활용한 영양분 획득(Lysosomal nutrient scavenging)
췌장암 종양 미세환경은 주변 정상 조직에 비하여 많은 양의 기질, 저산소, 영양소 결핍이 나타난다. 이러한 척박한 환경에 적응하기 위해 췌장암은 자가소화(autophagy)나 micropinocytosis와 같이 리소좀을 사용하는 영양분 재활용 신호전달 경로를 활성화 시켜 세포의 항상성을 유지할 수 있다. 췌장암은 MITF, TFE3, TFEB와 같은 전사인자를 통해 자가소화와 관련된 유전자의 발현을 증가시키고 리소좀 생성 조절에 관한 전사 프로그램을 증가시킬 수 있다. 인간 췌장암에서 이들 자가소화-리소좀 관련 유전자들을 활성화시키는 전사 인자가 지속적으로 활성화 상태인 것이 보고되었다. MITF, TFE 관련 단백질을 억제하는 것은 자가소화 및 micropinocytosis의 정상적 작동을 방해함으로써 췌장암이 대사적으로 취약하게 만들 수 있다. 이러한 연구 결과들은 췌장암의 영양분 획득 경로를 공략하는 것이 효과적인 치료적 메커니즘이 될 수 있음을 암시한다 (그림 2).
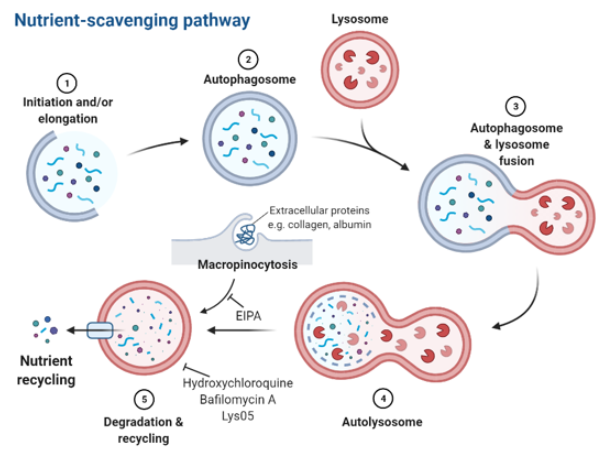
그림 2. 췌장암 세포가 나타내는 리소좀 활용 자가소화 기전을 이용한 영양분 획득.
손상받은 단백질이나 세포 내 소기관이 막구조에 함입되며 이중막 구조의 소낭으로 포장되게 된다(autophagosomes). 최종적으로 만들어진 autophagosomes은 리소좀과 합쳐지게 되며, 안에 들어있던 macromolecules은 잘게 부서지게 된다. 부서진 물질 중 영양분들은 세포질로 나가게 되고, 다양한 세포 대사 경로에 의해 영양분으로서 사용된다. 자가소화 기전과 리소좀 분해는 hydroxychloroquine 이나 Lys05 그리고 bafilomycin에 의해 저해될 수 있다. Macropinocytosis는 비선택적 포식활동으로서 세포 외부에 존재하는 알부민이나 콜라겐 등을 세포 내부로 들여올 수 있고, 리소좀 경로를 경유해 분해시켜 아미노산과 다른 대사체를 세포의 에너지원으로 공급해 줄 수 있다. Macropinocytosis는 “EIPA”라는 물질에 의해 억제될 수 있다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보
지식


 pdf_0003825.pdf
pdf_0003825.pdf