기술동향
FDA 약물 승인 최신 동향 및 혁신 신약 트렌드 분석
- 등록일2021-07-14
- 조회수6212
- 분류기술동향 > 레드바이오 > 의약기술
-
자료발간일
2021-07-13
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#FDA#약물승인#혁신신약#신약트렌드
- 첨부파일
FDA 약물 승인 최신 동향 및 혁신 신약 트렌드 분석
◈목차
1. 서론
1.1. 약물 승인 적용 개념
1.1.1. 혁신 치료제
1.1.2. 우선 심사 및 조기 승인
1.2. 약물 승인 동향
2. 본론
2.1. 최근 개발되는 약물
2.1.1. 항암제
2.1.2. 감염병 타깃 약물
2.1.3. 중추신경계 타깃 약물
3. 결론
4. 참고문헌
◈요약문
최근, 개발하기 어려운 타깃 이였던 KRAS 억제제의 FDA 승인 소식과 더불어 근 18년 동안 진척을 보이지 않았던 알츠하이머 치료제까지 승인되며, 신약 연구 분야에 새로운 바람이 불고 있다. 이렇듯 극복 불가능해 보였던 질병 치료 분야는 깊이 있는 과학기술 및 다양한 연구 개발로 인해 점점 공략 가능한 분야로 바뀌고 있는 것이다. 이러한 트렌드에 맞춰 본 동향리포트를 통해 최근 FDA의 약물 승인 추세 및 새롭게 떠오르고 있는 혁신 신약의 중요성과 개념, 그리고 앞으로의 방향성에 대한 이야기해 보고자 한다.
키워드: FDA, 혁신치료제, 우선 심사, 조기 승인, 신약, 항암제
분야: Cancer Biology/Oncology, Chemical Biology, Medicine
◈본문
1. 서론
지난 2010년과 2014년 사이, 몇몇 블록버스터 약물들의 특허 만료로 인해 대형 제약회사들의 연간 매출에 큰 피해가 생길 것이라 예측되었었다. 실제로 인기 있는 약물들의 특허가 만료됨에 따라, 값이 저렴한 복제약들이 나오기 시작해 개발사인 제약회사에게 그로 인한 막중한 피해가 옮겨가게 되었다 [1].
이 특허 만료에는 소분자 약물로 알려져 있는 화이자의 Atorvastatin (상품명: Lipitor, 2011년 특허 만료, 적응증: 고지혈증 치료제, HMG-COA 환원효소 저해 작용 원리)과 Clopidogrel (상품명: Plavix, 2012년 특허 만료, 적응증: 고위험군의 심혈관계 질환 및 뇌졸중 위험을 감소시키기 위해 사용)이 포함 되어 있었다.
참고로, Atorvastatin은 지난 1997년 출시된 이후로 천억 달러 이상의 매출을 보여준 초대박 블록버스터 약물이다. 특허 만료 직후, 2013년 월 처방액이 80억 원대 초반으로 떨어지는 듯 불안한 행보를 보였지만, 이 시기 이후로 이 약물은 특이하게 월 처방액이 상승하는 역주행 기록을 보여주었다.
Atorvastatin은 기존의 공식인 “특허 만료 후 매출 감소(patent cliffs)”라는 개념이 적용 되지 않았는데, 많은 전문가들은 특허가 풀리면서 제네릭 약물의 선택 폭이 넓어짐에 따라, 오히려 오리지널 약물 선호 현상이 강해진 현상이라 분석하였다 [2-4]. 이러한 특수한 경우를 제외하고는 블록버스터 약물 시장의 점유율 하락이 시작되면서 시장의 경쟁이 더욱 높아지고 있는 상황이다.
그럼 우리가 일반적으로 생각하는 약의 가치는 어떻게 매길 수 있는 것일까? 앞에서 언급한 화이자의 Atorvastatin과 같이 연간 10억 달러 이상의 매출을 보일 수 있는 블록버스터 약물을 만들어야만 의미 결과라고 평가받을 수 있는 것일까? 이러한 블록버스터 약물의 탄생은 기존에 이미 있는 약물과는 다른 기전이나 타깃을 갖는, 소위 말하는 ‘신규성’을 가지고 있어야 하며 더불어 오랫동안 특허의 보호를 받을 수 있는 권리를 포함하고 있어야 만들어질 수 있는 매우 어려운 일 중 하나이다.
약물 개발단계에서 최종 승인까지 걸리는 평균 시간은 8.7년으로 알려져 있다고 한다. 하지만 예외적으로, “Osimertinib (상품명: Tagrisso, 적응증: EGFR 돌연변이 비소세포폐암 1차 치료제)”이라는 약물은 개발에서 승인까지 매우 단축된 2.2년이라는 시간이 걸렸고 [5] 그 뒤에 나온 Deflazacort (상품명: Calcort, 적응증: 면역억제제)도 탄력을 받아 2.3년 만에 FDA의 최종 승인을 받았다 [6].
우리가 소위 말했던 기본 10년은 걸린다는 약물 개발 기간은 위의 두 사례와 같이 fast-track이라는 심사를 거쳐 단축될 수도 있는 것이다. Fast Track은 보통 unmet medical need가 있는 경우 적용 될 수 있는 심사로 시장에 나와 있는 약물이 없는 경우가 이 카테고리에 속할 수 있다.
이는 신약 심사 과정이라기 보다는 임상 3상을 잘 수행하기 위해 마련된 제도라 볼 수 있다. 우리가 잘 알고 있는 코로나 백신의 개발 승인 단계가 이 경우라 볼 수 있다. 이렇듯 약물 개발단계에서 빠른 승인 속도가 중요한 이유는 물질특허 등록으로부터 기술이나 지적 재산권이 들어간 상품의 생산과 판매를 타사에 허가해 주는 즉, 라이센싱 아웃을 위한 시점까지의 소요 시간을 최소화해야만 약을 개발한 개발사가 최고의 이익을 가져갈 수 있기 때문이다.
1.1. 약물 승인 적용 개념
약물을 가능한 빠르게 개발해 환자들에게 제공하기 위해 FDA는 앞서 언급한 ① 패스트트랙(Fast Track)이라는 제도와 ②혁신신약(Breakthrough Therapy) ③우선심사(Priority Review) 그리고 ④가속 승인(Accelerated Approval) 제도를 가지고 있다.
1.1.1. 혁신 치료제

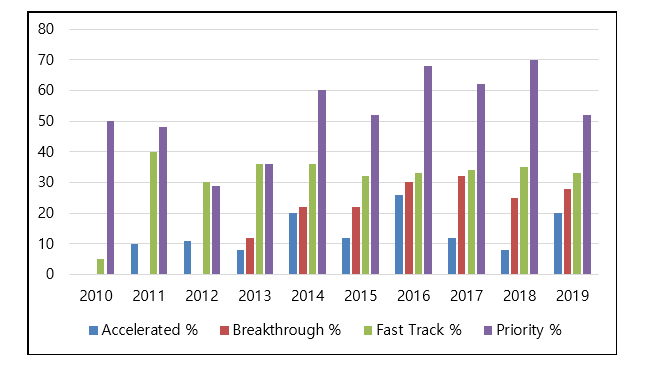
그림 1. 혁신치료제 및 조기심사 승인 약물.
첫 번째로 breakthrough 즉, “혁신치료제”라는 약물 승인 적용개념에 대해 알아보자. 이는 예비 임상 데이터가 최근 치료결과보다 적어도 한 가지 이상의 뛰어난 결과를 가지고 있는 경우가 속할 수 있게 된다. 즉, 기존 치료방법보다 치료 결과가 좋다는 것을 증명하면 되는데, 예를 들어, 항암제의 경우, 독성 문제 때문에 약 처방을 줄여야 하는 치료법을 사용하게 되는 경우가 있다.
이를 극복하기 위해 독성이 적은 치료법이나 약물을 개발하게 된다면, 이 혁신신약의 범주에 들 수 있게 되는 것이다. 지난 FDA의 신약 승인 건수를 살펴보면 2017년 46건, 2018년 59건에 이어 2019년은 총 48건의 승인 기록을 보였다. 특히나, 2019년 승인된 신약 48건 중 절반에 차지하는 비율이 혁신 신약 심사제도로 승인을 받은 약물이기에 많은 전문가들은 앞으로도 점점 혁신신약의 역량이 강화될 것으로 예측하였다 [7].
몇 가지 예를 들어보면, 최근 승인받은 암젠의 KRAS 억제제인 Sotorasib (상품명: Lumarkras)가 이 혁신신약 카테고리에 속한다. KRAS는 그동안 질병의 원인 및 치료를 위한 표적 단백질이 명확하게 밝혀져 있음에도 현재까지의 기술 부족으로 치료제 개발에 실패했던 undruggable target 이였기에 이번 승인을 통해 앞으로 undruggable target 극복의 새로운 가능성에 대한 긍정적인 메시지도 동시에 전해주고 있다.
Sotorasib은 KRAS G12C 변이가 확인된 국소 진행형이나 전이성 비소세포폐암 환자 중에 적어도 1번 이상의 치료를 받은 경우, 사용될 수 있는 약물이다 [8]. 그 외에도 HER2 표적항체약물 접합체인 아스트라제네카와 다이치산쿄의 Trastuzumab deruxtecan (상품명: Enhertu, 적응증: HER2양성 재발성전이성 유방암 치료제)도 혁신치료제에 속한다. 이는 HER2 양성 절제불가능 또는 전이성 위 또는 위식도 접합부 선암 환자의 치료를 위한 약물로 2021년 승인을 받았다.
특히나 HER2 양성 위암은 전체 위암 환자 5명 중 1명 꼴로 발견되는 매우 발생률이 높은 병으로 이번 승인 덕분에 많은 환자들이 질병 극복을 할 수 있다는 긍정적인 희망을 갖게 되었다. 또한, 로슈의 항 TIGIT 계열 신약 후보물질인 Tiragolumab (면역조절제, 적응증: PD-L1 발현 조절을 통한 폐암 치료)도 임상 2상 시험에서 나온 데이터를 근거로 올해 혁신치료제로 지정 되었다 [9]. 그 외에도 항암제인 Lenvatinib (상품명: Lenvima, EGFR을 억제해 보다 강력한 항암 효과를 보임, 적응증: 특정 종류의 갑상선암 및 다양한 암 치료)과 Pembrolizumab (상품명: Keytruda, 면역항암제)의 병용요법이 간암 1차 치료를 위한 혁신 치료로 지정 되었으며 [10], 노바티스의 Bimagrumab (BYM338)도 근육 손실 치료제로 2013년, FDA로부터 승인을 받았다.
산발적 봉입체 근염은 치명적인 근육 손실 희귀 질환으로 환자들이 점점 걷는 기능을 잃게 되는 질병이다. Bimagrumab는 병을 일으키는 저해물질을 차단해서 근육 성장을 촉진 시키는 메커니즘을 가지고 있다 [11]. 그 외에도 2013년 FDA의 승인을 받은 Daratumumab (상품명: Darzalex) 이라는 항암제도 있는데 이는 다발성골수종 치료제로 임상시험에서 성공적인 결과를 보였다 [12].
1.1.2. 우선 심사 및 조기 승인
그 다음으로는 priority review (우선심사)가 있다. 이는 현재 사용되는 standard of care 보다 치료제가 매우 뚜렷한 가능성을 보일 때 적용될 수 있다. 10개월 정도 소요되는 일반 심사에 비해 매우 짧은 심사를 진행하는 우선심사는 6개월의 단축된 심사기간을 갖는다.
2021년 FDA의 우선 심사로 지정된 약물은 다케다의 Mobocertinib (TAK788, 적응증: 비소 세포성 폐암 치료, tyrosine kinase 억제제) 가 있다 [13]. 그 외에도 인사이트의 Retifanlimab 이라는 PD-1 억제제도 2021년 7월 FDA의 우선심사 예정에 있다 [14]. Accelerated approval 즉, ‘조기 승인’이라는 개념도 있는데 이는 마켓에 나오면 합리적인 이점이 있을 것이라 예측이 가능한 경우에 승인을 받을 수 있다.
또한 승인 후에도 추가적인 테스트를 진행할 수 있는데 즉, 해당 질병에 수요가 있고 약물의 임상 결과에 약간의 불확실성이 있지만, 질환에 잠재적 이점을 가져올 것이라 확실한 예측이 되는 경우에 이 심사를 통과할 수 있게 된다. 예를 들어 암 치료제 심사 방법에 대한 설명을 해보면, 보통 항암제를 통해 기대하는 효능은 환자들의 생존율 증가와 이환율 감소이지만, 환자들이 사망할 때까지 몇 년을 기다려야 정확한 결과를 얻을 수 있게 된다.
조기 승인은 이러한 심사 방법 대신, 암조직의 크기가 줄어드는 실험 결과를 바탕으로 실제 환자에게 후보 약물을 적용하면 사망률이 감소할 것이라고 예견을 해서 심사 결과를 내리는 것이다. 또 다른 예를 들어보면, 골다공증 치료제의 경우는 골밀도로 심사를 할 수 있으며, 심혈관질환 치료제는 혈중 LDL 농도를 이용하여 심사를 내릴 수 있다 [15].
최근 FDA에서 2003년 이후 18년 만에 치매 치료제 신약으로 조건부 승인을 받은 미국의 바이오젠과 일본의 에자이가 공동개발한 Aducanumab (상품명: Aduhelm)이 조기승인 카테고리에 속한다. FDA는 Aduhelm이 제공하는 치료 이점이 현재 질병이 갖는 위험적인 측면 보다 크다 판단하여 이러한 결과를 내렸다.
오랜 연구 기간에 비해 그럴 듯한 성과를 보여주지 못했던 치매 치료제 분야는 점점 많은 제약회사들이 연구를 중단하거나, 투자를 하지 않는 분야로 전락하면서 연구 지속에 대한 불안감이 있었지만, 이번 FDA의 승인 결과로 앞으로 더욱 활발한 연구 가능성을 열어 줄 수 있다는 희망의 목소리가 올라오고 있는 중이다. 하지만, 뚜렷한 임상 실험 결과가 없다는 등 아직까지는 부정적인 의견이 많기 때문에, 환자 개개인 증상의 심각한 정도에 따른 약물의 효능과 같은 여러 가지 ‘시판 후 조사’를 진행한 후 효과를 제대로 입증 할 수 있다면, 앞으로 많은 환자들에게 확실한 희망을 안겨줄 수 있을 것이라 생각된다 [16].
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보
지식
동향


 pdf_0003833.pdf
pdf_0003833.pdf