기술동향
산화적 스트레스와 고혈압
- 등록일2021-07-19
- 조회수7074
- 분류기술동향 > 레드바이오 > 의약기술
-
자료발간일
2021-07-15
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#산화적스트레스#고혈압
- 첨부파일
산화적 스트레스와 고혈압
◈목차
1. 서문
2. 고혈압 개요
3. 고혈압과 ROS의 관련성
4. 고혈압에서 ROS 생성의 1차 메커니즘
4.1. NOX 군(family)
4.2. 심혈관계에서 p22phox 의존적 NOXes (NOX1-4)
4.3. 심혈관계에서 P22phox 독립적 NOXes - NOX5의 중요성
4.4. 고혈압과 관련된 다양한 NOX 아형들
5. 고혈압에서 ROS 생성의 2차 공급원과 메커니즘
5.1. NOS 언커플링
5.1.1. eNOS 언커플링의 역전은 혈관보호 효과를 지닌다.
5.1.2. NOX:NOS 상호작용
5.2. 소포체, ROS 생성 그리고 산화적 스트레스
5.2.1. 고혈압에서 소포체 스트레스와 ROS 간의 상호작용
5.3. 미토콘드리아 기능장애 및 산화적 스트레스
5.3.1. 미토콘드리아 산화적 스트레스와 고혈압
5.3.2. 미토콘드리아 표적 항산화제
5.3.3. 미토콘드리아 기능장애, SIRT3 그리고 고혈압
6. 고혈압의 교란된 산화환원 균형에서 항산화 효소의 역할
6.1. 고혈압에서 항산화제
6.2. 간접적 항산화제와 Nrf2 작용제(argonists)-산화적 스트레스를 줄이는 새로운 접근법
7. 고혈압에서 산화스트레스의 분자적 기초
7.1. 고혈압에서 산화-환원 신호전달
7.1.1. 산화-환원 신호전달과 구획화(Compartmentalization)
7.1.2. 고혈압에서 산화-환원 신호전달과 inflammasome
7.2. 고혈압에서 티올(thiol) 단백질체(proteome)
8. 고혈압에서 산화적 스트레스와 장기(organ) 시스템
8.1. 혈관 시스템
8.2. 신장 시스템
8.3. 중추신경 시스템
8.4. 염증 시스템
9. 임상적 관점
10. 결론
◈요약문
산화적 스트레스와 고혈압 사이의 연관성은 여러 고혈압 동물 모델에서 확고하게 확립되었지만 사람에서는 여전히 알기 어렵다. 초창기 연구는 과산화물에 의한 산화 질소의 비활성화에 초점을 맞추었지만, 관련 활성산소종(과산화물, 과산화수소 및 과산화질산염) 및 이들이 고혈압을 촉진하는 복잡한 신호전달경로의 조절에 대해 점차 알려지게 되었다.
이 리뷰에서는 고혈압 발생 과정에서 활성산소종의 1차, 2차 공급원(NADPH oxidases, eNOS 짝 풀림(uncoupled), 소포체, 미토콘드리아), 산화-환원 신호에 중요한 단백질을 표적으로 일어나는 전사 후 산화적 변형, 내재적 항산화 시스템과의 상호작용, inflammasome 활성과 ER (소포체) 스트레스에 관여하는 역할 등에 대한 최근 정보를 요약하여 소개한다.
장기들의 서로 다른 시스템에서 산화적 스트레스가 고혈압에 어떻게 기여하는지 주목하고, 특정 단백질의 중요성을 명확히 한 새로운 동물 모델을 설명하며, 이러한 과정과 경로가 인간 고혈압과는 어떻게 다른 지에 대한 임상 연구를 논의하였다. 마지막으로, ROS와 고혈압 사이의 관계를 완전히 이해할 수 있도록 산화 환원 단백질체학 및 시스템 생물학에 초점을 맞췄고, 이러한 학문이 새로운 항고혈압 요법을 설계하고 평가할 수 있는지 고찰하였다.
키워드: 항산화제, 바이오마커, 활성산소종
분야: Cell_Biology, Molecular_Biology, Pathology
◈본문
1. 서문
심장, 혈관, 신장, 뇌, 면역세포 등을 포함하는 다양한 조절 시스템은 고혈압의 병태생리를 뒷받침하며, 산화적 스트레스가 이러한 요소들을 연결하는 단일 인자로써 여겨져 왔다. 질병에 대한 산화적 스트레스 이론은 자유 라디칼과 비자유 라디칼을 포함하는 ROS (활성산소종)의 생체 이용률이 증가하면 RNA, DNA, 단백질, 지질 및 탄수화물과 같은 세포 거대 분자에 악영향을 미쳐, 세포의 손상과 사멸을 유발한다는 사실에 기반한다.
방어 기전으로써 항산화 시스템(SOD(superoxide dismutase), peroxidases, 항산화제, 비타민)의 진화를 통해, ROS 축적을 저해하여 산화-환원 상태를 유지한다. 산화적 스트레스는 본래 자유라디칼은 해로운 종이라는 개념과 함께 산화제:항산화제의 균형을 무너뜨리고 산화촉진제를 증가시키는 방해인자로서 정의되었다.
그러나, 1980년대에 (1) ROS는 숙주 방어반응에 중요한 역할을 하며, (2) 내피세포 유래 NO (nitric oxide)는 EDRF (endothelium-derived relaxing factor) 로써 혈관 이완을 조절하며, (3) ROS 생성은 전문화된 산화효소인(nicotinamide adenine dinucleotide phosphate [NADPH] oxidases [NOXes])에 의해 조절된다는 것, 그리고 최근 ROS의 수준은 호르몬과 기타 인자들에 의해 영향을 받는다는 것 등의 사실이 밝혀지면서, 세포 내 ROS는 다양한 인자에 의해 정밀하게 조절되어, 세포 신호전달, 항상성 유지, 기타 생물학적 기능에 사용된다는 사실이 명확히 알려졌다.
이제는 산화적 스트레스에 대해 산화-환원 신호전달과 (산화제에 유리한 산화제:항산화제 불균형으로 정의되었던) 산화적 스트레스가 통합되는 개념으로 재정의되었고, 이 균형이 무너지면, 신호전달 조절과정 및 분자적 손상이 유발된다.
2. 고혈압 개요
고혈압과 관련된 산화적 스트레스의 중요성은 내피 손상, 혈관 손상, 심혈관계 리모델링, 신장 손상, 교감신경계 자극, 면역세포 활성화, 전신염증 등을 유발하는 분자, 세포, 시스템적 과정에서의 ROS와 산화-환원 신호전달의 기본적인 역할이 연관되어 있으므로, 고혈압의 병태생리학에 있어서 중요하다. 산화 환원 신호는 O2- (과산화물 음이온) 및 NO와 같은 자유 라디칼과 H2O2 (과산화수소)와 같은 비 자유 라디칼에 의해 유도된 하위 신호전달 분자의 특정 산화-환원 번역 후 변형(posttranslational modification)이다.
단백질의 Ox-PTM (Oxidative posttranslational modification, 산화적 번역 후 변형)은 세포생물학적 반응에 절대적인 영향을 주는 단백질을 조절하는 중요한 분자적 메커니즘이다. 일반적으로 단백질은 가역적 Ox-PTM의 표적이며, 고혈압과 같은 산화적 스트레스와 관련된 병리학적 상태에서 단백질은 비가역적 Ox-PTM을 겪어 단백질 기능의 상실과 그에 따른 세포 손상, 조직 손상 및 표적 장기 부전을 유발한다.
산화 단백질체학의 발전은 세포 증식, 염증, 수축/이완, 세포 골격 조직 및 세포 사멸과 관련된 단백질의 시스테인 산화에 초점을 맞춘 최근 연구를 통해 심혈관 병리 생리학에서 산화 환원 생물학의 역할에 대한 새로운 시야를 제시했다. 심혈관 ROS의 효소 차원에서 주요 공급원은 고혈압에서 다양하게 상향 조절되는 비 대식세포성 NOXes이다.
새로운 연구들이 NOX의 과도한 활성화 외에도 NOS (NO 합성효소) 분리, ER (소포체) 스트레스 및 미토콘드리아 산화적 스트레스가 고혈압의 산화 환원 변화에 기여한다는 것을 나타냈다. 이러한 과정은 그 자체로 산화 환원에 민감하며, 고혈압에서 산화적 스트레스와 관련된 2차 메커니즘으로 생각할 수 있다. eNOS (내피 NOS)의 활성화는 일반적으로 NO를 생성하지만, 산화 환경에서는 NOS가 짝 풀림(uncoupled)되어, 혈관 보호성 NO 대신 혈관 손상성 O2-를 생성한다.
ER 스트레스와 미접힘 단백질 반응(unfolded protein response, UPR)은 잘못 접힌 단백질의 축적으로 발생한다. 이러한 과정은 세포 항상성, 세포 내 신호 전달 및 세포 형태에 악영향을 미쳐 조직 손상을 유발한다. ER 스트레스는 혈관 세포 표현형 전환, 역분화, 석회화 및 세포 사멸에 한 축을 담당하기 때문에 심혈관 질환의 새로운 조절자로 제시되며, 고혈압과 동맥경화에서 내피 기능장애 및 혈관 재형성에 기여한다. ROS로 조절되는 ER 스트레스는 고혈압 관련 심혈관 기능 장애 및 표적 장기 손상에서 중요한 과정이 될 수 있다.
이러한 사실은 ER 스트레스의 억제가 고혈압에 의한 혈관 기능 장애로부터 보호하고, 자발적 고혈압 쥐(spontaneously hypertensive rats, SHR)에서 고혈압의 발달을 둔화시키고, 고혈압 및 폐동맥 고혈압의 실험 모델에서 심장 손상 및 비대증을 예방하며, 증가된 Ang II (안지오텐신 II)와 교감신경적 박출의 기저 역할을 한다는 연구에 의해 뒷받침되었다.
미토콘드리아 산화적 스트레스는 미토콘드리아 기능장애 및 미토콘트리아 deacetylase인 SIRT3 (sirtuin 3)(silent mating type information regulation 2 homolog 3)의 산화-환원 비활성화와 연관되어 있으며, 핵심 미토콘리아 항산화효소인 SOD2 또한, 고혈압 발생에 기여하는 것으로 보인다. 자체적으로 산화적 스트레스를 유발하는 이러한 과정은 실험 모델에서 혈관 기능 장애, 심장 섬유증 및 혈압 상승을 촉진한다.
임상 연구에서는 Sirt3가 본태성 고혈압 환자에서 하향 조절되기 때문에 미토콘드리아 산화적 스트레스의 잠재적 역할을 뒷받침한다. 이러한 발견은 혈관 보호 및 항고혈압 전략으로써, 미토콘드리아 표적 중재술을 개발하는 데 관심을 불러 일으켰다. 특히, 미토콘드리아 지질 과산화 생성물(isolevuglandins)의 소거는 Ang II 주입 마우스에서 고혈압 발생을 지연시켰고, 미토콘드리아 표적 SOD 모방체인 mitoQ는 고혈압 모델에서 내피 기능장애를 개선하고, ROS 생성을 억제하며, 혈압을 감소시켰다. 이와 유사하게 미토콘드리아 항산화제인 MitoQ를 처방받은 사람에서도 유익한 혈관 반응이 나타났다.
실험 모델에 대한 광범위한 전임상 연구는 산화 환원 신호 전달이 심혈관 병태 생리학에 결정적으로 관여하고, 산화적 스트레스가 고혈압 발병과 인과 관계가 있음을 분명히 보여주었다. 그러나, 혈압 상승에서 ROS가 차지하는 기본적인 역할에 대해 입증하는 것이 어려웠기에 임상 연구로 이어지지는 않았다. 이는 인간 조직에서 ROS 생물학에 대한 정보 부족, 임상 환경에서 최적화되지 않은 ROS 측정법, 부적절하게 설계된 임상 시험법 등과 부분적으로 연관되었을 것이다.
그럼에도 불구하고, 많은 임상 연구에서 산화적 스트레스와 혈압의 전신 바이오 마커 사이에 긍정적인 연관성이 입증되었으며, 고혈압에서 항산화 능력이 감소하는 것으로 나타났다.
3. 고혈압과 ROS의 관련성
ROS는 호흡 과정에서 대사 부산물로 생성되지만, 또한, NOXes에 의해 촉진되는 것과 같은 효소 반응에 의해 생성되기도 한다. ROS는 과거 생리적 기능조절을 위한 신호전달 물질로 잘 알려졌지만, 세포 특정 소기관 및 조직에서 과도한 ROS가 생성되거나, 항산화 방어 실패는 단백질, 지질, DNA 손상뿐만 아니라, 병리학적 신호전달을 유발하게 된다.
4. 고혈압에서 ROS 생성의 1차 메커니즘
심혈관계에서 가장 중요한 O2-, H2O2의 효소적 공급원의 하나는 막을 투과해 전자를 전달하는 막 횡단 단백질(transmembrane protein)의 한 계열인 NOX이다 (그림 1). NOXes는 NADPH 의존적 방법으로 O2를 O2-로 환원시키며, 이는 다시 H2O2로 전환된다(자연반응 또는 SOD에 의한 촉매반응). 이러한 반응들은 O2-와 NO의 반응으로 ONOO-를 생성하는 반응, OH-를 생성하기 위한 철 촉매 펜톤(Fenton) 반응, 과산화효소로 촉매되는 차아염소산(hypochlorous acid)의 생성과 같은 2차 ROS 생성을 유발한다. 따라서, NOX는 두 가지 기능을 가질 수 있는데, 주요 역할은 ROS를 생성하는 전자전달의 중계이고 두 번째로 막을 통한 양성자의 생성 및 수송이다.
NOXes가 고혈압의 핵심 요소라는 개념은 약 40년 전에 항고혈압제가 코엔자임 Q10-NOX를 통해 효과를 매개하고 f-Met-Leu-Phe에 의해 자극된 NADPH 의존성 O2- 생산이 정상 환자에 비해 호중구 수가 4배 정도 높은 본태성 고혈압 환자의 호중구에서 나타난다는 임상연구에서 처음 제안되었다.
이러한 임상관찰을 실험 모델에서 테스트하였고, 1990년대에 NADH/NOX에 의해 생성된 ROS의 주요 역할이 Ang II 의존성 고혈압에서 입증되었다. 그 이후로, 일반적으로 연구되는 모든 고혈압 모델에서 NOX 유래 ROS가 혈압 상승에 관여한다는 것이 분명하게 입증되었다. 그러나, 사람의 고혈압에서 NOX/ROS의 인과적인 역할을 보여주는 것은 더 어려웠다.
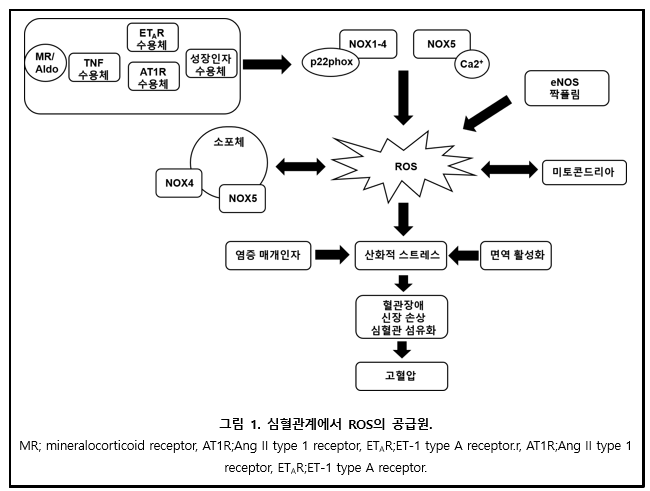
4.1. NOX 군(family)
NOX 군은 7개의 아형(isoform)으로 구성되어 있다: NOX1-5, duox1 (dual oxidase 1)/duox2 가 이에 속하며, 각 아형은 촉매 코어(전자 전달요소), 막 투과 도메인, NOX 서브유닛(p22phox, p47hox/NOXA1 (NOX-activator 1), p67phox/NOXO1 (NOX organizer 1), p40phox)를 포함하고 있다. NOX1-4는 활성에 p22phox와 기타 다른 서브유닛을 필요로 하지만, NOX5 활성은 p22phox나 NOX 서브유닛과는 독립적이다.
모든 NOXes는 heme 결합 부위가 있는 6개의 보존된 막투과 알파 나선과 C-말단에 FAD 및 NADPH에 대한 결합 부위를 포함하는 flavoprotein 상동 도메인을 가지고 있다. NOX1, NOX2, NOX4, NOX5는 심장, 혈관, 신장, 뇌에서 발현되며 심혈관 및 뇌혈관 병태생리에 중요한 역할을 하며 고혈압에서 산화적 스트레스와 연관되어 있다.
4.2. 심혈관계에서 p22phox 의존적 NOXes (NOX1-4)
NOX1은 처음 발견된 NOX 동형체이며, 세포 증식과 분열에 관여하는 역할 때문에 mitogenic oxidase로써 ‘Mox1’으로 불렸다. 완전한 활성을 위해서는 p22phox뿐만 아니라, NOXO1 (p67의 이형), NOXA1(p47phox 이형), Rac1이 필요하다. 이는 심혈관계의 염증 및 섬유화에 중요한 조절자이고, NOX1과 NOX1/4의 저해자로서 고혈압에서 심혈관계 재형성을 저해한다.
NOX2는 호중구(neutrophil)와 대식세포에서 주로 발현되나 심장, 혈관, 신장, 뇌의 세포에서도 발현된다. 활성화된 NOX2는 막에 결합된 p22phox, 세포질에 p47phox, p67phox, p40phox 및 G-단백질 Rac1/2와 결합한다. 식세포에서 NOX2는 과량의 O2-를 생산하여 숙주 방어반응을 일으키며, 혈관이나 비섭식세포에서는 지속적으로 조절되어 낮은 수준으로 생산한다.
NOX3는 거의 내이에서만 발현되며, 심혈관계에 기능적으로 존재한다는 확실한 증거는 거의 없다. 그러나, 몇 가지 연구에서 NOX3가 내피 및 심장 세포에서 발현된다는 사실이 입증되었다.
NOX4는 p22phox에 연결된 이종이량체(heterodimer)로 존재하며, 활성화를 위해 세포질 서브유닛이 필요하지 않다. 다른 NOX와 달리 NOX4는 상시 활성화되어 O2-및 H2O2를 생성한다. NOX4 활성은 양, 세포 내 위치, 세포 내 구획화, 조절단백질인 poldip2 (polymerase delta–interacting protein 2)와 Tks5 (tyrosine kinase substrate 5) 와의 결합 등에 직접적으로 연관되어 있다. NOX4는 세포 이동에 중요하게 연관되어 있으며, 혈관 이완 등에도 영향을 주어, 심장 보호성 효과를 주기도 한다.
4.3. 심혈관계에서 P22phox 독립적 NOXes - NOX5의 중요성
NOX5는 NOX2와 50%의 유사성을 가지며 활성화에 p22phox 또는 세포질 NOX 서브유닛 등이 필요하지 않다. Duox1/2 또한 p22phox에 독립적인 아형이며 갑상선 호르몬 합성에 포함된다. Duox1/2는 제브라피쉬 심장에서 H2O2 생성을 중개함에도 불구하고, 심혈관계 병태생리적 중요성은 나타내지 않았다.
NOX5는 가장 최근에 규명된 NOX로, 유일하게 결정화가 된다. NOX5는 다음과 같이 구분된 특징을 가지고 있다: (1) 설치류 유전체에는 NOX5가 없으나 하등 생물과 포유류에는 존재하며, (2) NOX5는 단일 유전자 산물에서 O2-를 생성하며, (3) Ca2+ 결합하는 나선-루프-나선 구조의 도메인을 가진 고유한 N-말단을 가지며, (4) NOX5 활성은 세포 내 자유 Ca2+ 농도에 의해 조절되며 구조적 변화를 일으키며, (5) NOX5는 인산화, 산화, S-nitrosylation, SUMOylation과 같은 번역 후 변형에 의해 조절되며, 다른 NOXes와 달리 glycosylation 되지 않는다.
NOX5의 여섯 아형은 NOX5-α,-β, -γ, -δ, -ε, -ζ으로 규명되었다. NOX5α, NOX5β, NOX5γ는 기능적으로 활성화되고 ROS를 생산한다. NOX5-ε이 NOX5에 의한 O2- 생성을 억제하는데, 사람 세포에서 주요 아형인 NOX5 α, β 역시, 이에 의해 음성적으로 조절된다. NOX5-δ, -ε, -ζ은 충분한 양의 ROS를 생산하지 않으며, 기능적인 특이성도 잘 알려지지 않았다.
NOX5의 활성에는 N-말단에 EF hand에 Ca2+의 결합도 필요하다. NOX5의 활성에 필요한 Ca2+의 농도는 높으며, Ca2+에 대한 민감도를 증가시키는 추가적인 조절 단백질이 포함되며, 낮은 Ca2+ 농도에서도 ROS 생성을 촉진시키도록 진화되었다.
NOX5 조절 단백질에는 protein kinase C (PKC), calmodulin, caveolin-1, c-Abl1, c-Src, Hsp90, Hsp70 등이 포함된다. 이러한 단백질들은 서로 다르게 NOX5에 영향을 주며 효소 안정화에 관여할 것으로 추정된다. 염증성 전사인자인 NF-kB, AP-1, STAT1/STAT3 등도 사람의 동맥 평활근세포에서 NOX5를 조절한다고 보고된 바 있다.
NOX1-4는 주로 세포막에 결합된 반면, NOX5는 세포 내 핵 주변부와 ER에 분포하고 있다. 이는 ER이 Ca2+가 풍부하고, 단백질 합성 및 번역 후 변형이 이루어지는 장소인 만큼 기능적인 연관성을 가지고 있다. 세포 내에서 NOX5는 세포 내 구획에서 세포막으로 이동하며, 활성화 및 다운 스트림 신호에 영향을 미치는 PKC 및 c-Src와 같은 조절 단백질에 접근한다.
NOX5는 사람 장기에서 흔히 발현되며 심혈관계 관련 세포에서 주로 ROS 생성 효소로 작용한다.
혈관계에서 우리는 산화-환원에 민감한 혈관 수축에서 Ca2+에 의해 조절된 NOX5가 Ca2+농도를 증가 시켜 수축을 유발한다는 NOX5의 핵심 역할을 규명하였다. 내피세포에서는 NOX5의 증가된 활성은 동맥경화와 혈관신생 등에 중요한 과정인 세포 증식과 미세소관 유사구조 형성을 증가시킨다. 심장에서는 NOX5가 관상동맥 수축에 관여하는 Ca2+ 활성 의존성 K+ 채널의 조절에 중요한 역할을 한다고 알려졌다.
4.4. 고혈압과 관련된 다양한 NOX 아형들
NOX 유래 ROS가 고혈압 발병에 기여하는 역할은 주로 NOX 아형 및 NOX 서브유닛 유전자의 소거 또는 과발현 마우스 모델에서 연구되었다. NOX1 결핍 마우스는 혈관 O2- 생성이 감소하고 압력 감지반응이 무뎌졌지만, NOX1 과발현 쥐에서는 AngII에 의한 혈관 비대증과 혈압상승이 과도하게 나타났다. 섬유아세포 NOX2는 주변 분비를 통해 혈관 재형성과 고혈압에 영향을 준다고 보고되었다.
NOX2의 과발현 또는 제거는 심혈관계 증상이 정상으로 나타났으나, AngII 또는 염분 등의 유발물질이 존재할 때에만 혈관 및 혈압에 변화를 나타내었다. NOX3는 심혈관계에서 일상적으로 발현되지 않기 때문에 고혈압과의 연관성은 잘 연구되지 않았으나, 뇌 산화스트레스와 NOX3 상향조절 간에 연관성이 보고되었다.
뇌졸중 모델에서 NOX3와 ROS 생성이 증가하였고, 신장손상성 고혈압 모델에서 산화적 스트레스성 교감신경 활성과 NOX3 발현증가의 연관성이 알려졌다. 사람의 폐동맥고혈압 대상으로 한 광범위한 유전자 발현 연구에서는 NOX3가 미래의 고혈압 예측인자로써 역할이 규명되었다. NOX4는 염분 민감성 고혈압에 특히 중요한 것으로 보인다. 다양한 염분 투여모델에서 신장의 손상 및 산화스트레스, 과도한 혈관수축, 혈압증가가 관찰되었으며, 여기에는 NOX4 유래 H2O2가 mTORC (mammalian target of rapamycin complex 1)의 상위 조절자로 작용하여, 신장 손상 및 고혈압을 유발하였다.
NOX1, NOX2, NOX4를 억제하는 고혈압 약인 apocynin, diphenylene iodinium, gp91ds-tat, GKT137831 등을 고혈압 마우스에 투약했을 때, 혈관 기능이 개선되고, 혈압이 정상화되었으며, 심장 재형성이 개선되었음을 통해 NOX 활성, 산화스트레스, 고혈압 간의 연관성이 깊음을 알 수 있다.
설치류에는 NOX5가 결핍되어 있으므로, 일반적인 마우스나 랫드에서 연구가 어렵기 때문에 NOX5 유전자 삽입 마우스가 제작되었다. Podocyte 특이적 발현 마우스는 podocyte 기능장애, 단백뇨증, 고혈압을 보이며, 이 쥐에 streptozotocin으로 당뇨를 유발하면 이러한 증상은 더욱 악화된다. NOX5 유발성 신장 염증은 사이토카인 발현을 증가시키고 TLRs (Toll-like receptors)를 상향조절하며, 양성 피드백 작용으로, 다시 NOX5에 의한 ROS 생성을 촉진하고, 산화스트레스와 신장 손상을 일으킨다.
NOX5를 혈관평활근세포에 특이적으로 발현시킨 쥐에서는 신장 산화스트레스, 사구체 경화증, 간막 확장, 신장 염증, 섬유화 등이 유발되었다. 내피세포에 NOX5를 발현시킨 쥐에 산소 유발성 망막병증을 유발한 쥐는 망막 혈관 투과성, 신생혈관, 염증 인자 등이 증가하였다. 어린 쥐에서는 혈압에 영향이 없었으나, 나이가 증가할수록 혈압이 증가하였다.
고혈압의 결과이자 심부전의 원인인 심비대증 또한 NOX5의 상향조절과 연관되어 있다. 심장 특이적 NOX5 발현쥐는 박출과부하 또는 AngII에 의해 좌심실 비대증, 간질성 섬유증, 수축 기능장애가 나타났다. 이러한 효과는 산화스트레스와 산화-환원 의존성 MAPK (mitogen-activated protein kinase)의 활성, 전수축성 Ca2+ 신호전달 등과 연관되어 있다.
5. 고혈압에서 ROS 생성의 2차 공급원과 메커니즘
심혈관계에서 NOXes가 ROS의 주요 공급원이며, 고혈압에서 산화스트레스의 중요한 조절자임은 잘 알려졌다. 그러나, 뒤따른 연구들에 따르면, 2차 공급원인 NOS uncoupling, ER 스트레스, 미토콘드리아 기능장애 역시 NOX에 의한 ROS에 영향을 받고, NOX 조절 및 산화-환원 신호전달에 영향을 주기 때문에 그 중요성이 점차 밝혀지고 있다.
5.1. NOS 언커플링
NO는 핵심 내피 유래 이완인자(endothelium-derived relaxing factor, EDRF)로서, protein kinase A의 인산화와 soluble guanyl cyclase에 의한 cyclic guanosine monophosphate의 활성화를 통한 혈관 효과를 중재한다. 또한, NO는 S-nitrosylation을 통해 단백질 구조와 기능을 변형시켜서, cyclic guanosine monophosphate에 독립적인 경로로 신호를 전달하기도 한다.
NO의 생성은 세 가지 아형을 가진 NOS (eNOS, nNOS, iNOS)의 활성에 의해 조절된다. 심혈관계에서 eNOS와 nNOS는 Ca2+/calmodulin 의존성 방법으로 상시 활성화되어있는 반면에 iNOS는 Ca2+와는 독립적으로 스트레스에 의해 활성화된다. 다양한 보조인자가 존재하는 생리적인 조건에서 NADPH, BH4 (tetrahydrobiopterin), NOS는 L-arginine을 L-citruline+NO로 전환을 촉진한다.
그러나, 산화적 스트레스 조건에서 NOS는 NADPH로부터 전자 하나를 O2로 전달하여, NO보다는 O2-를 생성한다. 이러한 과정을 “NOS 언커플링”이라고 하며, S-glutathionylation과 eNOS 인산화, BH4 산화를 포함한다.
NOS 언커플링의 중요한 개시자는 ROS 중개 과정들을 통한 BH4 소진이다. 과산화물은 BH4를 직접 산화시켜 BH2로 만들고, NOS를 불안정화시켜 언커플링을 유발한다. 모든 NOS 아형들은 BH4에 의해 조절되므로 스트레스 조건 하에서 모든 NOS는 언커플링 될 수 있다.
BH4 수준을 변경하면, NOS에서 유래된 NO 생성이 교란될 뿐만 아니라, S-니트로 화에 의한 번역 후 변형, 특히, 유비퀴틴-프로테아좀 시스템의 단백질들에도 영향을 준다. 그러므로, BH4와 eNOS는 다양한 하위 경로에 영향을 주는 신호 교차점의 역할을 한다.
NOS 언커플링을 촉진하는 가장 중요한 요소는 산화적 스트레스로, NO 생성을 감소시키고, O2- 생성을 증가시키며, 불안정하고 반응성이 큰 ONOO를 형성하여 BH4 산화와 prostacyclin synthase의 nitration을 유도한다.
NOS- 매개 산화적 스트레스가 NOS 언커플링을 통해 산화적 스트레스를 일으키는 이 시스템은 SHR, 뇌졸중에 취약한 SHR, Ang II 유발 고혈압 및 DOCA-염 랫드와 고혈압 환자에서 확인되었다. 그러나, BH4 전구체인 sepiapterin이 glucocorticoid에 의한 고혈압에서 혈압 강하 효과가 없었기 때문에 모든 고혈압 모델이 eNOS 언커플링을 포함하진 않는다.
5.1.1. eNOS 언커플링의 역전은 혈관보호 효과를 지닌다.
BH4 수준을 증가 시켜 NOS 활성을 정상화시키고 eNOS 전사를 강화시키는 물질인 AVE94884 (fluoro-N-indan-2-yl-benzamide)와 AVE3085 (2,2-difluorobenzo[1,3] dioxole-5-carboxylic acid indan-2-ylamide)은 심혈관계 질환의 잠재적 치료제로 제시되었다. BH4 치료는 설치류 고혈압과 당뇨 모델에서 내피 기능을 정상화시켰고, 고혈압과 동맥경화 환자에서도 내피 기능을 개선시켰다.
이렇게 BH4는 NOS 언커플링을 억제하여, 보호 효과를 나타낸다는 다수의 연구 결과가 보고되었다. 그러나, 모든 연구에서 BH4가 보호성 효과를 나타낸 것은 아니다. 관상동맥질환과 내피 기능장애를 가진 환자에서 BH4를 구강으로 투여했을 때, 혈관의 산화-환원 상태의 개선이나 내피 기능에 영향을 주지 못했고, 일부 고혈압 환자에서 혈압 강하에 실패한 경우도 존재한다.
5.1.2. NOX:NOS 상호작용
eNOS 언커플링은 심혈관계질환의 중요한 O2-의 공급원이나, 2차 메커니즘인 이유는 이 과정이 고혈압에서 주로 NOX 활성에 의한 산화스트레스에 의해 개시되기 때문이다. 다른 NOXes와 달리 p47phox와 NOXO1 의존적인 NOX1의 활성은 당뇨에서 혈관 eNOS의 언커플링을 매개하며, NOX1의 하향조절에 의해 효과가 개선되었다. 이와 비슷한 관계는 NOX1 과발현 쥐의 혈관평활근세포에서 손상된 내피 의존성 이완작용이 산화스트레스와 eNOS 언커플링의 결과로 나타났다는 연구에서도 보인다. 대동맥류에서는 NOX4 상향조절은 NOS 언커플링과 연관되어 있었다.
5.2. 소포체, ROS 생성 그리고 산화적 스트레스
소포체는 심혈관계에서 산화-환원 병태생리에 점차 중요하게 여겨지고 있다. (1) 소포체 효소인 Ero1 (ER oxidoreductin)과 그 파트너인 PDI (protein disulfide isomerase)는 ROS 생성에 관여하며, (2) 소포체는 p22phox와 NOX의 합성, 성숙, 번역 후 변형이 일어나는 장소이며, (3) NOX는 소포체의 샤페론인 PDI와 작용하여 NOX 활성을 증가시키며, (4) NOX4와 같은 몇몇 NOXes는 소포체에서 활성화되며, (5) 소포체는 미토콘드리아와 결합된 막에서 Ca2+와 ROS를 교환하고 (Ca2+에 민감한 NOX5에 중요함), (6) 소포체는 산화-환원 단백질의 접힘과 스트레스 반응에 중요하다.
소포체에서 단백질 접힘은 산화-환원에 민감한 과정에 의해 강하게 조절되는데, 스트레스 조건에서 소포체로 유입되는 미접힘 단백질이 증가하면 “UPR”이라 부르는 스트레스 신호전달경로가 활성화된다. UPR이 활성화되면 단백질의 축적 및 잘못 접힘이 유발되어 고혈압이나 심혈관계 재형성을 일으킬 수 있는 세포 사멸, 표현형 전환, 역 분화 및 전환 분화가 일어난다. 산화스트레스는 소포체 스트레스 신호전달 분자에 산화를 일으켜 직접적으로 UPR을 유발할 수 있다.
5.2.1. 고혈압에서 소포체 스트레스와 ROS 간의 상호작용
소포체 스트레스, UPR, 산화적 스트레스간의 상호작용은 고혈압의 병태생리에 영향을 주며, 표적 기관 손상에 연관되어 있다. Ang II 유발성 고혈압에서 UPR 단백질, BiP (binding immunoglobulin protein), CHOP (CCAAT-enhancer-binding protein homologous protein)이 대동맥, 장간막 동맥, 심장 및 뇌의 외막하기관에서 상향조절 되었다.
Ang II 고혈압 및 SHR 모델에서 소포체 스트레스 저해재인 4-phenylbutyric acid와 taurine-conjugated ursodeoxycholic acid의 투약은 혈압, 심혈관 UPR 활성을 낮추고 내피 기능을 회복시켰다. 소포체 스트레스는 심혈관계 손상 및 표적기관 손상에서 고혈압과 당뇨에 복합 효과를 가진 공통 인자로 제안되었다. 사람의 고혈압에서도 소포체 스트레스의 마커들과 ATF5, IRE-1, PERK와 같은 유전자 발현이 증가되었다.
5.3. 미토콘드리아 기능장애 및 산화적 스트레스
미토콘드리아는 주로 tricarboxylic acid cycle (TCA) 및 전자전달계를 통해 ATP를 합성하는 다기능 소기관이다. 일반적으로, 이 과정은 전자 유출이 최소화된 효율적인 과정이다. 그러나, 병리적 상태에서 미토콘드리아의 기능이 손상되어 전자 유출이 증가하면 O2- 생성이 증가한다. SOD는 O2-를 H2O2로 전환시키지만, 두 물질이 확산이나 채널 및 포어 단백질을 통해 세포질로 이동할 수 있다.
5.3.1. 미토콘드리아 산화적 스트레스와 고혈압
일반적인 조건에서 미토콘드리아의 O2-/ H2O2가 세포의 ROS 상태에 미치는 영향을 거의 없으나, 고혈압과 같은 병리학적 조건인 경우, 미토콘드리아의 손상은 세포 내 산화스트레스에 영향을 주고 그 자체로 미토콘드리아의 장애를 증가시킬 수도 있다. 고혈압에서 세포질의 NOX 유래 ROS는 미토콘드리아 막을 거쳐 전자 유출 및 산화적 스트레스를 증가시킨다.
이러한 과정이 L-NAME에 의해 Ang II에 의한 미토콘드리아의 O2- 생성을 억제했기 때문에 NO가 이 과정에 포함된다는 것이 알려졌다. 이를 통해, NOX와 미토콘드리아 간의 상호작용이 고혈압의 전체 산화적 스트레스에 기여한다는 것과 NOX2가 미토콘드리아에서 특히 중요하다는 것이 밝혀졌다.
5.3.2. 미토콘드리아 표적 항산화제
미토콘드리아를 표적으로 하는 항산화제들은 실험적 고혈압 모델에서 미토콘드리아 기능장애를 개선시키고 혈압을 감소시켰다. Cyclophilin D의 억제제는 Ang II에 의한 고혈압을 방지하였다. MitoQ는 고혈압 연관성 표적 기관 손상을 지연시키고 혈압을 감소시켰다. 임상연구에서 MitoQ는 노인에게 6주간 투약 후 내피 기능을 개선시켰고, 혈중 산화적 스트레스 마커를 감소시켰다.
5.3.3. 미토콘드리아 기능장애, SIRT3 그리고 고혈압
미토콘드리아에서 주목받고 있는 또 다른 시스템은 SIRT3로, cyclophilin D와 미토콘드리아 항산화제인 SOD2를 활성화시키는 미토콘드리아 deacetylase이다. SIRT3의 항산화 기능은 주로 아세틸기의 제거 기능과 SOD2의 활성화를 통해 나타난다. 고혈압에서 혈관 SIRT3 수준이 감소하고 SOD2가 아세틸화되면, 미토콘드리아에 O2- 축적 및 산화-환원 민감성 혈관 장애가 나타난다.
SIRT3 넉아웃 쥐에서 Ang II와 DOCA로 고혈압을 유발하면, 혈관 산화스트레스, 내피 기능장애, 혈압증가 등이 더욱 악화되며, 여기에 SIRT3를 과발현시키면 증상이 개선되었다. 핵 내에 있는 다른 SIRT 아형인 SIRT1과 SIRT6가 발현과 활성이 감소하면 심혈관계 질환과 고혈압에 악영향을 줄 수 있다. 이러한 연구들로, SIRT들이 상향조절되는 것은 조직 섬유화, 고혈압, 조직손상 등을 방지할 수 있는 새로운 전략이 될 수 있을 것으로 보인다.
6. 고혈압의 교란된 산화환원 균형에서 항산화 효소의 역할
심혈관계 병태생리에서 산화-환원 항상성은 SOD, glutathione peroxidase, catalase, thioredoxin-peroxiredoxin 등의 항산화효소와 비효소성 항산화제 등에 의해 정밀하게 조절된다. 항산화 효소의 발현 및 활성이 감소하거나, 혈중 비타민 A/C/E 등의 감소 등의 항산화 시스템의 변형은 실험적 고혈압 모델에서 지속적으로 관찰된다.
실험적 고혈압 모델에 외부에서 SOD를 주입하게 되면 내피 기능, 심혈관 재형성, 산화스트레스 등이 감소하고 혈압도 감소한다. 그러나, 정상 동물에 SOD를 넉아웃 하거나, 과발현 시키는 것은 혈압에 영향을 주지 못하는 것으로 보아 항산화제의 긍정적 효과는 산화스트레스와 고혈압 조건에서 나타나는 것으로 여겨진다.
고혈압에서 항산화 효소들의 기능장애를 일으키는 공통 요인은 Nrf2이다. 아질산염 치료는 Nrf2를 상향조절하여 산화스트레스, 혈관 기능, 혈압 등을 개선하였고, 항산화 효소들의 활성도 개선하였다.
임상 연구에서도 고혈압에서 비정상적인 항산화제 상태가 관찰되었다. 혈중 비타민C와 혈압은 역상관관계가 있었고, alpha carotene, beta carotene, beta cryptoxanthin, lycopene, lutein 등을 섭취했을 때, 고혈압 위험이 감소하였다고 보고되었다.
6.1. 고혈압에서 항산화제
실험적 고혈압 모델에서의 연구들은 꾸준히 항산화제, 비타민, SOD 모방체, resveratrol 등에 의해 산화적 스트레스와 혈압이 감소한다고 보고하였다. 그러나, 이러한 연구들이 임상에서 재현되지 않았다. 일부 소규모 연구를 제외하고, GISSI (Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico)와 HOPE (The Heart Outcomes Prevention Evaluation Study)와 같은 대규모 항산화제 임상 연구 대부분 실패했다. 이유는 다양하다. 이러한 우려를 해결하기 위해 MitoQ 또는 단백질 산화 등에 직접 영향을 주는 항산화제 등 구획 특이적 제제를 사용하는 방법이 제시되었다.
6.2. 간접적 항산화제와 Nrf2 작용제(argonists)-산화적 스트레스를 줄이는 새로운 접근법
임상적으로 연구된 대부분의 항산화제 치료는 1 또는 2개의 전자를 전달함으로써, 직접적으로 작용한다. 새로 제안된 방법은 제제가 항산화제의 기능이 없이 내제된 항산화 반응을 증가시키는 간접적인 작용을 하는 것이다. 간접적인 항산화제로는 폴리페놀인 resveratrol과 Nrf2 작용제와 같은 것들이 있다.
고혈압 환자에게 resveratrol을 투약한 연구는 혈압 강하 효과는 없었지만, 혈관 기능을 개선시켰다. Resveratrol을 기존의 항고혈압제와 같이 사용할 때 더 큰 혈압 강화효과를 가졌다. 이러한 연구에 힘입어 resveratrol의 대규모 임상이 진행 중이며, Nrf2 활성제인 bardoxolone methyl과 sulforaphane 역시 간접적인 항산화제로서 항산화 및 세포 보호성 유전자의 발현을 촉진시킨다.
7. 고혈압에서 산화스트레스의 분자적 기초
ROS가 고혈압에 영향을 미치는 분자적 메커니즘은 단백질의 구조 및 기능에 영향을 주는 것에서부터 시작한다. ROS는 세포 내 다양한 인자들, 전사인자부터 막 채널, 대사 효소, 구조단백질까지 다양하게 영향을 미친다. 단백질들은 O2-와 H2O2의 활성에 매우 민감하며 구성의 70% 이상이 ROS의 표적이 될 수 있다. 정상 조건에서는 산화적 변형이 가역적이지만, 병리적 조건에서는 비가역적 산화 반응으로 흘러가며, 결국 단백질의 분해, 세포 사멸로 이어진다.
7.1. 고혈압에서 산화-환원 신호전달
산화적 변형은 단백질의 구조와 기능에 영향을 주며, 이로 인해 많은 분자 및 세포의 과정들에도 영향을 미친다. Protein kinase G의 산화는 cyclic GMP 없이 활성이 발생되어 혈관 이완 효과를 갖는다. 산화에 의한 MAPK의 활성은 혈관과 심장에 염증, 증식, 비대, 이동성 등에 영향을 미치며 이러한 것들은 심혈관 재형성 및 고혈압에 의한 조직 손상까지 유발할 수 있다.
산화적 스트레스에 의해 조절되기 쉬운 또 다른 단백질은 구조단백질인 actin이다. Actin의 산화는 중합반응뿐만 아니라, actin 결합 단백질인 vinculin과의 결합에도 영향을 미친다. ROS는 염증성 케모카인 및 사이토카인의 발현을 조절하는 NF-kB와 HIF-1 (hypoxia-inducible factor)를 활성화시켜서 대식세포 및 염증세포들의 유입 및 활성을 일으키고, 이는 심혈관 염증 및 섬유화를 유발한다. ROS는 심혈관계의 Ca2+ 결합 단백질 및 채널의 cysteine 산화를 통해 직접적으로 영향을 주기도 한다.
7.1.1. 산화-환원 신호전달과 구획화(Compartmentalization)
ROS에 의한 신호전달에서 중요한 또 한 가지는 세포 내 구획화이다. 항산화제는 세포 전체에 널리 퍼져있기 때문에 O2와 H2O2는 바로 근처의 신호전달 분자에 작용하게 된다. 예를 들면, NOX1은 지질 뗏목(lipid rafts)과 내재화된 소포에 존재하지만 NOX4는 주로 ER과 국소 접착 부위에서 신호가 발생한다. 산화-환원 민감성 신호전달 단백질들 다수가 콜레스테롤이 풍부한 microdomain, 특히 caveolae와 지질뗏목에 주로 분포하여 근처에 민감한 표적과 함께 ROS 생성을 촉진시킨다.
7.1.2. 고혈압에서 산화-환원 신호전달과 inflammasome
Inflammasome은 면역 및 염증세포에서뿐만 아니라, 혈관평활근 세포와 내피세포에서도 중요하며, 고혈압에서의 역할이 점차 밝혀지기 시작했다. NLRP3 (nucleotide-binding and oligomerization domain-like receptor family pyrin domain-containing 3)가 가장 잘 알려져 있으며, 염증 인자, 세포 스트레스, 산화적 스트레스등이 존재할 때 구조가 변형되어 inflammasome을 구성하며 caspase-1을 통한 세포 사멸과 IL-1β, IL-18 등의 염증 인자를 통한 염증 신호를 활성화시킨다.
ROS는 NF-kB 또는 직접 inflammasome에 작용하여 활성화에 중요한 역할을 한다. 혈관평활근 세포에서 산화-환원과 Ca2+ 신호 상호작용에 TRPM2가 중요하게 작용하며, 이는 ROS와 inflammasome 사이의 중요한 연결 고리이다. NLRP3 inflammasome의 활성화는 Ang II와 DOCA/salt 고혈압 및 preeclampsia (자간전증), 폐고혈압, 고혈압성 신병증에서 나타났다. NLRP3 inflammasome의 활성화는 혈관평활근 세포의 표현형 전환, 세포 증식, 혈관 재형성, 고혈압에 기여한다.
7.2. 고혈압에서 티올(thiol) 단백질체(proteome)
고혈압 모델의 혈관에서 protein tyrosine phosphatase와 peroxiredoxins의 sulfenylation과 hyperoxidation이 증가되었고, 이는 plasmalemmal의 NOX1, 소포체의 NOX4의 상향조절을 통한 산화 및 ER 스트레스와 연관되어 있다. 유전적 비만 고혈압 쥐는 지질 대사, 산화-환원 조절, 샤페론 활성과 관련된 단백질들의 carbonylation이 증가되어 있으며, catalase의 carbonylation이 감소되어 대사 증후군이 촉진되며, 심혈관계 위험성이 증가되어 있다.
SHR 랫드의 신장에서 총 자유 티올 함량은 정상쥐보다 유의적으로 낮았으며, 이는 sulfhydryls의 산화의 증가를 의미한다. 이는 감소된 thioredoxin reductase의 활성에 기여한다. 사람의 고혈압에서도 혈장 단백질 carbonyls와 단백질 산화 산물(advanced protein oxidation products)이 증가되었고, 총 티올 수준은 감소되어 있었다. 심혈관 시스템에서 S-nitrosothiols은 주로 보호성 반응들, NOS 활성, 혈관 이완, 심근세포 Ca2+ 항상성, 심장 수축, ATP 합성, 미토콘드리아 에너지 생합성 등을 조절한다.
8. 고혈압에서 산화적 스트레스와 장기(organ) 시스템
산화스트레스는 고혈압의 병태생리에서 역할을 갖는 다양한 시스템과 장기에서 공통된 조직손상 메커니즘이다. 또한, 고혈압 관련 표적 장기 손상은 산화적 스트레스의 결과이다.
8.1. 혈관 시스템
내피 의존성 이완 장애, 동맥 경직 증가, 수축성 강화, 염증, 혈관 석회화 및 재형성 등으로 구성된 혈관병증은 고혈압의 원인이자, 결과이기도 하다. 이러한 과정은 노화와 함께 가속될 수 있다. Ang II는 고혈압 쥐의 대동맥과 혈관세포에서 ROS 생성을 유도하는 첫 번째 혈관 활성 제제이다. 고혈압 환자의 동맥과 Ang II 유도 쥐의 혈관은 NOX1과 NOX2 발현이 증가되어 있고, ROS 생성이 증가되었다.
이러한 과정은 혈관에 과도한 활성, 내피 장애, 혈관 재형성, 염증세포 유입, 경화, 섬유화 등을 일으킨다. 고혈압에 기여하는 다른 ROS 의존성 인자에는 알도스테론, ET-1, 성장인자, 염증 인자, 염분 등이 있다. 알도스테론은 mineralocorticoid 수용체를 통해 NOX1, NOX4를 활성화하여 ROS를 증가시키는 경로를 활성화시킨다. 내피세포에 ET-1을 과발현시킨 쥐는 고혈압과 산화적 스트레스를 보이며, NOX1과 NOX2 발현이 증가되었다.
PDGF, EGF, IGF-1과 같은 성장인자는 중간 비대증, 혈관 재형성, 염증, 섬유화와 같은 산화-환원 의존성 혈관 과정을 증폭시킨다. 또 다른 ROS 공급원은 혈관 주변 지방 조직이다. 이 조직에서는 NOX4가 활성화되어 ROS를 생성하며, 이는 지방 세포 기능과 아디포카인 생산에 중요한 역할을 한다.
8.2. 신장 시스템
신장은 ROS를 포함하는 다양한 과정을 통해 고혈압의 병태생리에 중요한 역할을 한다. 신장에서 ROS 생성이 증가는 혈압 증가를 유발하며, 고혈압을 가속시켰다. 신장 ROS의 주요 공급원은 NOX4이나, 다른 NOXes 또한 일부 역할을 담당한다. H2O2는 전사구체(preglomerular) 혈관 반응성을 감소시키고 수질(medullary) 혈류를 증가 시켜, 나트륨 배출 압력을 조절하는데 중요하지만, 증가된 O2-는 혈관과 세뇨관 기능장애를 유발한다. 신장에서 산화적 스트레스는 레닌 분비를 촉진시키고, 신장 수입성 신경(renal afferent nerves)을 활성화시켜, 사구체 세포 기능장애와 나트륨 항상성의 저해를 일으켜 고혈압 발병에 기여한다. 더욱이 특정 네프론에서 O2- 생산은 Ang II에 대한 반응성을 증가시킨다.
8.3. 중추신경 시스템
뇌에서 산화적 스트레스는 고혈압의 발생에 중요한 역할을 한다. 고립로핵(nucleus tractus solitarii)와 문측복외측연수(rostral ventrolateral medulla)에서 NOX에 의한 ROS 생성은 고혈압 쥐에서 NO 및 전염증성 과정을 포함하는 과정을 통해 교감신경 흥분을 유발한다. 중요한 전뇌 뇌실 주위 기관(circumventricular organ)인 뇌활밑기관(subfornical organ)에서 산화-환원 신호전달은 Ang II 유도 쥐의 혈압 상승을 유도하는 교감 신경 활성화에 중요하다. 뇌활밑기관에서 p22phox 유전자를 소거한 모델에서는 Ang II에 의한 고혈압 반응이 나타나지 않았다.
뇌는 산화적 메커니즘을 통한 고혈압 발생에 관여하는 활발한 레닌-안지오텐신 시스템을 가졌다. 뇌실방핵(paraventricular nucleus)에 Ang II를 급성으로 주입하면, 혈압이 상승하였고, Ang II를 뇌실에 주입하면, NOX 서브유닛 발현 및 O2- 생성이 증가하였다. 만성으로 Ang II를 뇌활밑기관에 주입하고 SOD를 선택적으로 적용한 경우 혈압 상승을 억제하였다. 고혈압 반응을 조절하는 뇌의 산화-환원 표적에 관해서는 잘 알려지지 않았다. 일반적으로, 신경에서 Ang II 신호는 Ca2+를 증가시키고 NOXes를 활성화시키며, 미토콘드리아 ROS 생성을 자극하고, 전압 의존성 칼륨 채널을 조절한다.
8.4. 염증 시스템
초기 연구에서 면역 억제가 신장 경색 후 혈압을 낮추는 것으로 보고되었고, 고혈압에서 선천적 및 적응성 면역계의 역할 및 개시 신호를 찾는 것에 초점을 맞춘 현재 연구에 이르기까지, 염증은 오랫동안 고혈압과 연관되어 왔다. T 세포와 B 세포가 결핍된 쥐는 Ang II 또는 DOCA/염분에 대한 고혈압 반응이 감소되었고, T 세포를 이식한 뒤 혈압 반응이 회복되었다. 고혈압 환자는 혈중 염증성 CD8+ T세포가 증가되었고, 이는 IFN (interferon)-γ, TNF (tumor necrosis factor)-α 등의 발현을 증가시킨다. CD4+ T 세포 역시 고혈압에서 중요하며, IL-17의 발현을 증가 시켜 혈압을 높이고 내피 의존성 이완을 손상시킨다. 단핵구와 대식세포의 결핍은 Ang II에 대한 고혈압 반응을 정상화시킬 수 있다. 나트륨을 흡수한 수지상세포는 NOX2 활성을 통해 ROS를 발생시키고, 이는 T 세포 증식과 IL-17 생성을 자극하여 고혈압을 악화시킨다.
9. 임상적 관점
산화적 스트레스가 고혈압 발병과 관련이 있다는 강력한 전임상 발견에도 불구하고, 이것이 사람에서 증명되기는 더욱 어렵다. 그럼에도 불구하고, 고혈압 환자의 저항성 동맥의 심혈관 및 신장 조직과 VSMC에서 NOX 활성, ROS 생성 및 산화 환원 신호 전달이 증폭된다는 증거들이 실험 모델의 결과와 일치하고 있다. 유전적으로 NOX 결핍 환자들은 고혈류성 이완, 낮은 두께, 감소된 혈중 NOX2 활성, 증가된 NO 활용성 등을 가졌고 혈관 손상도 덜했다. 최근 약 50만 명이 참여한 대규모 연구에서는 NOX4와 NOX5가 새로운 혈압 관련 유전자로 규명하였다.
고혈압 발생에 영향을 주는 후성유전학적 인자들은 특히 발병 초기 단계에 중요한 역할을 한다. ROS가 히스톤 변형, 논코딩 RNA 발현 DNA의 변형, ATP 의존적 염색질 변형을 조절하기 때문에 산화적 스트레스는 중요한 후성유전학적 조절인자이다. 본태성 고혈압에서 발견된 후성유전학적 프로그래밍을 위한 수많은 혈관 표적들이 규명되었다. 히스톤 아세틸화는 산화-환원에 조절되는 HDAC1을 포함하는 과정을 통해 내피에서 eNOS의 발현에 중요한 역할을 한다. 히스톤 메틸화 및 아세틸화는 가역적인 과정이므로, 산화적 스트레스를 줄이는 중재술은 후성 유전학적 변화를 정상화시켜 초기 고혈압 발생을 막는 좋은 방법이 될 수 있다.
많은 연구들이 사람에서 ROS와 혈액 또는 소변의 산화적 스트레스 마커, 혈압 간의 관계를 연구하고 있다. 고혈압 환자들은 혈중 H2O2, 혈액 및 소변의 thiobarbituric acid-reactive substances, oxLDL (oxidized low-density lipoprotein), 8 isoprostane과 같은 산화적 스트레스 마커가 증가되어 있다. 바이오마커의 잠재적 가치가 크기 때문에 좀 더 특이적이거나 직접적인 산화적 스트레스 마커를 규명하는데 관심이 모이고 있다. 항산화 시스템의 마커들도 사람 고혈압에서 보고되고 있다. SOD, glutathione peroxidase, catalase 등의 항산화 효소의 혈액 내 수준이나 활성의 감소가 알려졌다.
고혈압의 병태생리에 있어서 산화스트레스의 중요성이 강조되고 있고 항산화제, ROS 스캐빈저, NOX 억제제 등이 혈압을 낮추는 효과가 있다는 유의미한 결과들이 나타나고 있는 만큼 NOX/ROS를 표적으로 하는 치료법들의 개발에 관심이 증가하고 있다. 그러나, 현재까지 고혈압의 치료를 위한 NOX/ROS 억제제나 항산화제가 없다는 것도 기억해야 할 것이다. 그렇지만, 여전히 이 분야에 대한 수요가 높기 때문에 산화적 스트레스를 줄여 고혈압을 조절하는 치료법을 개발하는 것은 유망한 분야이다.
10. 결론
세포 및 동물 연구 결과들은 ROS, 산화-환원 신호전달, 고혈압 간에 강력한 연결고리가 있음을 보여주었다. 실험적 고혈압에서 NOXes, eNOS 언커플링, 미토콘드리아 ROS, 소포체 스트레스의 중요한 병태생리학적 역할들이 명확해졌다. 이러한 요인들의 공통점은 산화적 스트레스이다. 사람에서 행해진 대규모 항산화제 연구가 실패했음에도 ROS를 표적으로 하는 새로운 약제의 시기, 표적, 전달, 효율 등에 관해 연구해야 할 부분들이 많이 남아있다.
세포 내 특정 구획에서 ROS 생성을 막는 약이나 내제된 항산화 방어를 활성화시키는 약이 희망적으로 보인다. 그러나, 그보다 항산화 효과를 검증할 수 있는 더 나은 바이오마커가 필요하다. 산화-환원 단백질체학은 항산화제의 효과를 검증하는 바이오마커를 규명하는 것 외에도 증가된 산화적 스트레스의 실제 분자 표적에 관한 메커니즘에 대한 시야를 제공할 수 있는 새로운 접근법이다. Inflammasomes, ER 스트레스, ROS 및 미토콘드리아 기능 간의 추가적인 설명은 임상 시료나 고혈압 동물 모델의 조직에서 시스템 생물학 및 시험물질 연구를 통해 얻을 수 있다.
이러한 새로운 기술들은 동물의 고혈압 모델에서 분명하게 확립된 ROS의 역할과 인간 고혈압의 현재 모호한 증거 사이의 모순을 해결할 희망을 보여준다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
이전글
- 나노포어(Nanopore) 단분자 탐지의 응용과 기술 개발에 대한 연구 동향
-
다음글
- 2016∼2019년 국내 종합병원 분리 주요 세균의 항생제 내성률 추이(Kor-GLASS)
관련정보


 pdf_0003837.pdf
pdf_0003837.pdf