기술동향
다중오믹스와 머신러닝 기반의 종양항원예측 알고리즘과 암치료
- 등록일2021-08-11
- 조회수4583
- 분류기술동향 > 플랫폼바이오 > 바이오융합기술
-
자료발간일
2021-08-05
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#다중오믹스#머신러닝기반#종앙항원예측#알고리즘#암치료
- 첨부파일
다중오믹스와 머신러닝 기반의 종양항원예측 알고리즘과 암치료
◈목차
1. 서론(Introduction)
2. 본론(main contents)
2.1. 종양특이항원의 물리 화학적, 생물학적 발생 요인
2.2. 종양특이항원(TSA)와 다른 TAA
2.3. 종양항원을 인식하는 항원제시기능을 가진 세포
2.4. 항원의 uptake에서 T 세포의 priming까지
2.5. Cross-presentation
2.6. 컴퓨터를 이용한 종양항원의 예측
2.7. 종양항원 분석 플렛폼(파이프라인)
2.8. 종양항원을 이용한 다양한 백신치료제
2.9. 백신 면역치료에 대한 한계점
3. 결론(Conclusion)
4. 참고문헌
◈요약문
종양에 대한 면역치료제 개발이 가속화되면서, 종양의 예방적 차원 그리고 치료 목적으로 종양 백신들이 개발되고 있다. 최근 COVID19의 백신 개발과 함께 다양한 형태의 백신들이 주목을 받고 있으며, 단백질 혹은 핵산 형태인 mRNA, DNA vector, 혹은 수지상세포를 이용한 세포의 형태까지 다양한 방법으로 개발되고 있다.
하지만, 백신 기술에 있어 중요한 부분은 타겟 항원을 선정하는 것이다. 종양 백신을 개발하는 데 있어 종양 항원을 인지하는 방법이 성공적인 백신 개발에 중요한 부분이지만, 실제로 종양의 항원의 다양성으로 인하여, off-the shelf 형태의 백신을 개발하는데 어려움을 갖는다. 하지만, 개인 맞춤형 백신의 개발에 있어서 종양항원의 다양성을 극복하는 것은 시간의 문제로 사료된다. 이번 동향에서는 종양항원에 특징, 종류 그리고 이를 예측하기 위한 다중오믹스 데이터와 적용되고 있는 머신러닝 기술에 대해 요약하여 이해를 돕고자 한다.
키워드: 종양항원예측, 종양백신, 다중오믹스, 머신러닝, 암치료
분야: Bioinformatics, Cancer Biology/Oncology, Immunology
◈본문
1. 서론(Introduction)
“종양항원(Tumor neoantigen)”이란 정상적인 조직이나 세포에서 발현하지 않는 새로운 형태의 항원으로 지칭되는 포괄적인 항원을 의미한다 [1-3]. 종양항원과 같은 비정상적인 단백질은 T 세포로 하여금 TCR (T cell receptor)과 MHC 분자 사이에서 교차인지되어, T 세포가 인지하고, 인지되어진 비정상적인 세포는 T 세포의 살세포 기전을 통해 죽음을 맞이한다 [4].
종양항원은 종양특이적 T 세포의 활성에 영향을 미치는 중요한 요소로써, 종양의 면역치료에 대한 반응과 연관되는 이유로 종양항원을 기반으로 한 맞춤형 백신과 T 세포 치료제 개발이 가능하다 [3-6]. 종양항원이 기인하는 데에는 물리 화학적인 이유와 생물학적인 발생 요인들 등 다양한 원인들이 포함된다 [7-9].
돌연변이 이외에도 정상 성인세포에서는 발현되지 않는 후생유전학적인 요인들도 비 정상적인 종양항원을 유발하는 원인이 되기도 한다. 이번 동향에서는 암의 면역치료를 목적으로 하는 종양항원 기반의 의학적 활용에 대하여 논해보도록 한다.
2. 본문(main contents)
2.1. 종양특이항원의 물리 화학적, 생물학적 발생 요인
종양특이항원은 기본적으로 유전체의 변화로 인하여 기인된 돌연변이를 통해 불완전한 단백질 그리고 아미노산의 변화가 유도된 단백질을 생성하게 됨에 따라 생성된다. 이는 SNV (single-nucleotide variant), Indel (insertions and deletion), gene fusion, SV (structural variant), frameshift 돌연변이 등이 대표적인 종양항원을 일으키는 유전체의 변화이다 [10-13].
이러한 유전체의 변화는 다양한 돌연변이 유발인자에 의하여 유도되며, 방사선, 화학물질, 산화스트레스 등이 이에 포함된다. 이러한 물리 화학적인 영향 이외에도 생물학적 외부 인자에 의해서 새로운 형태의 종양항원이 생성되기도 한다 [14, 15]. HPV (Human papillomavirus) 등과 같은 바이러스의 감염은 cervical, oropharyngeal cancer를 만들어 내기도 하고, MCPyV (Merkel cell polyomavirus)와 EBV (Epstein-Barr virus) 또한, 암을 유발함과 동시에 non-self 종양항원인 virus의 특정 항원이 종양항원으로 인식되어진다.
종양항원의 발생은 종양의 약점이자, 면역반응을 통해 종양을 공격할 수 있는 중요한 통로이다. 종양항원의 형태는 돌연변이에 기인할 수 있고, 후생유전학적인 영향에 의해 발생할 수 있으며, 때로는 정상적인 세포보다 과 발현함으로 발생하기도 한다. 하지만 모든 암세포가 종양항원을 발생하는 것은 아니다.
이는 내제적으로 존재하는 MHC 분자와의 결합 여부에 따라 같은 항원이라고 하더라도, MHC 분자의 allele에 따라 그 결과가 상이하다 [16]. 더러는 MHC 분자의 결함이나, 발현 등에 대한 문제점에 의해 항원이 발생하더라도, 종양세포에서 이를 제시하지 못하는 경우도 존재한다. HLA-LOH [17]와 같이 MHC를 인지할 수 있는 분자 1쌍 중 한쪽에 결여가 있다면, 항원에 대한 제시기능이 절반으로 감소되어 종양으로서는 자신을 면역세포에 표지할 수 있는 확률을 감소시킬 수 있다 [18, 19].
이로써, 종양세포는 T 림프구에 의하여 감작되어 사멸될 수 있는 가능성이 낮아지게 된다. 이러한 경우를 제외하고, 종양항원에 대한 의학적 적용 범위는 여전히 유효하다.
2.2. 종양특이항원(TSA)와 다른 TAA
종양특이항원과는 달리 TAA (tumor associated antigen)는 종양세포 이외에도 정상적인 세포에서도 발현된다 [20]. 일방적으로 TAA는 정상세포에 비하여 발현 정도가 높으며, MHC1 분자로 노출이 된다는 점에서 T 세포에 반응을 할 법도 하지만, 실제로 T 세포들은 self 항원을 인지하지 못하도록 교육을 받는다.
즉, 종양항원이라고 인지하지 못하도록 흉선에서 positive selection을 통해 자기 세포를 인지하는 T 세포는 사멸시키고 만다. 따라서, TAA를 인식하기 위한 T 세포가 결여되어 있다. 반대로 TAA, CGA를 강하게 인지하는 T 세포가 체내에 높은 비율로 존재한다면, 정상세포를 공격할 수 있는 자가면역반응에 노출될 수 있는 가능성도 배제할 수 없다.
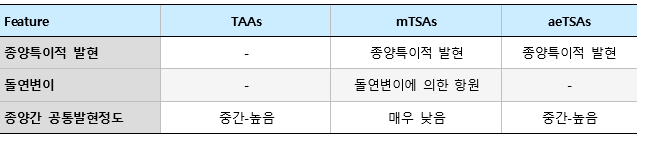
이러한 의미에서 백신 등의 후보군으로 TAA, CGA를 일반적으로 활용할 수 있지만, 자가항원으로써의 가능성이 높기 때문에 이러한 부분을 극복해야 할 필요가 있다. 반대로 TSA의 종양특이성으로 가능성이 높지만, 환자들이 서로 공통적인 돌연변이를 가질 수 있는 가능성이 낮다. TSA의 경우는 다시 2가지로 나뉠 수 있는데, mTSA (mutated tumor-specific antigen)와 aeTSA (aberrantly tumor-specific antigen)로 구분되어진다 [21].
이 둘의 차이점은 돌연변이에 의하여 기인되어진 항원 혹은 정상적인 성인 세포에서는 발현하지 않는 암 특이적인 MAP (MHC associated peptide)를 의미한다 (그림 1). 후자의 경우, canonical onco-fetal 유전자들은 정상적인 경우 성인세포에서 발현되지 않는다.
하지만, 특별한 경우 정상적인 성인세포에서 발현이 발견되기도 하는데, open reading frame의 변화에 의하여, MAGEA3와 같은 cancer-specific epigenetic change, frameshift translation, splicing aberrations 등을 통해 만들어지는 경우다. 전자인 mTSA에 비하여, aeTSA의 발생빈도가 높으며, 암 환자에서 나타나는 공통적으로 나타날 수 있는 빈도수가 높은 편이다. MAGE와 같은 항원이 이에 포함된다 [22].
표 1. 종양항원의 종류와 특징.
2.3. 종양항원을 인식하는 항원제시기능을 가진 세포
종양항원을 인지하는 시작점은 항원을 인식할 수 있는 항원제시세포 [23]로 dendritic cell, macrophage, B cell, basophils, eosinophils 등이 존재한다. 최근에는 gamma-delta T cell도 항원제시기능이 있다고 보고 되고 있다 [24, 25]. 앞서 언급한 다양한 세포가 가진 항원제시에 대한 기능적차이가 있다.
종양항원제시기능과 밀접한 기능을 하는 MHC 분자의 종류와 더불어 Co-stimulatory 분자인 B7-1/2와 같은 분자는 항원제시에 중요한 역할을 하는데, 이에 대한 차이가 naive T 세포를 활성화하는데 중요한 역할을 한다. 특히, dendritic cell은 macrophage와 B 세포와 비교하여 B7 분자가 표면에 높은 비율로 발현한다. 뿐만 아니라, 항원제시 기능과 더불어, cytokine의 종류에 따라 T 세포의 분화의 방향이 결정된다.
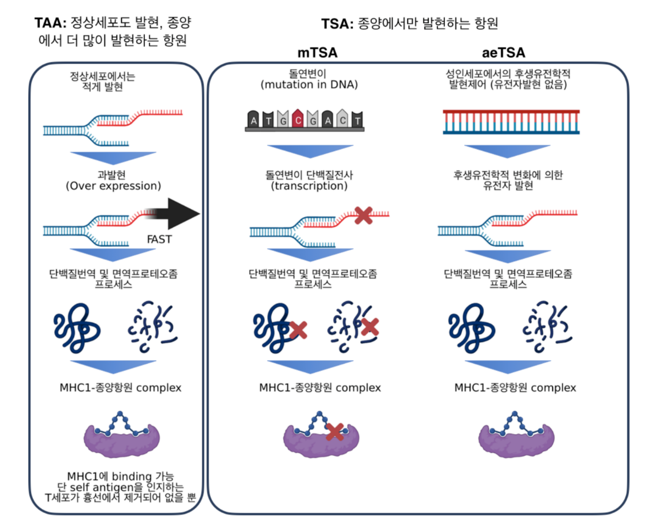
그림 1. 종양항원의 종류와 특징
2.4. 항원의 uptake에서 T 세포의 priming까지
종양항원을 인식하는 가장 첫 번째 단계는 항원을 uptake 하는 것이다. 현재까지 보고되어 있는 항원을 취하는 방식은 3가지 정도로 보고 되고 있다. 일반적으로 잘 알려져 있는 phagocytosis, macropinocytosis 그리고 receptor mediated endocytosis로 구분된다. phagocytosis는 세포 내부로 들어온 항원이 phagosome과 함께 반응하여 early endosome 형태로 발달한다.
macropinocytosis는 macropinosome의 형태에서 앞서 early endoscope 형태로 합쳐지게 된다. Receptor mediatedendocytosis의 경우에는 receptor에 매게 하여 약 190 KDa 크기의 clathrin과 반응하여, clathrin-coated vehicle 형태를 만들게 된다 [26-28]. clathrin은 cell membrane, trans-golgi network, endosome 등 일종의 cytoplasm의 trafficking에 관여하는 중요한 요소로 잘 알려져 있다.
Dendritic cell의 표면에서 외부 항원을 좀 더 빠른 속도로 uptake를 하기 위한 receptor들은 C-type lectin-like receptor, Fc receptor, integrins, scavenger receptor, CD91, aquaporin 등이 이에 포함되며, 종양에 있어서 특히 주목받는 scavenger receptor인 CD36, LOX-1, AXL, MER, Tyro3 등이 이에 포함된다 [29-31].
앞서 3가지 형태로 종양제시세포의 내부에서 MHC 분자와 결합하기 위한 단백질의 분해 단계가 시작된다. 종양의 항원을 확보한 항원제시세포의 내부에서는 단백질을 분해하기 위한 proteasome의 활성화가 진행된다. 8-11 mer 크기의 MHC에 결합하기에 적합한 크기의 peptide는 TAP 단백질을 통과해서 ER에 도달한다.
평상 시에 ER에서 calreticulin과 결합하고 있는 MHC1 분자는 B2M 분자와 결합하고, 이에 MHC1 분자에 결합력에 따라서, BiP/ERp57 complex와 해리한 뒤에 MHC1/B2M 분자와 peptide는 항원으로서 결합하게 된다. 최종적으로 MHC1-epitope complex는 Golgi를 통과하여 세포의 표면으로 이동하게 되며, TCR과 결합하는 T 세포를 priming 하여 항원을 타겟으로 하는 종양특이적인 T 세포가 만들어지게 되는 것이다.
MHC2 분자의 경우에는 MHC1 분자와는 달리 proteosome을 통과할 필요 없이 곧바로 MHC2에 결합하게 된다. 이는 MHC2 분자의 형태 때문인데, 항원을 인식하는 MHC2 두 분자의 양쪽이 열려있어, 크기와는 상관없이 binding 되기 때문이다. 일반적으로 교과서에 나와 있는 데로 MHC1 분자는 CD8+ CTL을 MHC2 분자는 CD4+ T cell을 priming하게 된다 [32, 33].
2.5. Cross-presentation
Cross presentation은 병원체나 종양에 대한 T 세포의 반응을 이끌어 내기 위한 중요한 면역기전이다. 현재까지도, dendritic cell이 외부의 exogeneous 항원이 어떻게 MHC1/CD8+으로 유도하는 지에 대한 부분이 완전히 이해되지 않고 있다. 현재까지 가장 유력한 기전으로는 Cytosolic pathway 그리고 vacuolar pathway로 두 가지의 방법이 있다 [34].
Cytosolic pathway는 phagocytosis로 들어온 외인성 항원이 phagosome으로 들어와 cytosol로 다시 항원이 노출된다는 점이 특이점이다. 이는 이어 proteasomal degradation 과정을 거친 이후에, 적당한 크기의 peptide가 phagosome의 TAP으로 다시 들어와 MHC1에 로딩되는 것 그리고 ER의 TAP을 거쳐 MHC1에 로딩하는 경로를 갖는다.
다른 방법으로는 phagosomal degradation과 MHC1에 대한 로딩이 동시에 진행되는 것이 vacuolar pathway이다. 이 두 가지 방법은 dendritic cell subset마다 차이가 있는데, CD8+ dendritic cell과 CD103+ dendritic cell 모두에서 cross-presentation이 강하게 나타난다. 반면, 랑게르한스세포나 lymphoid CD8 DC, migratory CD103- DC에서는 이러한 과정이 나타나지 않는다. Cross-presentation의 기능적 차이는 궁극적으로 항암 백신 치료제를 개발하는데 있어 중요한 역할을 할 것으로 예상한다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보


 pdf_0003844.pdf
pdf_0003844.pdf