기술동향
전사의 기계적 조절: 최신 동향
- 등록일2021-08-19
- 조회수4632
- 분류기술동향 > 플랫폼바이오 > 바이오융합기술
-
자료발간일
2021-08-17
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#전자조절#유전자발현 #후생유전체#기계적신호
- 첨부파일
전사의 기계적 조절: 최신 동향
◈목차
1. 세포와 조직의 물리적 환경에 대한 반응
2. 세포의 기계신호 감지 장치
3. 전사와 염색질 분포의 기계적 조절
3.1. 세포-기질 상호작용의 유전자 발현 조절
3.2. 세포 연접으로부터의 신호
3.3. 세포핵의 액틴과 마이오신
3.4. 기계적 자극에 의한 염색질 분포 조절
3.5. 기계적 힘에 반응한 전사 측정
4. 생리적인 기계적 자극들
4.1. 기계적 상호작용이 망가진 암
4.2. 조직 경직화의 생화학적, 생물리적 과정
4.3. 물리적 신호와 세포의 형질전환: 3차원 세포배양 시스템의 발전
5. 살아있는 세포에서 기계적 힘과 염색질 구조를 통합시켜주는 주요 기술들
6. 결론 및 향후 전망
◈요약문
기계신호전달(mechanotransduction)이란, 세포가 주변 환경으로부터 기계적 신호를 감지하여 이를 생화학적 신호로 변환 시켜 적절한 유전자 발현이나 세포반응을 유발할 수 있는 기능을 일컫는다. 본 리뷰에서는 기계적 전사 조절 연구의 최근 동향과 기계신호전달에서 새로 알려진 주요 기작으로써, 후생유전체의 기계적 조절 그리고 기계적 신호와 유전자 발현의 연결 고리를 밝히는데 중요한 최근 기술적 발전에 대해 기술해 보겠다.
특히, 암의 진행을 조절하는 주요 기작으로써 기계신호전달의 중요성을 역설하고, 기계적 신호의 감지 및 전사 조절에 관한 보다 많은 분자 수준의 기작 연구의 필요성을 강조할 것이다.
키워드: 기계신호전달, 유전자 발현, 전사 조절, 후생유전체, 기계적 신호
분야: Cancer Biology/Oncology, Cell_Biology, Molecular_Biology
◈본문
1. 물리적 환경에 대한 세포와 조직의 반응
우리 몸 속의 세포들은 여러 단계에서 다양한 기계적 자극을 받고 있다. 분자 수준에서는 면역세포의 수용체들이 리간드들을 구분할 때 힘을 이용하고, 세포 수준에서는 기계적 신호가 줄기세포의 분화 방향이나 암세포의 이동 전략 결정에 관여한다. 기질의 견고성은 암세포의 힘 생성 능력을 바꾸고, 이는 곧 암세포의 전이 가능성과 연계된다. 끝으로, 상처 치료나 암의 진행 그리고 조직의 항상성 유지 같은 복합적인 과정들은 물리적으로 주변 미세환경과 직접적으로 연결되어 있다.
세포들은 주변 환경으로부터 가해지는 수동적인 기계적 자극(예: 주변 환경의 경직성)이나, 능동적인 기계적 자극(예: 세포나 조직이 생성한 힘)에 적절히 반응하기 위해서, 이러한 기계적 변화를 인식하고 그 변화 정도를 가늠할 수 있어야 한다. 세포 내 각각의 요소들은 다 같이 세포의 구조적 완결성을 유지하거나, 외부환경으로부터의 기계적 자극을 감지하는 일을 수행한다.
이러한 외부 자극들은 결국 핵으로 전달되어, 염색질의 구조와 접근성에 폭넓은 변화를 유발하게 된다 (그림 1). 비록 유전체 성형에 기계적 힘들이 끼치는 영향은 이제 잘 받아들이게 되었지만, 여전히 기계신호전달과 관련된 분자 수준에서의 기작은 수수께끼로 남아있다. 본 리뷰 논문은 암의 진행에 초점을 두면서 기계신호 감지와 유전자 전사 사이의 상호작용을 이해하는 데에 기여한 최근 연구들을 소개할 것이다 (그림 1).
2. 세포의 기계신호 감지 장치
기계신호 감지 장치는 크게 두 가지로 분류할 수 있다: (1) 세포막 수용체, 초점접착역(Focal adhesion), 세포 연접, 액토미오신(actomyosin) 세포골격으로 이루어진 근접 기계신호 감지 장치, (2) 핵막 단백질들이다. 부착세포들은 초점접착역의 인테그린(integrin)들이 세포를 세포외 기질(extracellular matrix, ECM)에 연결해 준다. 힘이 가해지면, 인테그린의 구조가 변형되면서, ECM과 강한 캐치본드(catch bond, 당기는 힘)가 생기게 되고 초점접착역들이 생성 및 성숙된다.
초점접착역들은 α-actinin, talin, vinculin과 같은 어댑터 단백질들을 통해 액틴(actin) 세포골격과 연결되고, 이는 곧 세포의 주요한 힘 비축 요소가 된다. Adherence junction (AJ) 이나 tight junction (TJ)과 같은 세포 연접 구조물들 또한 기계신호 센서로 작동한다.
AJ는 cadherin 계열 세포막 투과 단백질들로 이뤄져 있는데, 이들 또한 catenin을 통해 액틴과 연결된다. AJ에 힘이 가해지면, α-Catenin의 구조가 벌어지면서 vinculin이 결합할 수 있는 부위가 노출되어, vinculin이 AJ로 오게 되고 actin이 더 잘 결합하게 된다. TJ는 claudin과 occludin 계열의 세포막 투과 단백질들로 이뤄져 있고, 이들은 액틴이나 microtubule과 연결된다. 액틴 세포골격은 기계적 자극에 대응하여, 재빠르게 자신의 구조를 재형성할 수 있는 매우 역동적이고 다형성인 구조물이다.
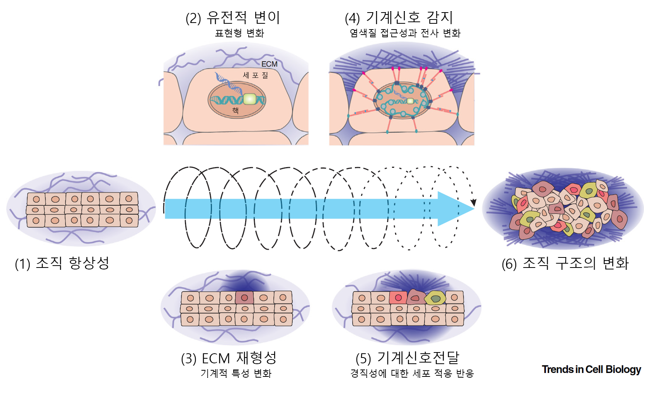
그림 1. 물리적 환경, 세포의 기계신호 감지, 유전자 전사 사이의 역동적인 상호작용.
(1) 세포는 주변 세포와 세포외기질의 물리적 특성을 감지하고 그에 반응한다. (2) 종양 유발은 곧 세포의 재프로그래밍을 시작시킨다. (3) 전사유전체의 변화는 ECM단백질과 결합 단백질들의 분비에 변화를 가져와서 ECM의 유동학적 특성을 변화시킨다. (4) ECM의 물리적 변화는 주변 세포들에게 감지되고 이렇게 세포에 가해진 물리적 힘은 핵으로 전달되어 생화학적 신호와 전사 조절에 영향을 끼친다. (5) 세포와 ECM의 유동학적 변화는 세포 연접을 통해 주변 세포로 전달되어 적응을 유도한다. (6) 이러한 상호 피드백은 나아가 조직의 구조에 변화를 가져온다.
세포 내에서 가장 크고 딱딱한 기관인 핵 역시, 세포골격이나 힘들로부터 분리돼 있지 않다. “LINC (Linker of Nucleoskeleton and Cytoskeleton)”라 불리는 구조는 핵과 세포골격을 연결시켜 주는데, 유전자 발현과 기계적 힘 전달 모두를 조절한다. “Nesprin”이라는 단백질은 외부 핵포막(outer nuclear membrane, ONM)을 관통해 세포질 쪽에 있는 세포골격과 연결된다.
한편, 핵질 쪽을 향한 ONM의 nesprin은 SUN 단백질과 결합하는데, 이 SUN 단백질은 내부 핵막(inner nuclear membrane, INM)에 붙은 채 핵의 lamina와 결합해주는 역할을 한다. Lamina는 A형과 B형의 lamin 단백질로 이뤄져 있고, ECM의 경직성이나 세포의 기하학적 구조에 따라, lamin의 발현량이 달라지며 핵막의 경직성을 조절한다. 기계적 힘을 감지하는 것 외에도, 핵은 게놈을 보호하기 위하여 가해진 스트레스에 신속하게 반응한다.
LINC 구조체로부터 핵을 분리하기 위해 직접 힘을 가하면, 핵막 단백질인 emerin이 INM에서 ONM으로 이동하게 되면서 핵이 경직된다. 압착력을 가하게 되면, 핵이 힘 측정기로써 작동하며, 핵 모양에 따라 세포 반응이 결정된다. 압착은 핵막의 장력을 증가시키고, 핵막에 저장돼 있던 칼슘 이온을 방출시키면서, 인지질 가수분해 효소인 cPLA2를 활성화 시켜, 액토미오신 수축을 자극하게 된다.
기계적으로 세포를 늘리면 유사하게 칼슘 이온이 방출되는데, 이는 이질 염색질(heterochromatin)의 소실로 인한 핵의 연화(softening)를 유발한다. 액틴 세포골격과 핵은 서로 협업하며, 기계적 힘을 감지하고 세포로 하여금 이러한 힘에 적응하게 해준다. 기계적 신호 자극을 인식하는 다른 이온 채널들도 있지만, 본 리뷰의 주제에서 벗어나므로 다루지 않았다.
3. 전사와 염색질 분포의 기계적 조절
3.1. 세포-기질 상호작용의 유전자 발현 조절
초점접착역은 ECM에 결합하는 세포의 근접 기계신호 감지 장치가 된다. 세포와 ECM 사이에서 물리적인 연결고리를 제공하는 것 외에도, 기계신호에 반응하는 유전자의 발현도 조절한다 (보다 자세한 내용은 Kechagia et al. PMID: 31182865 참조). 큰 기계적 장력이 가해지면, 인산화 효소와 다른 신호전달 단백질들이 초점접착역 근처에 모이게 된다.
예를 들어, 액틴 스트레스 섬유가 형성되면, FHL2 (four and a half LIM domains 2) 단백질이 초점접착역과 결합하면서, 유전자 발현과 연결시키게 된다. 약한 기계적 스트레스를 받는 세포에서는(예를 들어, 부드러운 기질 위의 세포), FHL2가 핵으로 이동하여 p21 유전자의 프로모터 부분에 축적되면서 세포분열을 억제하게 된다.
유체 전단 응력(fluid shear stress, FSS)이나 세포외기질 경직성, 지형(topography)과 같은 수동적, 능동적 기계 자극들은 세포골격의 재배열을 야기한다. Hippo 신호전달 체계의 단백질인 YAP (yes-associated protein 1)과 TAZ (transcriptional coactivator with PDZ-binding motif)는 장기 크기 조절에 중요한 역할을 수행한다고 알려져 있는데, 기계적 신호에 반응하는 유전자 전사 조절 매개체로도 알려져 있다.
예를 들어, 기계적 스트레스가 증가된 세포에서는(높은 전단력 혹은 기질 경직성에 노출된 세포) YAP/TAZ가 핵에서 주로 발견되고, 이곳에서 세포 분열, 장기 성장, 종양 형성 등을 유도하는 몇 가지 전사 인자들의 조절매개체 역할을 수행한다. 인테그린이 ECM의 fibronectin에 결합하면, FAK (focal adhesion kinase)가 FAK/Src/PI3K 신호전달 체계를 통해, YAP을 핵으로 이동시키게 된다.
그러면 YAP/TAZ는 액틴 조절 단백질이나 초점접착역 단백질들의 발현을 조절함으로써, 초점접찹역과 액틴 구조체를 더욱 강화 시킨다. YAP/TAZ의 조절 기작은 참고문헌 (Totaro et al. PMID: 30050119)에서 매우 잘 리뷰되어 있으며, YAP/TAZ의 핵으로의 이동은 이제 기계신호전달 체계의 마커로써도 종종 이용되고 있다.
3.2. 세포 연접으로부터의 신호
세포 연접 또한 세포분열 접촉저지와 같은 세포의 운명을 결정하는 데에 필수적인 기계적 신호를 제공한다. 이러한 신호들은 cadherin이나 claudin과 같은 접착 단백질을 통해 전달되는데, E-cadherin은 catenin이나 YAP을 조절한다고 알려져 있다. 이축성(biaxial)의 기계적 팽창 시, cadherin 결합체를 구성하는 YAP과 β-catenin은 E-cadherin에 의존해서 세포주기를 시작시킨다.
TJ 단백질로 알려진 claudin-6는 SFK (Src-family kinases)를 활성화 시킨다고 알려져 있는데, 이는 곧 RARγ (retinoic acid receptor γ)나 ERα (estrogen receptor α)와 같은 핵수용체의 활성화를 유발한다.
일반적인 핵수용체나 특정 스테로이드 호르몬 수용체는 몇 몇 종류의 암에서 중요한 역할을 수행하는 전사 인자들이다. 특히, 내분비계 신호전달 체계는 최근에 YAP/TAZ 신호체계와 연관되어 있음이 밝혀졌다. 예를 들어, GR (glucocorticoid receptor)의 활성화는 YAP의 mRNA 발현과 핵으로의 이동을 증가시킨다. 이러한 변화는 fibronectin의 침착 증가와 동반되었는데, 앞서 말한 대로 YAP 조절에 FAK/Src/PI3K 신호전달체계가 연관되어 있다는 추가적인 단서를 제공해 준다.
3.3. 세포핵의 액틴과 마이오신
힘을 생성하는 역할 이외에도, 액틴과 액틴 결합 단백질들(actin binding proteins, ABPs) 그리고 마이오신이 다양한 기작을 통해 전사를 조절하는지 연구되고 있다. 한 개의 액틴 단백질은 작은 ABP인 cofilin과 결합한 채 “Importin-9”이라는 구조체를 통해 활발하게 핵 안으로 들어오고, profilin과 결합하여, Exportin-6를 통해 핵 밖으로 나오게 된다.
핵 안에서 한 개의 액틴 분자는 “PIC (Pre-initiation complex)”라는 구조의 일부를 이루게 되고, 전사 신장(transcription elongation)에 관여한다. 액틴은 RNA 중합효소 II (RNA polymerase II, Pol II)를 인산화 시키는 P-TEFb와 결합하여 보다 많은 전사를 촉진하게 된다. 액틴은 또한 전사 인자들의 세포 내 위치를 직접적으로 조절하기도 한다.
예를 들어, SRF (serum-response factor)의 전사 공활성화 인자(transcriptional coactivator)인 MRTF-A (myocardin-related transcription factor A)는 액틴 단분자와 결합한다. 혈청 자극은 액틴의 중합반응 유발하고, 단분자 액틴을 MRTF-A로부터 분리시키며, 핵 안으로 이동 시켜 SRF와 결합시킨다. 이러한 반응은 mDia1/2 formin 단백질과 LINC 구조체를 통해 결합된 세포질과 핵 안의 액틴 구조체에 의존한다.
나아가 핵 안의 마이오신 I과 마이오신 IV은 Pol II와 복합체를 구성하는데, 마이오신 IV는 에스트로겐 수용체(Estrogen receptor, ER)와 결합하며 전사 조절 부위로 이동하게 된다. 이러한 연구들은 세포골격 단백질들이 전사 조절과 세포의 힘 전달 및 반응 등 신호 전달 분자로써, 이중 기능을 수행한다는 것을 보여준다.
3.4. 기계적 자극에 의한 염색질 분포 조절
상당히 중요한 연구들이 세포골격과 핵막 단백질들의 역할은 밝혀냈지만, 세포외기질과 염색질 분포 사이의 상호작용은 잘 알려져 있지 않다. 이는 특히 세포외기질의 경화가 정상세포를 암세포로의 변형을 촉진시키는 병적인 상황에서 중요하다. 최근의 고분자 제조 화학의 발전은 기계적 신호가 어떻게 세포의 전반적인 후생유전 상태와 전사를 조절하는지 직접적으로 측정할 수 있게 해주었다.
일련의 경화도를 갖고 있는 히드로겔(hydrogel)에서 세포를 배양하면, 특정 조직의 경화 정도에 상응하는 히드로겔에서 자라는 세포는 그 조직에 특이적인 전사 인자들을 발현한다.
지형적인(topographic) 신호는 후생유전 조절자로써 작용하면서, 다양한 히스톤 아세틸화와 메틸화를 일으킨다. 광 변환 가능한(photoconvertible) –빛에 의해 경직화와 유화가 가능한- 히드로겔을 이용한 연구에서는, 경직된 지형에서 자란 인간 간엽 줄기세포는 염색질 재형성 과정(chromatin remodeling)이 일어나고, 이는 곧 증가된 HAT (histone acetyltransferase)와 감소된 HDAC (histone deacetylase)로 나타난다는 것을 보여주었다.
이러한 변화들은 온전한 LINC 구조체를 필요로 하는데, 이는 곧 핵-세포골격 결합이 염색질 재형성에 필수적이라는 것을 재확인 시켜주는 것이다. 흥미롭게도, 경직된 재질에서 세포를 장기간 키울 경우 빛으로 히드로겔을 유화 시키더라도 세포는 핵 구조를 바꾸지 못하는데, 이는 곧 세포배양 시 생리적인 조직경화도의 중요성을 나타낸다.
반면, 기계적으로 팽창시킨 표피 간세포(epidermal progenitor cell)에서는 INM으로부터 ONM으로 emerin이 재분포 되면서 H3K9me2,3 감소와 PRC2 (polycomb repressive complex 2)에 의한 H3K27me3의 증가를 유발하고, 이는 전반적인 전사의 억제로 이어진다. ONM의 emerin은 액틴에 결합하면서, 핵 주변을 액틴으로 덮고, 다른 F-액틴 구조들을 조절한다. 이는 곧 핵의 G-액틴 양과 Pol II의 활성을 감소시킨다.
H3K9me3가 표지된 이질 염색질의 소실은 액틴과 무관한 핵의 유화를 가져오고, 이는 곧 세포로 하여금 게놈을 보호하면서 변형 에너지(strain energy)를 소멸시킬 수 있게 해준다. 보다 긴 시간 동안 세포는 세포골격과 AJ를 조정하며 변형 에너지를 재분포 시킴으로써 핵의 힘 전환(force transduction)을 차단하고, 세포로 하여금 원래의 후생유전 상태로 돌아가게 한다.
기질의 강직성과 압축력/인장력 외에, 세포의 기하학적 구조 역시 핵의 구조, 염색질 구조, 그리고 유전자 발현을 조절한다. 조그만 원형에서 섬유아 세포를 키우면 길쭉한 사각형 모양에서 키운 세포에 비해 핵에서 증가된 염색질과 핵막의 역동성을 보게 되고, 염색체간 접촉에 변화가 생기며, 핵 속의 HDAC3 양이 증가하는 것을 보게 된다.
경직된 재질에서처럼, 섬유아 세포를 옆면이 막힌 곳에서 장기간 키우면 탈분화와 재프로그래밍으로 이어지고 이는 곧 노화된 섬유아 세포를 젊게 만드는 데에 활용될 수 있다. 이러한 발견들은 기계적인 자극들이 다양한 형태로 가해지면서, 세포별로 특화된 생리현상이나 치료법에 중요한 영향을 끼치며 후생유전체를 각기 다른 방식으로 조절할 수 있음을 보여준다.
3.5. 기계적 힘에 반응한 전사 측정
지금까지 언급한 연구들은 기계적 자극들이 초점접착역, 세포 연접, 혹은 YAP/TAZ를 통해 직접적으로 생화학적 자극으로 연결된다는 것을 보여주었다. 생리적인 힘들이 물리적으로 어떻게 염색질 구조를 바꾸고 생화학적 신호전달 체계와 유전자 발현을 조절하는지는 활발히 연구되고 있는 분야이다.
기계적인 변화에 대한 직접적인 전사 반응을 측정하기 위해서, 자성을 이용한 세포분석법으로(magnetic twist cytometry) 조절된 힘을 세포에 가한 뒤 FISH (fluorescence in situ hybridization) 기법으로 염색질 팽창과 유전자 발현을 조사하였다. 그 결과, 생리적인 수준에서의 힘은 염색질을 늘어나게 할 수 있고, 외부에서 넣어주었거나 내재하는(endogenous) 기계자극 반응 유전자 모두 발현을 증가시킬 수 있음을 발견하였다.
이러한 유전자 발현 증가는 H3K9me3에 의존적이었으며, 또한 유전자 위치와 핵막과의 거리 그리고 H3K9me3의 정도가 힘에 따른 유전자 발현 상향조절과 관련 있음을 시사한다. 개념적으로는 매우 유력하지만, 이러한 연구들은 아직도 기계적 힘이 어떻게 유전자 발현을 조절하기 위해 염색질 접근성을 변형시키는지에 대한 답들은 제시하지 못하고 있다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보


 pdf_0003851.pdf
pdf_0003851.pdf